在非小细胞肺癌(NSCLC)的精准治疗时代,EGFR酪氨酸激酶抑制剂(TKI)虽已成为一线标准,但耐药问题,尤其是第三代TKI耐药后的治疗困境,仍是临床面临的严峻挑战。2025年世界肺癌大会(WCLC)上,我国自主研发的EGFR×HER3双特异性抗体偶联药物(ADC)——BL-B01D1(iza-bren)公布了突破性数据,无论是在TKI耐药后的单药治疗,还是联合奥希替尼的一线治疗中,均展现出前所未有的疗效潜力,为攻克耐药难题带来了全新曙光。【肿瘤资讯】特别邀请广州医科大学附属第一医院周承志教授从呼吸科临床视角出发,结合WCLC最新进展,深入剖析当前EGFR突变NSCLC的全程管理现状与核心挑战,并探讨以BL-B01D1为代表的创新ADC疗法如何重塑未来诊疗格局,及其在推动多学科协作、提升患者长期获益中的深远意义。
特邀嘉宾——周承志教授
广州医科大学附属第一医院副院长、国家呼吸医学中心临床诊疗部部长
在国际上率先提出并发表“重症肺癌”“肿瘤呼吸病学”等理念,第一版“重症肺癌国际共识”“肺癌合并COPD诊疗国际共识”
学术任职:
中华医学会呼吸分会肺癌学组副组长
中国呼吸肿瘤协作组(CROC)秘书长兼青委副主委
广东省医师协会肿瘤重症专委会主委
第二届“人民好医生-金山茶花-肺癌领域杰出贡献奖”、第五届“羊城好医生”、第一届“广州实力中青年医生”、第一批广东省医师协会“名医绝技”。
从呼吸科视角来看,您如何看待当前EGFR突变NSCLC患者从一线治疗到后线治疗的全程管理现状?尤其在第三代EGFR-TKI耐药后,临床实践中面临的核心挑战是什么?
周承志教授:从呼吸科的临床实践来看,EGFR突变NSCLC患者的全程管理在过去十年中取得了显著进步。第三代EGFR-TKI(如奥希替尼)的出现,极大地改善了一线治疗的疗效,将患者的中位无进展生存期(PFS)延长至前所未有的水平。目前,一线治疗模式也正从单一靶向治疗向联合治疗演进,例如EGFR-TKI联合化疗或EGFR/cMET双抗,旨在进一步提升疗效深度和持久性。
然而,尽管取得了这些成就,耐药问题依然是全程管理中不可避免的巨大挑战。尤其在第三代EGFR-TKI耐药后,临床实践中我们面临的核心挑战主要体现在以下几个方面:
1. 治疗选择有限且疗效不佳:目前,第三代EGFR-TKI耐药后的标准治疗仍以含铂双药化疗为主。然而,化疗的客观缓解率(ORR)仅为20%~36% ,中位PFS仅约4-5个月,且伴随明显的毒性,严重影响患者的生活质量[1]。虽然一些联合抗血管生成药物的方案略有改善,但未能从根本上突破疗效瓶颈。
2. 免疫治疗效果受限:免疫检查点抑制剂在EGFR突变NSCLC患者中的疗效普遍不佳,单药ORR仅为10%~30% ,甚至存在超进展的风险,这使得免疫治疗在这一特定人群中的应用受到限制[2]。
3. 肿瘤异质性与复杂耐药机制:EGFR突变NSCLC在耐药后往往表现出高度的肿瘤异质性,涉及多种复杂的耐药机制,如旁路激活、组织学转化等。这使得单一靶点或传统化疗难以有效应对,亟需能够多维度、广谱覆盖耐药机制的创新疗法。
4. 患者生活质量与治疗依从性:随着疾病进展,患者的身体状况通常较差,对治疗的耐受性降低。现有后线治疗方案的毒性往往较大,导致患者依从性下降,难以获得长期持续的治疗。
因此,在第三代EGFR-TKI耐药后,如何为患者提供更有效、更持久、更安全的治疗选择,是当前呼吸科医生面临的紧迫而巨大的临床需求。
近年来,以ADC为代表的新型药物为NSCLC治疗带来了革新。您认为像BL-B01D1这类靶向EGFR和HER3的双特异性抗体偶联药物,其作用机制对于克服TKI耐药、解决临床挑战有何特殊意义?结合本次WCLC公布的数据,您如何评价它在一线联合及后线单药治疗中的潜力?
周承志教授:ADC药物的出现确实为NSCLC治疗带来了革命性的突破,而BL-B01D1(iza-bren)作为全球首创、新概念的EGFR×HER3双特异性抗体偶联药物,其作用机制对于克服TKI耐药、解决临床挑战具有里程碑式的特殊意义。
作用机制与克服TKI耐药的特殊意义:iza-bren通过EGFR和HER3双靶点协同作用,将新型拓扑异构酶I抑制剂有效载荷精准递送至肿瘤细胞。
1. 双靶点协同,克服异质性:EGFR和HER3在EGFR突变NSCLC中广泛表达,且在TKI耐药机制中扮演关键角色。双靶点设计能够更有效地识别和结合肿瘤细胞,即使在肿瘤异质性高或单一靶点表达下调的情况下,也能通过双重识别提高药物的入胞效率,从而更有效地递送细胞毒药物,克服单一靶点治疗的耐药问题。
2. 精准杀伤,降低毒性:ADC的“导弹”效应使其能够精准靶向肿瘤细胞,减少对正常组织的损伤,从而在提高疗效的同时,降低传统化疗带来的全身性毒副作用。
3. 新型载荷,广谱抗肿瘤:新型拓扑异构酶I抑制剂有效载荷具有强大的细胞毒性,能够有效杀伤肿瘤细胞,且其作用机制与TKI不同,有助于克服TKI耐药。
结合本次WCLC公布的数据,iza-bren在一线联合及后线单药治疗中的潜力巨大,在一线联合治疗方面:本次WCLC公布的iza-bren联合奥希替尼一线治疗EGFR突变NSCLC的II期研究数据令人振奋 [3]。在iza-bren 2.5 mg/kg D1D8 Q3W剂量组中,我们看到高达100%的客观缓解率(ORR)和100%的疾病控制率(DCR),确认的ORR也高达95%。这意味着所有患者均能实现肿瘤显著缩小和缓解,有效克服了肿瘤异质性。更令人鼓舞的是,中位随访12.5个月时,中位缓解持续时间(mDoR)和中位PFS尚未达到,12个月PFS率高达92.1%,12个月OS率高达94.8%。这些初步数据显示的疗效,在ADC一线治疗EGFR突变NSCLC的探索中达到了新的高度,展现出卓越的临床潜力。同时,该联合方案的安全性良好,主要为可控的血液学毒性,且导致停药率低,未报告发热性中性粒细胞减少症。这表明iza-bren联合奥希替尼有望重新定义EGFR突变NSCLC的一线治疗标准,引领肺癌靶向治疗进入一个新的时代。
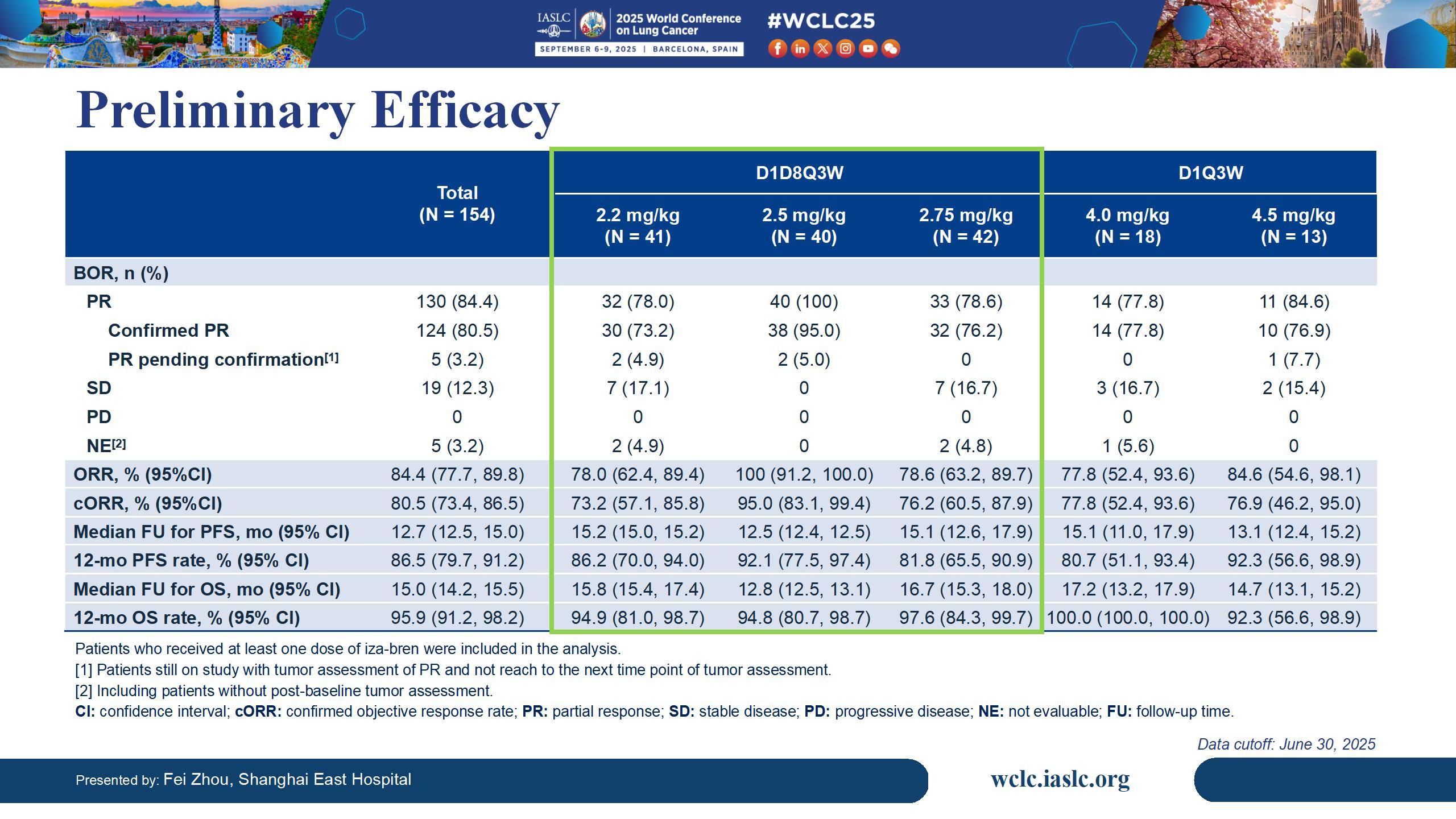
在后线单药治疗方面:针对EGFR-TKI耐药患者,iza-bren单药治疗的I/II期研究结果同样具有突破性[4]。在未经化疗的EGFR-TKI耐药患者亚组中,iza-bren展现出66.0%的ORR和90.0%的DCR,大多数患者(94%)肿瘤缩小,中位DoR长达13.7个月。最重要的是,中位PFS长达12.5个月,这一数据在针对经治EGFR突变NSCLC患者的后线治疗研究中取得了突破性进展,显著优于现有含铂化疗及其他联合方案的疗效。中位随访20.5个月时,中位OS仍未达到,18个月OS率高达69.2%,彰显了iza-bren在长期生存方面的获益潜力。其安全性良好,不良反应可控且可管理,因TRAEs导致的治疗终止率极低(1.2%),间质性肺病(ILD)发生率也非常低(0.6%)。这一结果提示,iza-bren单药治疗模式有望简化当前复杂的后线联合方案,避免毒性叠加,也为TKI进展后更早地介入治疗提供了强有力的证据,具备了改变EGFR-TKI耐药后治疗格局的巨大潜力。
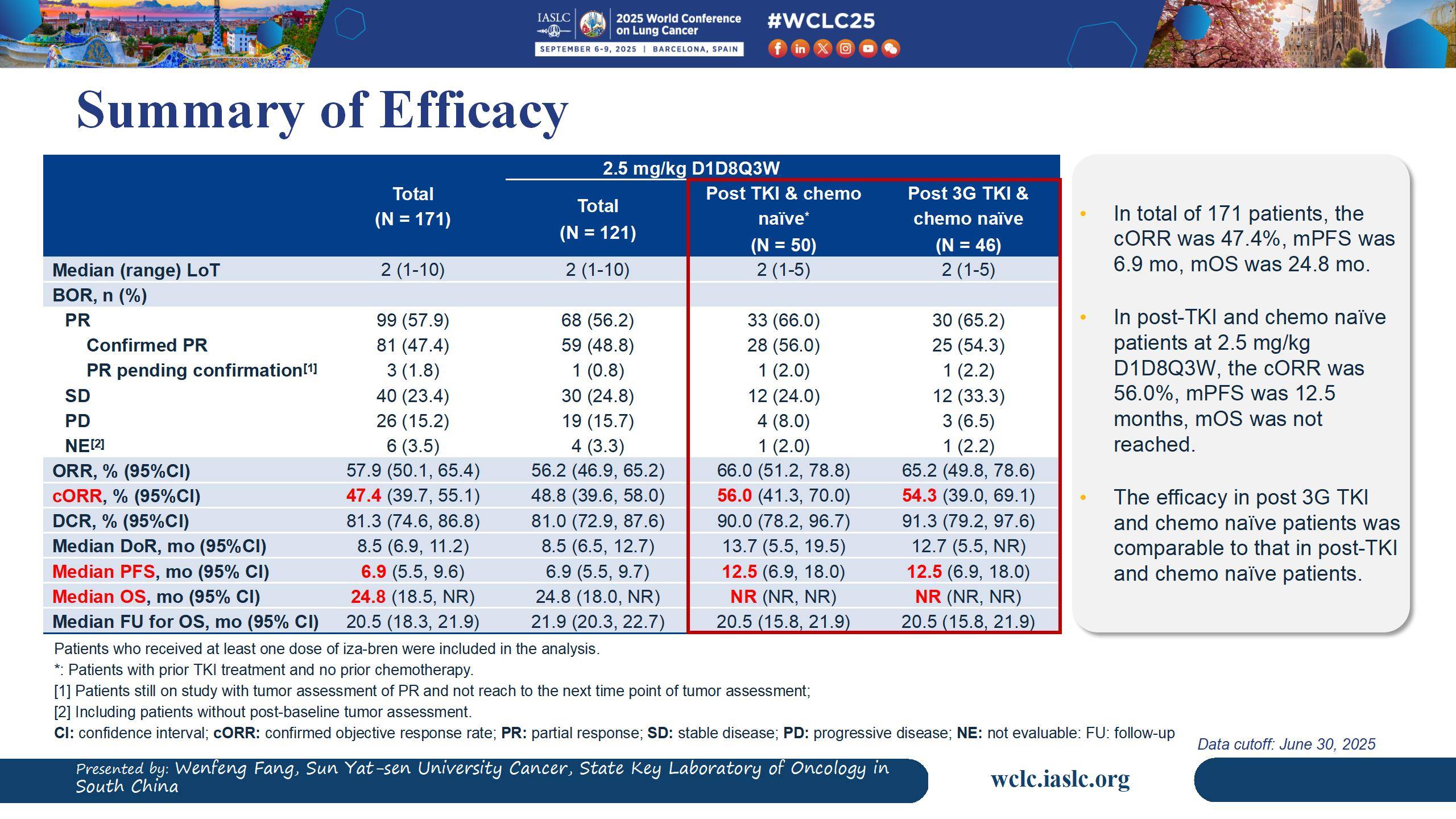
综上所述,iza-bren凭借其独特的双靶点作用机制和WCLC公布的突破性临床数据,无论是在一线联合还是后线单药治疗中,都展现出巨大的潜力,有望为EGFR突变NSCLC患者带来更深、更持久的缓解和生存获益。
展望未来,您认为以双抗ADC为代表的创新疗法将如何整合入现有的NSCLC诊疗体系?对于推动呼吸科与肿瘤科在肺癌多学科诊疗(MDT)中的协作,以及提升患者长期获益,您有何见解与期待?
展望未来,以iza-bren为代表的双抗ADC创新疗法,无疑将深刻影响并重塑现有的NSCLC诊疗体系,并对多学科诊疗(MDT)协作提出新的要求和机遇。
双抗ADC创新疗法整合入现有诊疗体系的路径:
1. 一线治疗新标准:鉴于iza-bren联合奥希替尼在一线治疗中展现出的100%ORR和高PFS/OS率,一旦III期临床研究(如NCT06838273)获得确证性数据,该方案有望成为EGFR突变NSCLC患者新的标准一线治疗选择,尤其对于肿瘤负荷高、异质性强的患者,可实现肿瘤的深度杀伤和持久缓解。
2. 后线治疗优先选择:在第三代EGFR-TKI耐药后,iza-bren单药治疗的突破性PFS数据(12.5个月)使其有望替代传统化疗,成为未经化疗的EGFR-TKI耐药患者的优先选择。正在进行的III期研究(NCT06382116和NCT07100080)将进一步验证其疗效和安全性,推动其进入临床指南。
3. 早期介入策略:iza-bren在EGFR-TKI耐药后早期介入治疗的巨大潜力,将促使我们重新思考治疗时机。未来,我们可能会在患者出现TKI耐药后,更早地考虑使用双抗ADC,以期最大化延长患者的长期生存。
4. 精准治疗的深化:随着对ADC药物作用机制和耐药谱的深入理解,结合基因检测和生物标志物研究,我们将能够更精准地筛选出最适合接受双抗ADC治疗的患者,实现真正的个体化精准治疗。
推动呼吸科与肿瘤科在肺癌MDT中的协作,以及提升患者长期获益的见解与期待:双抗ADC等创新疗法的出现,使得肺癌诊疗的复杂性进一步增加,这更加凸显了多学科诊疗(MDT)模式的重要性。
1. MDT协作的深化与常态化:
呼吸科的独特贡献:呼吸科医生在肺癌的早期筛查、诊断、支气管镜介入、肺功能评估以及围手术期管理和并发症处理方面具有不可替代的专业优势。在MDT中,呼吸科医生能够提供全面的患者肺部状况评估,为治疗方案的制定提供重要依据,尤其是在ADC药物相关的间质性肺病(ILD)的早期识别、鉴别诊断和及时干预方面,呼吸科医生凭借其在肺部影像学和呼吸系统疾病诊疗上的专业优势,能够为患者安全保驾护航,这是MDT中不可或缺的一环。
肿瘤科的核心作用:肿瘤科医生则专注于肿瘤的系统性治疗,包括靶向治疗、免疫治疗、化疗以及ADC药物的选择、剂量调整和不良反应管理。他们对最新药物进展和耐药机制的理解是MDT成功的关键。
紧密协作,全程管理:我期待呼吸科与肿瘤科能够建立更紧密的协作机制,定期进行MDT讨论,从患者确诊伊始就共同参与,制定并动态调整全程管理策略。这包括从一线治疗方案的选择,到耐药后的二线、三线治疗,甚至包括对患者生活质量的关注和支持治疗。
2. 提升患者长期获益的期待:
延长生存,改善生活质量:以iza-bren为代表的双抗ADC药物,通过其高效、持久的抗肿瘤活性和可控的安全性,有望显著延长EGFR突变NSCLC患者的PFS和OS,同时最大程度地保障患者的生活质量,减少因治疗毒性导致的治疗中断。
打破耐药困境,提供更多希望:这些创新疗法为长期困扰我们的TKI耐药难题提供了新的解决方案,为那些曾经无药可用的患者带来了新的希望。
推动中国创新走向世界:iza-bren作为中国自主研发的全球首创药物,其在国际舞台上的卓越表现,不仅提升了中国在全球肺癌研究领域的地位,也激励更多中国创新药物走向世界,最终惠及全球患者。
总之,双抗ADC等创新疗法是肺癌治疗领域的重要里程碑。我坚信,通过呼吸科与肿瘤科的紧密协作,以及MDT模式的不断优化,我们能够更好地整合这些前沿技术,为EGFR突变NSCLC患者提供更精准、更有效、更人性化的全程管理,最终实现患者长期生存和生活质量的双重提升。
1. Ramalingam S, Belani C. Systemic chemotherapy for advanced non-small cell lung cancer: recent advances and future directions. Oncologist. 2008;13(1):5-13.
2. Haslam A,Prasad V. Estimation of the percentage of US patients with cancer who are eligible for and respond to checkpoint inhibitor immunotherapy drugs[J]. JAMA Netw Open,2019,2(5):e192535.
3. Zhou F, et al. Phase II Study of Iza-Bren (BL-B01D1) Combo With Osimertinib in EGFR Mutated Locally Advanced or Metastatic NSCLC Patients. 2025 WCLC. OA10.04.
4. Fang WF, et al. Phase I/II Study of Iza-Bren (BL-B01D1) as Monotherapy in Patients With Locally Advanced or Metastatic EGFR Mutated NSCLC. 2025 WCLC. OA10.03.
排版编辑:Yuki











 苏公网安备32059002004080号
苏公网安备32059002004080号


