瑞波西利联合芳香化酶抑制剂(AI)作为激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性转移性乳腺癌的一线治疗方案,目前已获得广泛应用。韧带样纤维瘤(DTF)是一种罕见的局部侵袭性软组织肿瘤,仅占所有乳腺肿瘤的0.2%,其影像学表现可能与恶性肿瘤相似。本病例报告描述了一例44岁绝经前女性患者,诊断为HR阳性、HER2阴性仅伴骨转移的乳腺癌,在接受瑞波西利联合AI治疗30个周期后,出现乳房内快速增大的肿块。影像学检查提示乳腺癌进展,遂行全乳切除术。然而术后病理结果证实为硬纤维瘤,该情况极为罕见,且此前未见文献报道。本病例提示,在对转移性乳腺癌患者制定治疗计划及随访过程中,除临床与影像学评估外,必要时应进行组织病理学检查,以明确诊断并指导后续治疗策略。
病例报告
一名44岁绝经前女性因左乳房外上象限(UOQ)出现可触及肿块至我院门诊就诊。患者无婚姻史、无生育史,不吸烟,亦无创伤史、口服避孕药使用史、乳房假体植入史或任何特殊家族史。
体格检查发现左侧UOQ有一不规则、质硬肿块,大小约3.0 × 2.5 cm,伴有皮肤和乳头回缩。初次乳腺X线片显示左侧UOQ有一4.4 cm的高密度肿块,伴有皮肤回缩,提示皮肤侵犯,左侧腋窝有一1.3 cm的增大淋巴结(图1A)。乳腺超声和磁共振成像(MRI)显示,左侧UOQ有一3.5 × 1.3 × 3.3 cm的不规则低回声主肿块,伴有乳头和皮肤侵犯,左乳房有多中心病灶,左侧腋窝I级有两个可疑淋巴结(图1B和C)。
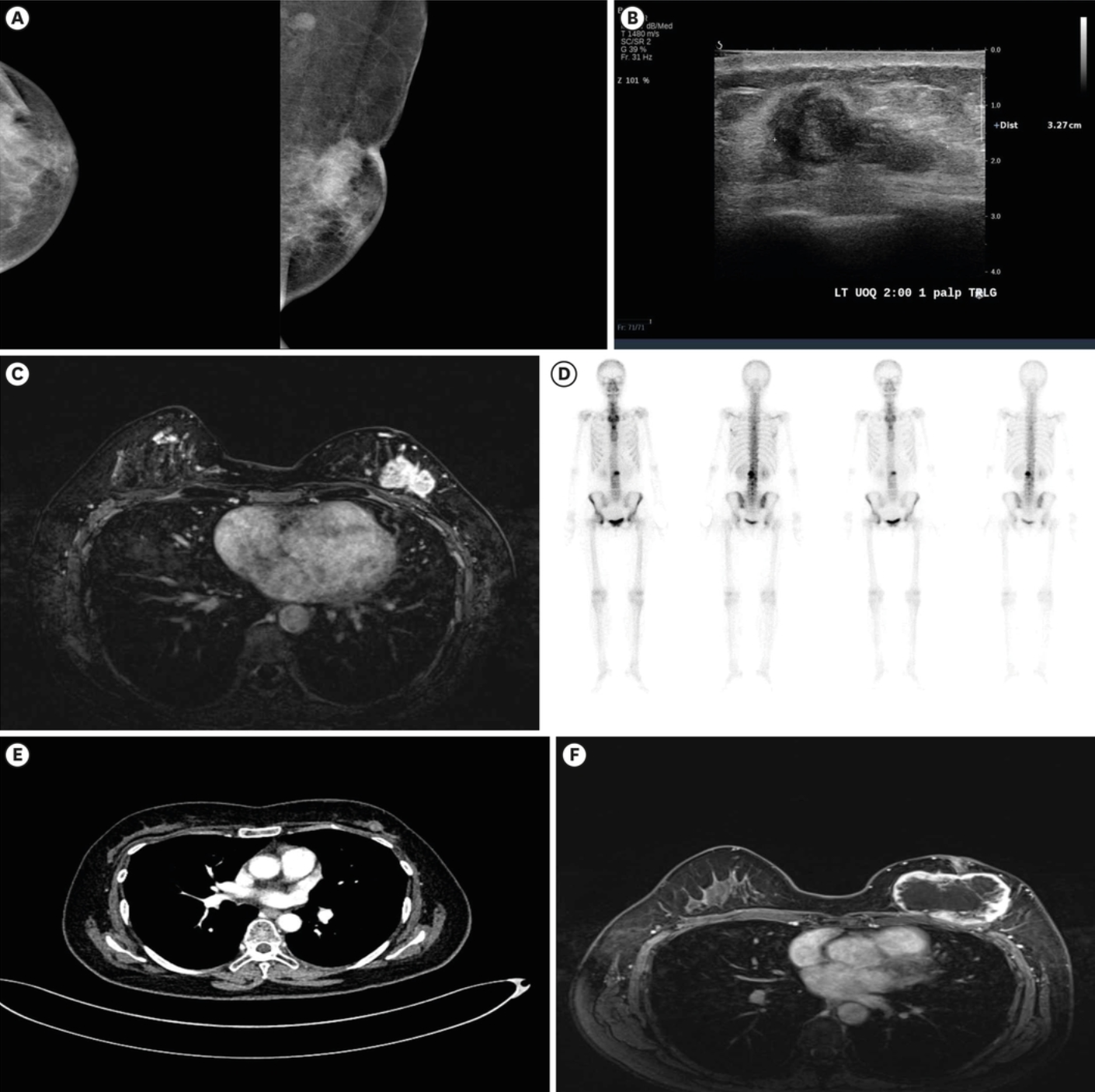 图1 乳腺和转移性病变的影像学表现(A)初始乳腺X线片:左侧UOQ有一4.4 × 2.1 cm的高密度肿块,伴有皮肤回缩,提示皮肤侵犯,左侧腋窝有一增大的淋巴结。(B)初始乳腺超声:左侧UOQ的3.5 × 1.3 × 3.3 cm不规则低回声肿块经证实为恶性肿瘤。(C)初始T1动态减影增强MRI:证实左乳外侧半部有恶性肿瘤(3.4 × 2.4 × 4.1 cm),伴有皮肤和乳头回缩。(D)初始骨扫描:T5、L2和双侧坐骨有多发骨转移病灶。(E)接受24个周期瑞波西利和芳香化酶抑制剂治疗72周后胸部计算机断层扫描(左乳房肿块1.3 cm)。(F)接受30个周期治疗90周后MRI:左乳房可见一个7.6 × 5.0 cm的环形增强肿块,形态和边缘不规则。UOQ = 乳房外上象限;MRI = 磁共振成像。
图1 乳腺和转移性病变的影像学表现(A)初始乳腺X线片:左侧UOQ有一4.4 × 2.1 cm的高密度肿块,伴有皮肤回缩,提示皮肤侵犯,左侧腋窝有一增大的淋巴结。(B)初始乳腺超声:左侧UOQ的3.5 × 1.3 × 3.3 cm不规则低回声肿块经证实为恶性肿瘤。(C)初始T1动态减影增强MRI:证实左乳外侧半部有恶性肿瘤(3.4 × 2.4 × 4.1 cm),伴有皮肤和乳头回缩。(D)初始骨扫描:T5、L2和双侧坐骨有多发骨转移病灶。(E)接受24个周期瑞波西利和芳香化酶抑制剂治疗72周后胸部计算机断层扫描(左乳房肿块1.3 cm)。(F)接受30个周期治疗90周后MRI:左乳房可见一个7.6 × 5.0 cm的环形增强肿块,形态和边缘不规则。UOQ = 乳房外上象限;MRI = 磁共振成像。
乳房肿块的核心穿刺活检结果为非特殊类型浸润性乳腺癌。根据Allred评分系统,患者被诊断为雌激素受体:8,孕激素受体:8,C-erbB2:阴性的Luminal A型乳腺癌。患者无血行性肺部或腹部转移,但经骨扫描和腰椎经皮骨活检证实存在T2和T5脊柱转移性癌(图1D)。根据《美国癌症联合委员会第八版癌症分期》,临床分期为T2N1M1;因此,患者接受了瑞波西利+AI+戈舍瑞林醋酸酯联合地诺单抗的一线姑息性化疗。
在开始一线姑息性化疗前,全血细胞计数显示白细胞增多和血小板增多(白细胞:16,240/μL,血红蛋白:16.4 g/dL,血小板:970,000/μL);因此,进行了骨髓检查,证实为JAK2 V617F突变阳性(49.3%)的骨髓增殖性肿瘤。治疗方案中增加了阿司匹林(100 mg/天)。在接受72周(24个化疗周期)的胸部计算机断层扫描后,左乳房的主病灶显著缩小至1.3 cm(图1E),骨转移病灶也保持稳定。患者继续接受瑞波西利 +AI+戈舍瑞林醋酸酯姑息治疗18周(额外6个化疗周期)。
在完成90周(30个周期)瑞波西利+AI+戈舍瑞林醋酸酯姑息治疗后的评估中,肿瘤标志物和骨转移病灶持续显示病情稳定;然而,一个形状和边缘不规则的环形增强肿块突然增大,占据了整个左乳房(7.6 × 5.0 cm),并伴有肌肉和皮肤侵犯(图1F)。鉴于病灶的快速增大、临床症状以及影像学表现高度提示局部复发,因此在未进行核心穿刺活检的情况下,进行了改良根治性乳房切除术。术后活检显示,左乳房肿块大小为8.5 × 8.0 cm,大体标本呈结节状,局部浸润至周围脂肪组织;但在乳头或皮肤中未观察到癌症成分(图2A)。
淋巴结中观察到反应性淋巴样增生。对切除标本进行了全切片制备,并使用标准染色(苏木精-伊红或过碘酸-希夫反应)和补充免疫组织化学检查(广谱细胞角蛋白、CD34、CD31、S-100、结蛋白、β-连环蛋白和平滑肌肌动蛋白[SMA])。免疫组织化学检查结果为:广谱细胞角蛋白、CD34、CD31、S-100和结蛋白均为阴性,患者被诊断为β-连环蛋白和SMA阳性DTF(图2B-J)。
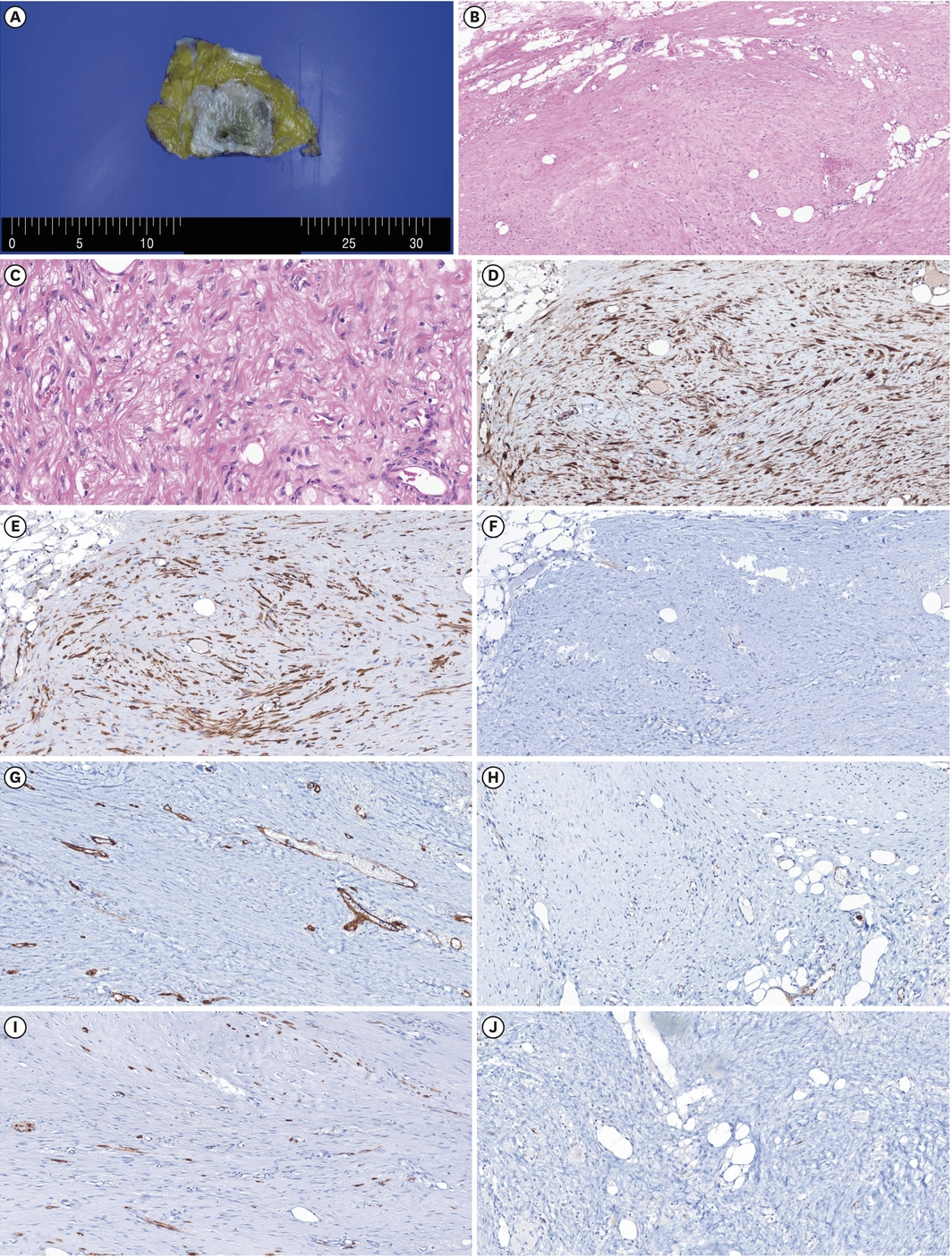 图2 硬纤维瘤的组织病理学和免疫组织化学特征(A)DTF的大体外观通常呈肿大的结节状肿块,局部浸润到周围脂肪组织。(B)纤维瘤病浸润到周围乳腺实质。其不规则边界在影像学上可与浸润性癌高度相似(H & E, ×100)。(C)高倍镜下可见长而交错的梭形细胞束,显示轻度异型性(H & E, ×400)。(D)DTF显示β-连环蛋白在细胞核中呈异常模式(原始放大倍数, ×200)。(E)DTF显示平滑肌肌动蛋白阳性染色,可见无有丝分裂象的梭形细胞(原始放大倍数, ×200)。(F)DTF显示广谱细胞角蛋白阴性染色(原始放大倍数, ×200)。(G)DTF显示CD34阴性染色(原始放大倍数, ×200)。(H)DTF显示CD31阴性染色(原始放大倍数, ×200)。(I)DTF显示S-100阴性染色(原始放大倍数, ×200)。(J)DTF显示结蛋白阴性染色(原始放大倍数, ×200)。DTF = 硬纤维瘤;H & E = 苏木精和伊红。
图2 硬纤维瘤的组织病理学和免疫组织化学特征(A)DTF的大体外观通常呈肿大的结节状肿块,局部浸润到周围脂肪组织。(B)纤维瘤病浸润到周围乳腺实质。其不规则边界在影像学上可与浸润性癌高度相似(H & E, ×100)。(C)高倍镜下可见长而交错的梭形细胞束,显示轻度异型性(H & E, ×400)。(D)DTF显示β-连环蛋白在细胞核中呈异常模式(原始放大倍数, ×200)。(E)DTF显示平滑肌肌动蛋白阳性染色,可见无有丝分裂象的梭形细胞(原始放大倍数, ×200)。(F)DTF显示广谱细胞角蛋白阴性染色(原始放大倍数, ×200)。(G)DTF显示CD34阴性染色(原始放大倍数, ×200)。(H)DTF显示CD31阴性染色(原始放大倍数, ×200)。(I)DTF显示S-100阴性染色(原始放大倍数, ×200)。(J)DTF显示结蛋白阴性染色(原始放大倍数, ×200)。DTF = 硬纤维瘤;H & E = 苏木精和伊红。
尽管患者因疑似疾病进展而接受了全乳切除术,但最终诊断为良性DTF。患者目前正在继续第36个周期的瑞波西利 + AI + 戈舍瑞林醋酸酯联合地诺单抗治疗,方案未作更改。
讨论
硬纤维瘤(DTF)是一种罕见的侵袭性非恶性间叶源性肿瘤,好发于育龄期女性的腹壁或躯干部。乳腺DTF较为少见,病因尚未完全明确,已知与既往创伤、家族性腺瘤性息肉病、乳腺癌病史以及乳腺手术操作有关。一项单中心为期25年的研究显示,25%的乳腺DTF患者曾有乳腺癌手术史,44%曾接受过隆胸、缩胸或活检等乳房整形手术。DTF通常于术后11至179个月(中位时间24个月)出现,且多位于原乳腺癌手术区域。
在临床和影像学表现上,乳腺DTF常与恶性肿瘤相似。其典型特征为可触及的质硬肿块,可伴皮肤回缩;在假体植入患者中还可能表现为包膜挛缩。影像学检查常呈现可疑恶性征象:乳腺X线提示恶性的比例在38%至92%之间;超声多显示为低回声实性肿块,伴后方声影及边缘不规则;乳腺MRI脂肪抑制T2加权像常见不规则环形强化及快速洗脱动力学曲线,进一步增加恶性疑虑。本例患者的肿块紧邻胸大肌,不能排除肌层侵犯,并伴有皮肤回缩。既往研究表明,DTF在T2加权MRI上可呈高信号,动力学曲线模式因个案而异;但所有经MRI检查的DTF患者均因影像表现被归类为可疑恶性。
DTF的诊断需依赖免疫组织化学检测,典型表现为原癌蛋白标志物β-连环蛋白及SMA阳性。约80%的病例中可见β-连环蛋白与SMA阳性染色,但β-连环蛋白表达并不具特异性,亦可见于梭形细胞癌、化生性乳腺癌及良性叶状肿瘤。若β-连环蛋白呈阴性,则需通过排除其他标志物(如CD34、p63、CK5、AE1/AE3、KL-1、MNF-116、结蛋白、S-100、细胞角蛋白及激素受体等)以确立诊断。本例患者的免疫组化结果符合DTF:β-连环蛋白核阳性,SMA局部阳性,细胞角蛋白、CD34、CD31、S-100及结蛋白均为阴性。
对于出现症状、病情进展或影响生活质量的DTF,可考虑手术切除。辅助放疗因未能显著降低复发风险,一般不推荐应用。根据《欧洲共识》,无症状DTF的原发手术已不再作为标准治疗。值得注意的是,积极观察的患者中88.2%在中位42.2个月内病情无进展。
DTF的2年无事件生存率(EFS)约为56.4%,其预后与肿瘤部位有关。腹壁、乳腺、腹腔内及下肢部位的EFS较好,而胸壁、头颈和上肢则预后较差。约10%至29%的乳腺DTF患者可能出现复发。因此,如条件允许,建议行广泛镜下阴性切缘(R0)切除;若切除可能影响功能或外观,也可接受镜下阳性切缘(R1)。
本病例为首例报道在接受CDK4/6抑制剂联合AI及戈舍瑞林醋酸治疗期间,一名新发转移性乳腺癌患者因新出现肿块疑似疾病进展而接受手术,最终病理确诊为DTF的案例。在MONALEESA-2试验中,疾病进展是最常见治疗中止原因(占61.1%)。全身治疗期间出现的肿瘤快速生长常引发进展担忧,但本病例表明,诸如DTF这类良性病变在临床和影像学上亦可摹拟疾病进展。因此,对转移性乳腺癌患者而言,组织病理学确认对于准确诊断和制定后续治疗方案至关重要。
Ha Rim Ahn, Ae Ri Ahn, Hyun Jo Youn. Desmoid-Type Fibromatosis Masquerading as Disease Progression in Metastatic Breast Cancer in a Patient on Ribociclib Therapy: A Case Report. J Breast Cancer. 2025 Aug;28(4):288-294. English.
排版编辑:肿瘤资讯-Annie











 苏公网安备32059002004080号
苏公网安备32059002004080号


