CAR-T细胞疗法在复发/难治性(R/R)B细胞恶性肿瘤和多发性骨髓瘤的治疗中取得了卓越的临床成果,并已有多款产品获批上市。然而,在急性髓系白血病(AML)和T细胞急性淋巴细胞白血病(T-ALL)领域,目前尚无任何相关CAR-T产品获批。对于R/R AML及T-ALL患者而言,治疗选择极为有限,预后不佳,因此开发创新的治疗策略是当务之急。
在此背景下,CD84(SLAMF5)作为一种在多种免疫细胞上表达的细胞表面糖蛋白,进入了研究者的视野。研究显示,CD84在AML的白血病发生过程中扮演着重要作用,抑制其功能可有效降低细胞活力并诱导细胞凋亡。此外,多项转录组和蛋白质组学研究发现,CD84在AML和T-ALL的细胞系及患者样本中均呈高水平表达,CD84或是AML、T-ALL极具潜力的免疫治疗靶点。
近日,《Leukemia》杂志发表的一项开创性研究,首次对靶向CD84的CAR-T细胞疗法(CART84)进行了全面的临床前开发与验证。结果提示CD84在多种血液系统恶性肿瘤中均有表达,是一个极具潜力的泛血液系统靶点,支持CD84 CAR-T细胞疗法作为AML和T-ALL的治疗手段。

研究方法
CD84表达检测(流式细胞术)
通过使用抗人CD84-PE或同型对照抗体染色1×106个细胞,分析CD84的表达。
CAR-T细胞扩增
通过密度梯度法从健康供体或AML患者的外周血单个核细胞(PBMC)中分离T细胞。随后,使用CD3/CD28 Dynabead和IL-2(50 IU/mL)激活、刺激后,并以5的感染复数(MOI)对细胞进行转导。制备好的CAR-T细胞在含有5%人血清和1%青霉素-链霉素的X-VIVO™15培养基中扩增8-10天。
细胞毒性实验
将靶细胞与CAR-T细胞(CAR表达率标准化至40%)按照预设比例培养24-48小时,通过公式计算存活细胞的百分比来评估CAR-T细胞的杀伤效果。
AML和T-ALL异种移植模型
第0天,将1×105 MOLM-13(AML)细胞或7×105 MOLT-4(T-ALL)细胞注入小鼠体内。2-13天后静脉注射3×10⁶-5×10⁶个CART84细胞,通过生物发光成像技术监测肿瘤的进展。
AML和T-ALL患者来源异种移植(PDX)模型
将 1×10⁵个AML PDX细胞或7×10⁵个T-ALL PDX细胞静脉注射至经过放疗处理的小鼠体内。第11天,对小鼠进行5×10⁶个CART84细胞静脉注射。通过每周外周血(PB)检测和每月骨髓穿刺检测监测肿瘤进展。
CD34+人源化小鼠模型
将1×10⁵个CD34+细胞胫骨内注射到经放疗处理的小鼠体内。在确认人CD45+细胞植入率>60%后,在第48天对小鼠进行1×10⁶个自体CART84、CART19或未转导(UT)T细胞静脉注射。通过每周外周血检测和每月骨髓穿刺检测监测骨髓毒性。
统计分析
两组间比较采用t检验,多组间比较则采用单因素方差分析(ANOVA)检验结合Dunnett事后检验进行比较。动物生存曲线采用Kaplan-Meier分析,组间比较采用log-rank(Mantel-Cox)检验,P值<0.05认为结果具有统计学显著意义。
研究结果
靶点验证:CD84是血液系统恶性肿瘤潜在靶点
使用 GEPIA分析 TCGA 数据集发现,与健康对照组相比,CD84 mRNA 表达在弥漫性大 B 细胞淋巴瘤 (DLBCL) 中高4.2倍,在AML中高10 倍。CCLE数据亦显示,多种血液系统肿瘤细胞系均存在CD84 mRNA高表达。
在细胞系水平,研究人员分析了CD84在细胞表面的蛋白表达情况。结果显示,在伯基特淋巴瘤(Ramos)、B-ALL(NALM-6)、AML(MOLM-13和HL-60/S4)及T-ALL(MOLT-4)等多种细胞系中,均检测到CD84高表达(85.3%–95.4%)。
研究者对51名成年AML患者(包括初诊和复发/难治患者)原始细胞的CD84表达情况进行分析,结果显示,在 TP53 突变的 AML 中,CD84表达均处于高水平,中位数为 95%。与 CD123 和 CD33(AML 中的主要 CAR-T 靶点)相比,CD84 表达与 CD33 表达相似(图 1A)。值得注意的是,在 7 例具有 TP53 突变的 AML 患者中,5例患者CD84高表达,2例具有 MECOM 重排的患者CD84表达均> 95%。所有 AML 样本中 CD84 的平均标准化平均荧光强度 (nMFI) 为 26.30(图 1B)。
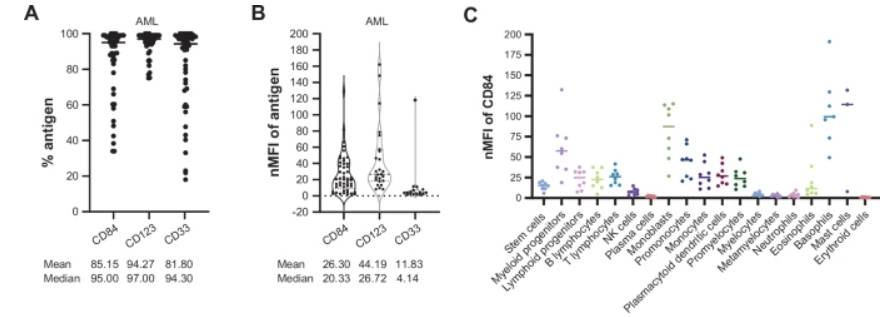
随后,研究者对8例成年患者T-ALL原始细胞中的CD84表达进行分析,发现6例CD84表达超过95%。此外,在17例慢性淋巴细胞白血病(CLL)患者的白血病细胞中亦发现CD84过表达。
技术可行性:CD84 CAR-T细胞可成功构建
研究团队采用鼠源和全人源单链可变区片段 (scFv) 的第二代慢病毒 CAR 载体 (抗 CD84scFv-CD8αH-TM-4-1BB-CD3ζ),成功构建多个靶向 CD84 的 CAR-T 细胞 (CART84)。CART84构建体152.3、153.5、1.226.5、1.7.3、3.89.5和H3.5表现出更高的扩增能力,CAR阳性率超过40%。
鉴于T细胞也表达CD84,研究人员评估了CD84 CAR-T细胞的潜在“自相残杀”问题。结果显示,虽然CD84表达降低可能提示存在自相残杀,但这种现象似乎是限时的,因为到第6天,CART84细胞已显著扩增并达到较高的CAR表达水平。此外,与UT细胞相比,CART84的CD4/CD8比值更高,这可能是由于清除了高表达CD84的CD8+中枢记忆细胞和效应记忆细胞。而且,扩增后的CART84细胞主要呈现中央记忆T细胞表型,这种表型被认为与CAR-T细胞在体内的长期持久性密切相关。
体外实验:CART84展现高效抗肿瘤活性
在体外细胞实验中,所有 CART84 构建体均表现出强效剂量依赖性细胞毒性。其中,CART84 152.3和153.5表现出高效的细胞毒性、强劲的细胞因子分泌能力以及对靶抗原的特异性增殖,是进一步研究的理想候选者。
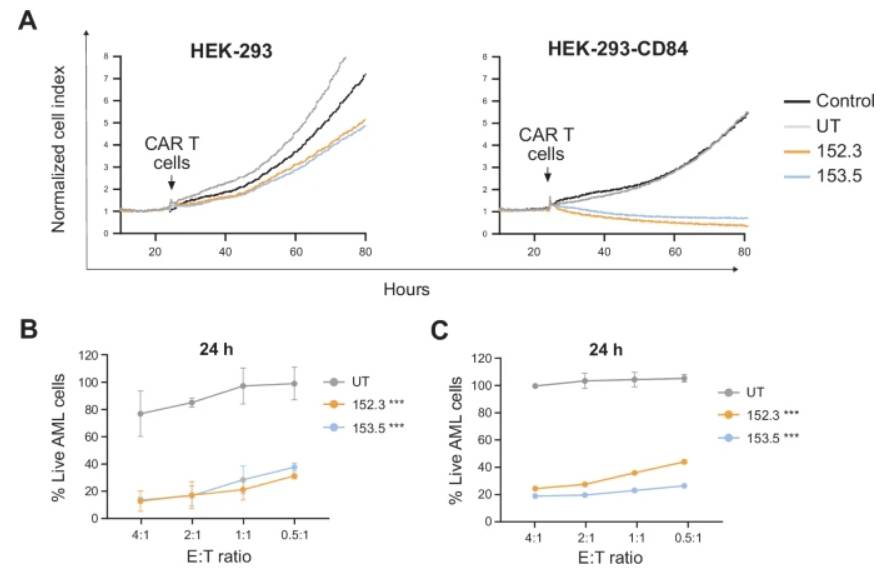
为最终确认其精准靶向特异性,研究人员将其与不表达CD84的HEK-293细胞及经基因工程改造后表达CD84的细胞共培养。结果证实,两种CART84均能选择性地清除CD84表达细胞,而对不表达细胞无任何影响。进一步评估CART84对AML患者原始细胞细胞毒性发现,在24h时CART84产生细胞毒性作用,在48h时作用更为显著。
AML模型疗效
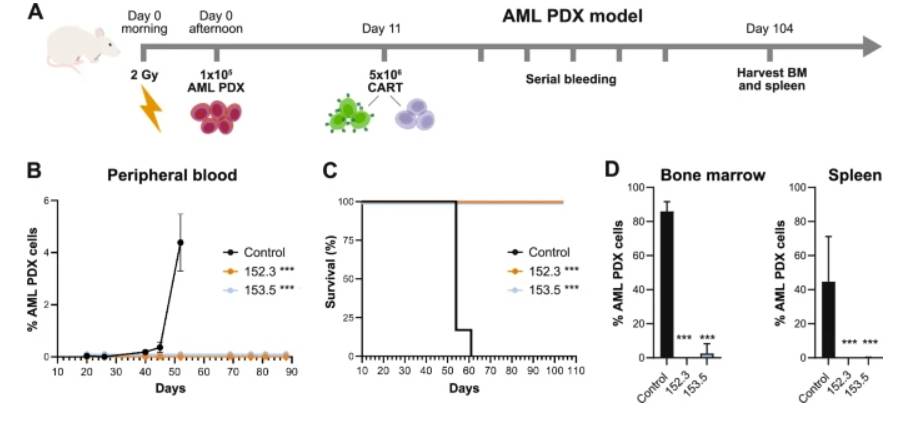
研究人员采用MOLM-13 细胞系评估CART84在AML异种移植模型中的体内疗效。结果发现,两剂注射后,与 UT 治疗组相比,CART84 治疗组小鼠生存率更高。除153.5处理组中的2只小鼠出现髓外肿瘤外,所有CART84治疗的小鼠在实验结束时均未发生白血病。
在 AML PDX 模型中,CART84 152.3 和 153.5 可有效清除肿瘤细胞。在CART84 治疗小鼠的外周血和骨髓中发现,与对照组相比,CART84 治疗组生存期显著延长。在研究结束时,CART84治疗组动物骨髓或脾脏病灶消除。
T-ALL模型疗效
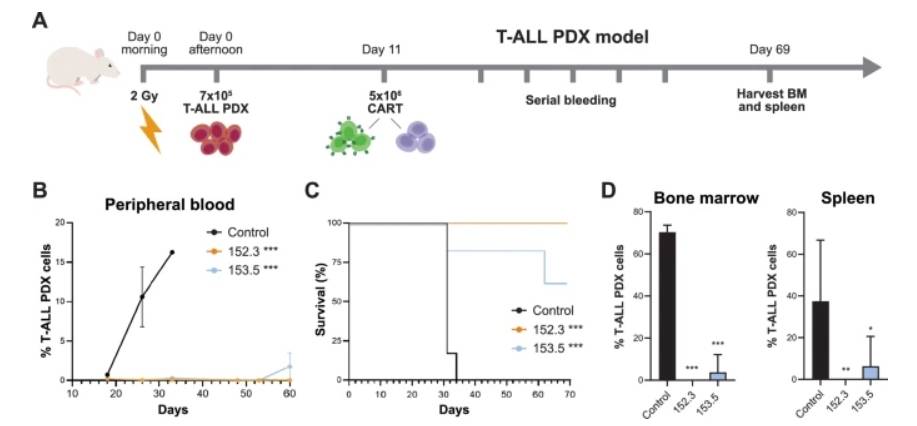
采用MOLT-4细胞系评估CART84在T-ALL异种移植模型中的体内疗效,结果显示,CART 84细胞治疗可有效控制肿瘤进展,小鼠生存期延长2-3周。在T-ALL PDX模型中,CART84细胞治疗可有效清除白血病,并且与对照组相比显著提高了小鼠生存率。在实验结束时,几乎所有CART84细胞治疗小鼠的骨髓和脾脏中均未检测到白血病细胞(仅在153.5治疗组中有1例观察到白血病细胞)。
CD84在健康组织中的表达与潜在靶向/脱靶毒性
通过对人体多种健康组织切片的染色分析,研究显示,除淋巴器官外,均未检测到CD84表达;在淋巴结以及骨髓中的巨核细胞和早幼粒细胞中检测到CD84。
采用152-1D5和153-4D9抗体评估组织中CD84表达,以验证候选药物的安全性。结果显示,152-1D5和153-4D9不与健康组织心脏、肺、肝、肾或大脑等重要器官的实质细胞结合,仅与淋巴结结合。
CART84 在人源化小鼠模型中体外和体内血液学毒性
与其他针对 AML 的 CAR-T细胞一样,CD84 在 CD34+ 造血干细胞/祖细胞 (HSPC) 上表达,但表达水平较其他免疫细胞低。研究者评估了候选药物 CART84 153.5 对三种来源的健康供体 CD34+ HSPC 的细胞毒性:G-CSF 动员的 PB、脐带血和 BM。细胞毒性实验显示,24 小时后,CART84 对G-CSF 动员的 PB 和脐带血来源的CD34+ HSPC表现出较低的细胞毒性,对来自 BM 的 CD34+ HSPC 表现出中等程度毒性。
在人源化NSG小鼠模型中,评估CART84潜在血液毒性。结果显示,CART84细胞治疗的小鼠,与对照组相比,CD34+细胞数量减少,CD19+ B细胞和CD33+髓系细胞减少,但差异无统计学意义。在实验结束时,CART84细胞治疗组小鼠的所有细胞群体仍可检测到。
研究结论
这是首个探讨CD84 作为急性白血病 CAR-T细胞疗法新靶点的研究报道。该研究结果显示,CD84在多种血液系统恶性肿瘤中均有表达,是一个极具潜力的泛血液系统靶点。研发针对AML和T-ALL的靶向CD84的CAR-T细胞疗法,有助于打破领域内目前尚无CAR-T细胞疗法获批的困局。鉴于CART84在临床前研究中显示出的疗效,研究团队计划将其推进至首个人体临床试验,作为R/R AML和T-ALL患者异基因造血干细胞移植(allo-HSCT)前的桥接治疗(EudraCT 2024-519966-31-00)。
排版编辑:肿瘤资讯-Elva
Pérez-Amill, L., Armand-Ugón, M., Val-Casals, M. et al. A novel chimeric antigen receptor T-cell therapy targeting CD84 for the treatment of acute myeloid and T-cell lymphoblastic leukemias. Leukemia (2025).











 苏公网安备32059002004080号
苏公网安备32059002004080号


