胆道癌(BTC)作为高度异质且侵袭性极强的恶性肿瘤,诊疗形势严峻:起病隐匿、手术切除率不足30%,晚期患者5年生存率低于10%。近年来,随着分子分型、免疫治疗及多学科协作(MDT)模式的突破,BTC诊疗正经历从“一刀切”到“精准分层”的范式转变。中国《胆道恶性肿瘤转化治疗专家共识(2025)》首次系统规范了免疫联合化疗在转化治疗中的核心地位,通过MDT动态评估为初始不可切除患者争取手术机会;欧洲EASL指南则创新性提出“三型分治”框架,将肝外胆管癌的解剖亚型与FGFR2/IDH1等分子特征深度融合,推动诊疗精准化。为帮助临床医生全面了解BTC领域前沿进展,特邀北京协和医院管梅教授,对近期BTC文献精粹进行深度解析。
北京协和医院肿瘤内科副主任医师、副教授
研究方向:消化道肿瘤的综合治疗
从2004年至今在北京协和医院肿瘤内科工作,参与20余项国际和国内新药临床研究,以第一作者或者通讯作者发表中英文文章28篇,其中SCI 10篇
15条硬核推荐,中国胆道癌转化治疗共识点亮生机
《胆道恶性肿瘤转化治疗专家共识(2025)》由中华医学会外科学分会胆道外科学组和中国医师协会外科医师分会胆道外科专家工作组联合制定1,旨在规范BTC转化治疗的临床实践。BTC是一类高度侵袭性的恶性肿瘤,约占消化系统恶性肿瘤的3%。由于其起病隐匿,多数患者在确诊时已处于进展期,手术切除率仅为20%~30%,预后极差。近年来,随着系统治疗和局部治疗的进步,转化治疗为部分初始不可切除的BTC患者提供了根治性手术的机会,但其临床应用仍存在诸多争议和问题。为此,专家组基于最新循证医学证据和我国临床实践,通过德尔菲问卷调查法和GRADE系统对证据等级及推荐强度进行评估,最终形成15条共识意见,涵盖转化治疗的适用人群、治疗方案、效果评估及术后管理等方面。
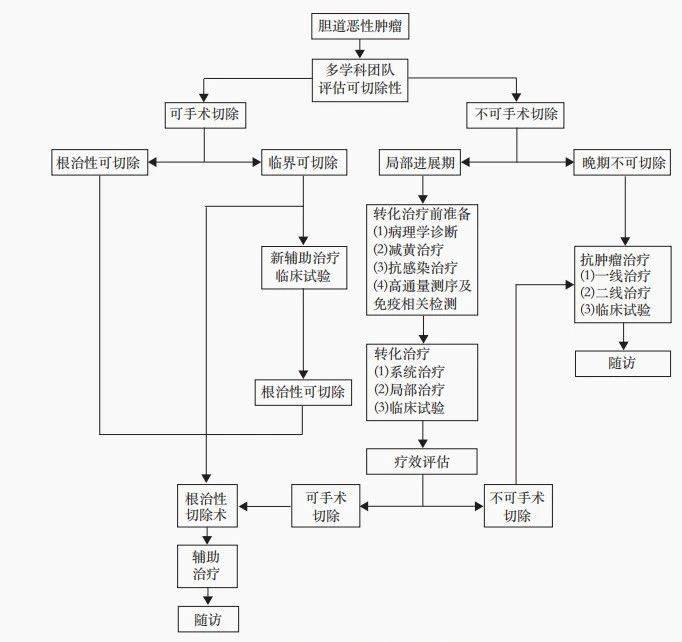
共识指出,BTC转化治疗的目标人群主要为局部进展期患者,需通过MDT模式全程管理,包括可切除性评估、病理学诊断、减黄保肝治疗等。转化治疗方案首选免疫检查点抑制剂联合化疗(如度伐利尤单抗联合吉西他滨和顺铂),其客观缓解率(ORR)和生存获益显著。对于一线治疗不佳者,建议通过二代测序筛选靶向治疗机会(如FGFR2、IDH1等靶点)。局部治疗(如TACE、HAIC、放疗等)联合系统治疗也可作为选择。治疗周期通常为2~6个周期,需依据RECIST 1.1标准动态评估疗效。转化成功后,手术时机需根据药物不良反应调整(如化疗停药3~6周,免疫治疗停药2~4周)。术后辅助治疗推荐延续原方案完成6~8个周期,以降低复发风险。共识强调,BTC转化治疗仍处于探索阶段,需进一步开展高质量临床研究,并建立全国多中心真实世界登记系统以积累数据。
欧洲指南出炉,肝外胆管癌诊疗迈入"三型分治"时代
EASL Clinical Practice Guidelines on the management of extrahepatic cholangiocarcinoma2
由欧洲肝脏研究协会制定的《肝外胆管癌临床实践指南》旨在解决近年来胆管癌在影像学、分子分型和系统治疗方面的进展与早期诊断、精准分类及有效管理之间的挑战。指南针对肝外胆管癌(包括远端胆管癌dCCA和肝门部胆管癌pCCA)的分类、诊断和治疗策略,强调解剖学、病理学和分子特征的差异对临床决策的影响。指南的制定基于专家小组的系统文献回顾和德尔菲法共识,采用PICO框架(患者、干预、对照、结局)对分类、流行病学、监测/早期诊断、诊断/分期、治疗和随访六大核心主题进行评估,并通过两轮投票达成共识(≥75%同意率)。证据质量采用牛津循证医学中心(OCEBM)标准分级,推荐强度分为“强”或“弱”。
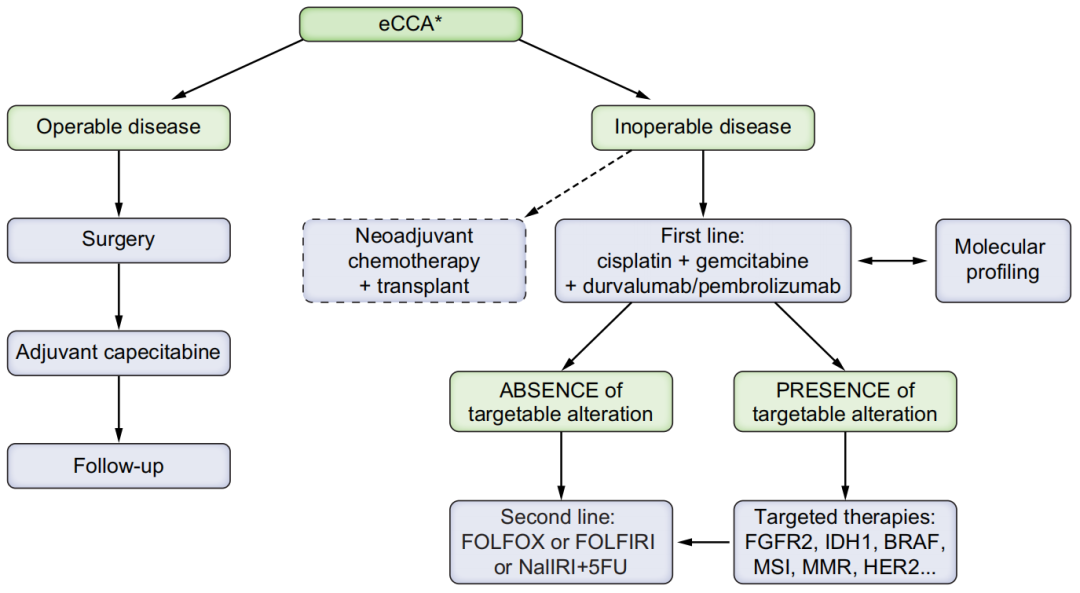
因在病理生物学和临床管理上存在显著差异,指南明确将CCA分为肝内(ICCA)、肝门部(pCCA)和远端(dCCA)三型;诊断方面,推荐增强CT和MRI联合磁共振胰胆管成像(MRCP)作为首选影像学手段,必要时胆道镜二次活检;治疗方面,手术切除是局部肝外胆管癌的唯一潜在治愈手段,但仅20-30%患者适合;对于不可切除病例,吉西他滨+顺铂联合免疫检查点抑制剂(如度伐利尤单抗或帕博利珠单抗)成为一线标准治疗,所有晚期患者均应接受分子检测以寻找FGFR2、IDH1、HER2、BRAF V600E等可靶向变异,其中证据级别最高的靶点为FGFR2融合/重排(推荐福巴替尼或佩米替尼,基于Ⅲ期试验数据)和IDH1 R132突变(推荐艾伏尼布,基于ClarIDHyⅢ期研究)。其他潜在靶点包括HER2扩增/过表达(泽尼达妥单抗或德曲妥珠单抗)及BRAF V600E突变(达拉非尼+曲美替尼)。若无靶向变异,二线治疗推荐FOLFOX(基于ABC-06Ⅲ期试验),或考虑脂质体伊立替康脂质体+5-FU/LV(NIFTYⅡ期数据)。化疗方案需结合患者耐受性及前期治疗反应个体化选择;辅助治疗方面,推荐卡培他滨,R1者可个体化加放化疗;胆道引流中,内镜下金属支架置入优于经皮引流,尤其在远端梗阻。此外,指南强调对原发性硬化性胆管炎等高危人群的定期监测,并指出液体活检等新兴技术尚需进一步验证。
胆道癌细胞系图谱的构建揭示分子亚型和治疗靶点
Generation of a biliary tract cancer cell line atlas reveals molecular subtypes and therapeutic targets3
BTC包括肝内胆管癌、肝外胆管癌、胆囊癌和壶腹癌,晚期患者5年生存率低于10%,临床治疗选择有限。尽管靶向治疗(如针对IDH1、FGFR2、BRAF和HER2的抑制剂)取得了一定进展,但多数患者仍缺乏有效治疗靶点。BTC的分子异质性显著,不同解剖亚型和基因亚型之间存在显著生物学差异,亟需建立功能相关的分子分类系统以指导精准治疗。本研究通过整合63种BTC细胞系的多组学聚类和全基因组CRISPR筛选,构建BTC细胞系图谱,并进行全外显子测序、RNA测序和定量蛋白质组学分析。利用DepMap数据库中的数据,通过CRISPR筛选确定BTC细胞系的遗传脆弱性,并结合转录组和蛋白质组数据,揭示BTC的分子特征和潜在治疗靶点。
研究发现,BTC细胞系保留了原发肿瘤的分子特征,且转录谱与患者样本高度一致;特定基因突变(如KRAS、BRAF V600E、FGFR2融合)导致显著的“癌基因成瘾”现象,而IDH1突变未表现出类似依赖;染色体3p缺失与EGFR依赖性显著相关,且EGFR抑制可增强KRAS或FGFR2抑制剂的疗效;转录组聚类揭示了四种亚型(R1-EMT、R2-肝细胞样、R3-双谱系、R4-胆管样),其中R3(双谱系)和R4(胆管样)亚型分别与IDH1/FGFR2突变和KRAS/SMAD4突变相关,且具有不同的预后意义;蛋白质组学分析进一步识别了Hippo通路等新的治疗靶点;部分BTC表现出鳞状分化特征(TP63依赖),与不良预后相关。
信迪利单抗联合安罗替尼及吉西他滨加顺铂治疗晚期胆道癌:SAGC随机II期试验
Sintilimab and anlotinib with gemcitabine plus cisplatin in advanced biliary tract cancer: SAGC a randomized phase 2 trial4
BTC起病隐匿,确诊时多已转移,现有吉西他滨联合顺铂(GC)一线化疗的中位PFS仅5.7-8.0个月,免疫检查点抑制剂联合GC的增益亦有限(TOPAZ-1试验OS延长1.2个月)。抗血管生成药物理论上可通过重塑肿瘤微环境增强免疫疗效,但缺乏随机对照证据,且剂量选择存在争议。2020-2022年国内三家中心开展随机、开放、Ⅱ期SAGC试验,纳入80例未经系统治疗的不可切除/转移性BTC患者,1∶1分至信迪利单抗+安罗替尼+GC(SAGC)组或单纯GC组;主要终点PFS按mRECIST评估。
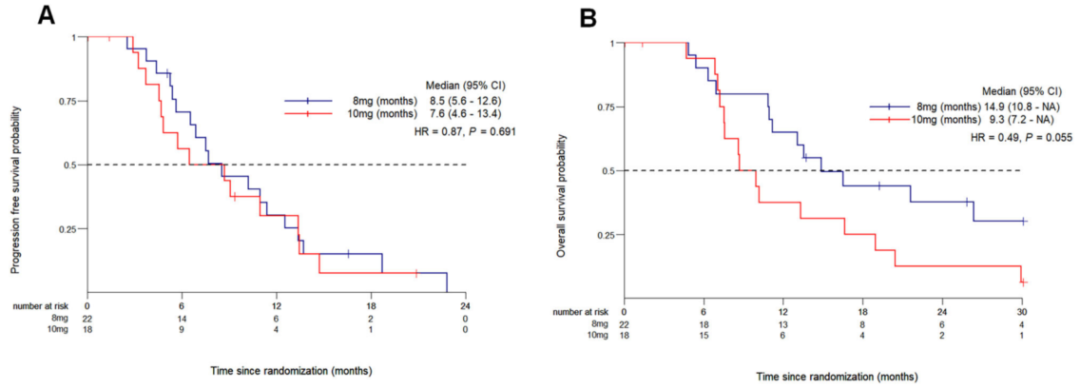
中位随访13.4个月,SAGC组PFS显著优于GC组(8.5个月 vs 6.3个月,HR 0.48,P=0.005),客观缓解率51.4% vs 29.4%(P=0.033),但中位OS差异无统计学意义(13.2个月 vs 13.7个月)。事后分析8 mg安罗替尼亚组较10 mg组疗效更佳(ORR 54.5% vs 38.8%,OS 14.9个月 vs 9.3个月,P=0.055)。安全性方面,SAGC组3/4级不良事件发生率75.0%,高于GC组(43.6%),主要表现为中性粒细胞减少、血小板减少;剂量下调后≥3级血小板减少由38.9%降至13.6%。动物实验证实低剂量安罗替尼联合PD-1单抗较之高剂量组显著减少肿瘤负荷、延长生存,机制上表现为血管正常化、缺氧减轻、CD8⁺T/NK细胞浸润及GZMB、perforin表达上调,且血液及肠道毒性更低。
泽尼达妥单抗治疗HER2阳性晚期胆道癌患者的真实世界疗效
Real-world efficacy of zanidatamab in patients with HER2 positive advanced biliary tract cancers5
胆道癌中HER2过表达或扩增约占5-10%,尤其在胆囊癌中更为常见。HERIZON-BTC-01临床试验已证实泽尼达妥单抗对经治HER2阳性BTC患者的疗效,但仍缺乏真实世界数据。本研究纳入了2022年9月至2024年11月期间接受泽尼达妥单抗治疗的20例HER2阳性转移性BTC患者。HER2状态通过免疫组化(IHC 3+或IHC 2+伴FISH扩增/NGS扩增)确认。主要终点为PFS,次要终点包括OS、ORR、疾病控制率(DCR)和安全性。泽尼达妥单抗以20 mg/kg每两周一次的剂量静脉给药,直至疾病进展或出现毒性。
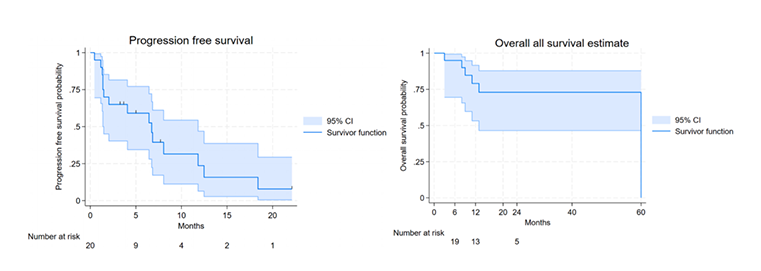
研究结果显示,中位随访8.5个月时,中位PFS为6.7个月,1年OS率为79.1%。DCR为65%,其中40%为部分缓解,中位缓解持续时间为7.3个月。IHC 3+患者的PFS显著优于IHC 2+/FISH+/NGS扩增患者(8个月 vs. 1.4个月,P=0.02),但两组1年OS率无显著差异(P=0.39)。安全性方面,仅15%患者出现2级输液反应,40%出现1-2级腹泻,未观察到3-4级治疗相关不良事件或心脏毒性。
专家点评
近年来,BTC的诊疗取得了显著进展,但仍面临诸多挑战。《胆道恶性肿瘤转化治疗专家共识(2025)》的发布为临床实践提供了重要参考,其核心价值在于通过MDT模式整合多学科资源,明确免疫联合化疗(如度伐利尤单抗+GC方案)作为转化治疗的首选。然而,共识中“2-6个周期”的弹性治疗周期建议,反映了疗效评估标准(RECIST 1.1)在BTC中的局限性——部分患者可能因影像学评估滞后错失手术时机。术后辅助治疗延续原方案的推荐虽基于TOPAZ-1等研究,但忽略了个体化分子分型的潜在影响。未来需探索动态活检或ctDNA监测以优化治疗决策。
欧洲肝外胆管癌指南的亮点在于将解剖分型(pCCA/dCCA)与分子特征(如FGFR2/IDH1突变)深度融合,提出肝内、肝门、远端胆管癌“三型分治”框架。这一分类不仅解决了传统解剖分型对治疗反应的预测不足,还为靶向治疗筛选提供了精准路径。但指南对局部治疗(如TACE/HAIC)的推荐相对保守,可能低估了其在转化治疗中的潜力。值得注意的是,液体活检未被纳入常规监测,反映出技术转化仍需时间验证。未来研究需聚焦解剖-分子双维度指导下的综合治疗模式。
BTC细胞系图谱研究通过多组学整合揭示了四大分子亚型(如R3双谱系型与IDH1/FGFR2突变关联),为靶向治疗提供了新思路。其中,染色体3p缺失与EGFR依赖性的发现尤为关键,提示EGFR抑制剂可能成为KRAS/FGFR2耐药后的潜在选择。然而,该研究存在局限性:细胞系模型无法完全模拟肿瘤微环境,且TP63依赖的鳞状分化亚型尚未转化为临床可用靶点。未来需结合类器官模型和空间转录组学进一步验证。
SAGC试验的创新性在于探索抗血管生成药物与免疫治疗的协同机制,其PFS获益印证了“血管正常化增强免疫浸润”的理论。但OS未显著改善可能提示后线治疗交叉对生存期的影响,而安罗替尼8 mg组的优势则凸显剂量优化的重要性——高剂量可能加剧免疫抑制性微环境。法国真实世界研究证实了泽尼达妥单抗在HER2阳性BTC中的疗效(IHC 3+患者PFS达8个月),但其疗效异质性(IHC 2+患者获益有限)提示需优化检测标准——当前IHC 2+/FISH+阈值可能不足以筛选最佳获益人群。
当前BTC诊疗已进入“解剖-分子-免疫”多维度整合时代,但仍需解决三大关键问题:一是建立动态疗效评估体系(如影像组学联合ctDNA),二是开发针对罕见靶点(如TP63)的创新药物,三是优化联合治疗策略(如抗血管-免疫-化疗的排兵布阵)。未来,跨学科协作与真实世界数据积累将推动BTC诊疗迈向个体化新高度。
审校:北京协和医院管梅教授
整理:中国医学论坛报 林颖
审批号::M-TIBSO-CN-202508-00015
本文转自:论坛报
1. 梁后杰,沈锋,秦叔逵,等.《胆道恶性肿瘤免疫检查点抑制剂治疗中国专家共识(2025版)》[J].临床肿瘤学杂志,2025,30(06):598-608.
2. European Association for the Study of the Liver. EASL Clinical Practice Guidelines on the management of extrahepatic cholangiocarcinoma. J Hepatol. 2025 Jul;83(1):211-238. doi: 10.1016/j.jhep.2025.03.007. Epub 2025 May 10. PMID: 40348685.
3. Vijay V, Karisani N, Shi L, et al. Generation of a biliary tract cancer cell line atlas reveals molecular subtypes and therapeutic targets. bioRxiv [Preprint]. 2024 Jul 8:2024.07.04.601970. doi: 10.1101/2024.07.04.601970. Update in: Cancer Discov. 2025 May 12. doi: 10.1158/2159-8290.CD-24-1383. PMID: 39026794; PMCID: PMC11257448.
4. Li J, Zhou S, Xu X, et al. Sintilimab and anlotinib with gemcitabine plus cisplatin in advanced biliary tract cancer: SAGC a randomized phase 2 trial. Nat Commun. 2025 Jul 1;16(1):5559. doi: 10.1038/s41467-025-60119-3. PMID: 40593475; PMCID: PMC12217857.
5. Smolenschi C, Blanc JF, Lancry A, et al. Real-world efficacy of zanidatamab in patients with HER2 positive advanced biliary tract cancers. Eur J Cancer. 2025 Jun 3;222:115432. doi: 10.1016/j.ejca.2025.115432. Epub 2025 Apr 18. PMID: 40319675.
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关政府部门批准使用的指南或规定。
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


