磷脂酰肌醇 4,5-二磷酸 3-激酶催化亚基 α(phosphati-dylinositol-4,5-bisphosphate3kinasecatalyticsubunitalpha,PIK3CA)基 因 突 变 在 乳 腺 癌 中 占 30% ~40% ,对 早 期 乳 腺 癌 的发生、发展至关重要。随着靶向 PIK3CA突变的抑制剂的发展,PIK3CA突变成为乳腺癌个体化治疗的重要检测因子。 该文就 PIK3CA突变在乳腺癌中的相关临床研究进展以及 临床检测等进行系统综述。
乳腺癌是全球女性中最常见的恶性肿瘤,具有高发病率 和致死率。磷脂酰肌醇 4,5-二磷酸 3-激酶催化基α(phos- phatidylinositol-4,5-bisphosphate3-kinasecatalyticsubunital-pha,PIK3CA)基因突变在乳腺癌中占 30% ~40%,对肿瘤的发生和进展起重要作用。PIK3CA基因编码的PI3K酶是 PI3K/Akt/mTOR 信号通路的核心,其突变引起的酶 活性异常可导致该通路的过度激活,促进肿瘤细胞的生长和抗凋亡能力。 因此,PIK3CA突变成为乳腺癌个体化治疗的重要靶点。随着靶向 PIK3CA突变抑制剂的发展,临床上对 PIK3CA突变的检测需求增加。这不仅有助于制定精准的治疗方案,还能预测患者对靶向药物的反应,优化治疗效果。因此本文综述了 PIK3CA基因突变在乳腺癌中的临床研究进展及检测方法,旨在规范PIK3CA基因突变检测,为乳腺癌的精准治疗提供依据。
1 PIK3CA在乳腺癌中的突变及临床意义
1.1 PI3K在乳腺癌中的分布
磷脂酰肌醇3-激酶(phos- phoinositide3-kinase,PI3K)是一组由催化亚基p10(p10α、p10β、p10δ和 p10γ)和调节亚基 p85(p85α、p85β、p85γ、p50α和 p5α)组成的异二聚体,各亚基分别由PIK3CA、PIK3CB、PIK3CD基因编码。PI3K是PI3K/Akt经典信号通 路的关键因子,与众多人类疾病相关,PI3K的过度激活促进 癌细胞的快速增长和繁殖(图1)。
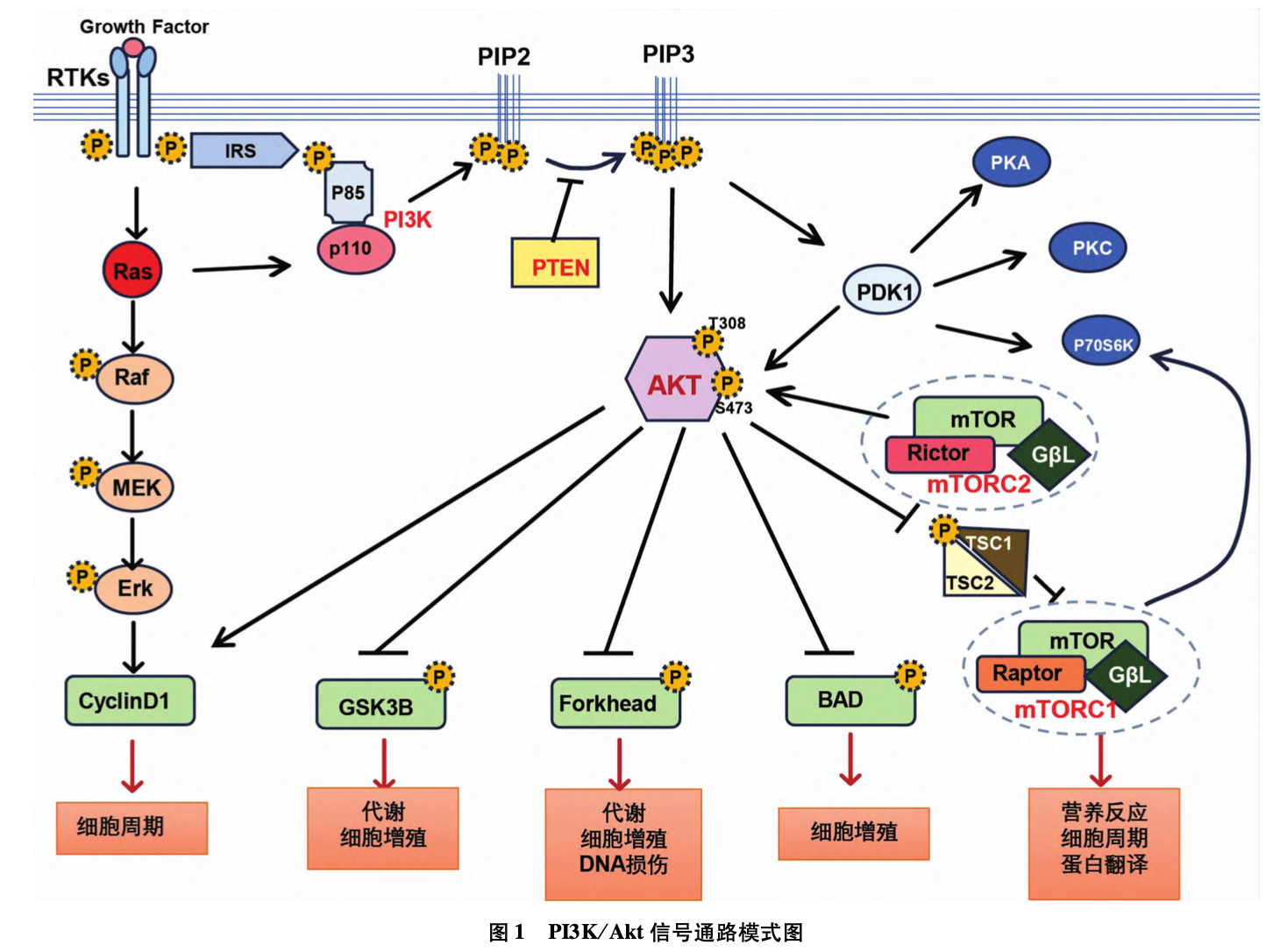
2004年,PI3K体细胞突变尤其是 PIK3CA(编码 p10α催化亚基的基因),在不同的恶性肿瘤中被发现[1]。根据 MSK-IMPACT临床测序队列,PIK3CA突变在子 宫内膜癌中发生的频率最高(40%),其次是乳腺癌(34.59%)、子宫颈癌(30%)、直肠癌(28%)、头颈 癌(24%)、膀胱癌(23.4%)和结直肠癌(19.17%)[2]。在乳腺癌中,PIK3CA突变仅次于TP53突变,且在所有乳腺癌亚 型中普遍存在[3-6]。PIK3CA突变在 HR+乳腺癌中占比达35% ~40%,HER2+乳腺癌中为 25% ~30%,而在三阴型乳腺癌(triplenegativebreastcancer,TNBC)中小于 10%。
Yi等[7]在对中国乳腺癌患者基因突变分析的临床研究 结果表明,PIK3CA突变在中国乳腺癌患者发生率为32%~46.5%。PIK3CA突变在 ER+/HER2+患者中发生率高(51.6%),其次是ER+/HER2-患者(48.7%),ER-/HER2-患者中发生率最低(30.0%),但其拷贝 数扩增比例最高(19.05%)[8-9]。一项523例中国人群女性乳腺癌患者的研究结果显示,HER2低表达乳腺癌亚组与HER2阳性及HER20亚组相比,其 PI3K-Akt信号通路上发生了更多的基因突变(P<0.001)。利 用癌症基因组图谱数据库,研究发现与西方乳腺癌患者相比,中国乳腺癌患者 PIK3CA突变的发生率更高(分别为45.6%和 34.7%,P<0.01)[10]。
1.2PIK3CA基因在乳腺癌中的热点突变
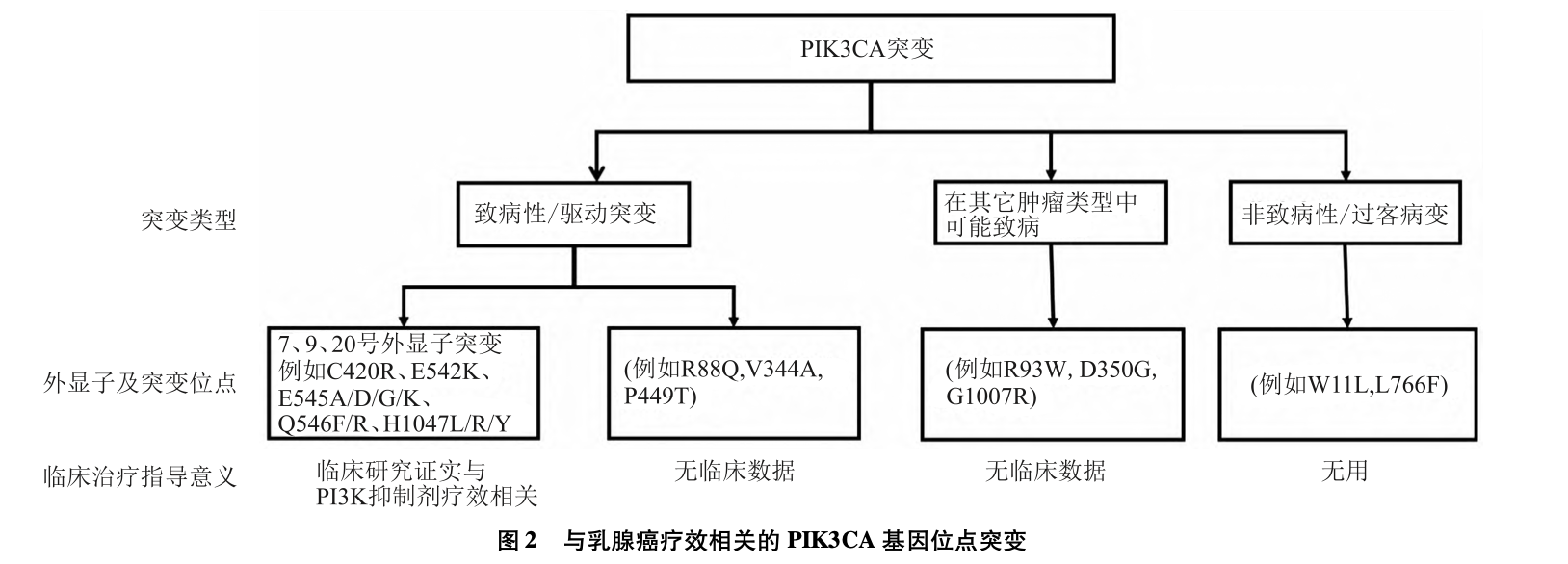
乳腺癌患者中,70%~80%的PIK3CA基因突变发生在位于9号外显子的p.E545K、p.E542K和20号外显子 的p.H1047R,其PIK3CA突变与致癌作用密切相关。9号外显子突变位点位于p10α的螺旋结构域,使其能够避免p85的抑制性调节,最终促进肿瘤的发生、发展。20号外显子突变位于激酶结 构域,但具体机制目前尚不明确[4]。根据来自癌症基因组图谱(theCancerGenomeAtlas,TCGA)中乳腺癌和癌症体细胞突变目录(theCatalogueofSomaticMutationsinCancer,COS-MIC)中数据显示,PIK3CA中其他具有致病性但频率较少的位点突变包括位于4号外显子的 p.N345K突变、13号外显 子的 p.E726K取代、20号外显子的p.G1049R、9号外显子的p.Q546K、p.Q546R、p.E545A、p.E545G以及 7号外显子的 p.C420R[8]。新的检测技术可能会检测出更多的突变位点,其与临床疗效的相关性需要大样本量的进一步确认。目 前经临床试验数据证实的与PI3Kα抑制剂疗效相关的位点突变如图2所示[1]。
1.3 乳腺癌中 PIK3CA突变的临床意义
PI3K是多条信号通路的主要枢纽,其过度活化会导致AKT/mTOR等信号通路紊乱 。PIK3CA基因突变是乳腺癌的早期事件,促进了乳腺癌的发生、发展 [12]。研究发现,PAM信号通路的异常激活是乳腺癌最常见的致病因素,且与不良预后相关,也是肿瘤细胞抵抗治疗的主要原因之一[13-14]。一项纳入3个研究的荟萃分析对3219例HR+/HER2-转移乳腺癌患者按照PIK3CA基因是否突变进行分组,对无进展 生 存 期 (progres- sion-fresurvival,PFS)和总生存期(overalsurvival,OS)进行 分 析 ,结 果 显 示 ,无 论 进 行 何 种 治 疗 方 案 ,PIK3CA 突 变 组 患 者中位 PFS均少于 PIK3CA野生组患者,预后较差[15]。研究发现,PI3K通路异常激活可诱导ER的磷酸化,使ER相关调控基因上调,最终导致内分泌治疗的原发或获得性耐药[5,16]。PALOMA-3研究主要针对哌博 西利(Palbociclib)结合氟维司群在HR+/HER2-内分泌治疗后进展的晚期乳腺 癌患者,该研究通过基因测序发现,经哌博西利联合氟维司群治疗后,具有 PIK3CA突变的患者比例增多[17]。PI3K是HER2信号通路下游的重要靶基因,抑制该信号异常活化可能是防止HER2靶向治疗耐药的有效策略。
晚期HR+/HER2+乳腺癌的标准化治疗包括内分泌治 疗、联合或不联合使用细胞周期蛋白依赖性激酶4和6(CDK4/6)抑制剂,但大约50%HR+乳腺癌患者因内分泌治疗耐药而发生疾病进展,且这部分患者耐药的出现通常与ESR1、PIK3CA等基因突变相关[18]。研究显示,约40%的HR+/HER2-乳腺癌患者伴有PIK3CA突变,且PIK3CA突变型患者的预后更差[8,19]。对转移性ER+/HER2-乳腺癌的研究表明,当使用NGS技术评估时,PIK3CA突变的患者频率较低(35%),其中20%为非热点突变[20]。在一项对 ER+/HER-原发性乳腺癌并经持续内分泌治疗5年内复发的患者进行的回顾性研究中,PIK3CA突变的存在与淋巴结累及显著相关,这表明PIK3CA突变的肿瘤可能更具侵袭性并扩散到淋巴结。此外,在持续内分泌治疗期间,该突变在复发组 (48%)中比原发组(40%)更频繁,而在这些突变中,几乎有三分之一的肿瘤含有非热点突变[21]。这些均提示在晚期肿瘤标本中应进行PIK3CA突变状态检测以进行PI3K抑制剂治疗,热点突变之外发生的大量突变意味着还需要扩大评估 范围。需要更多的研究扩充队列来检测内分泌抵抗性乳腺 癌患者的 PIK3CA突变状态,从而有助于优化其治疗和后续评估。总之,PIK3CA突变是乳腺癌潜在治疗的重要靶点,其精准化检测为乳腺分子病理带来了新的机遇与挑战。
1.4 PI3K抑制剂在乳腺癌中的研发进展
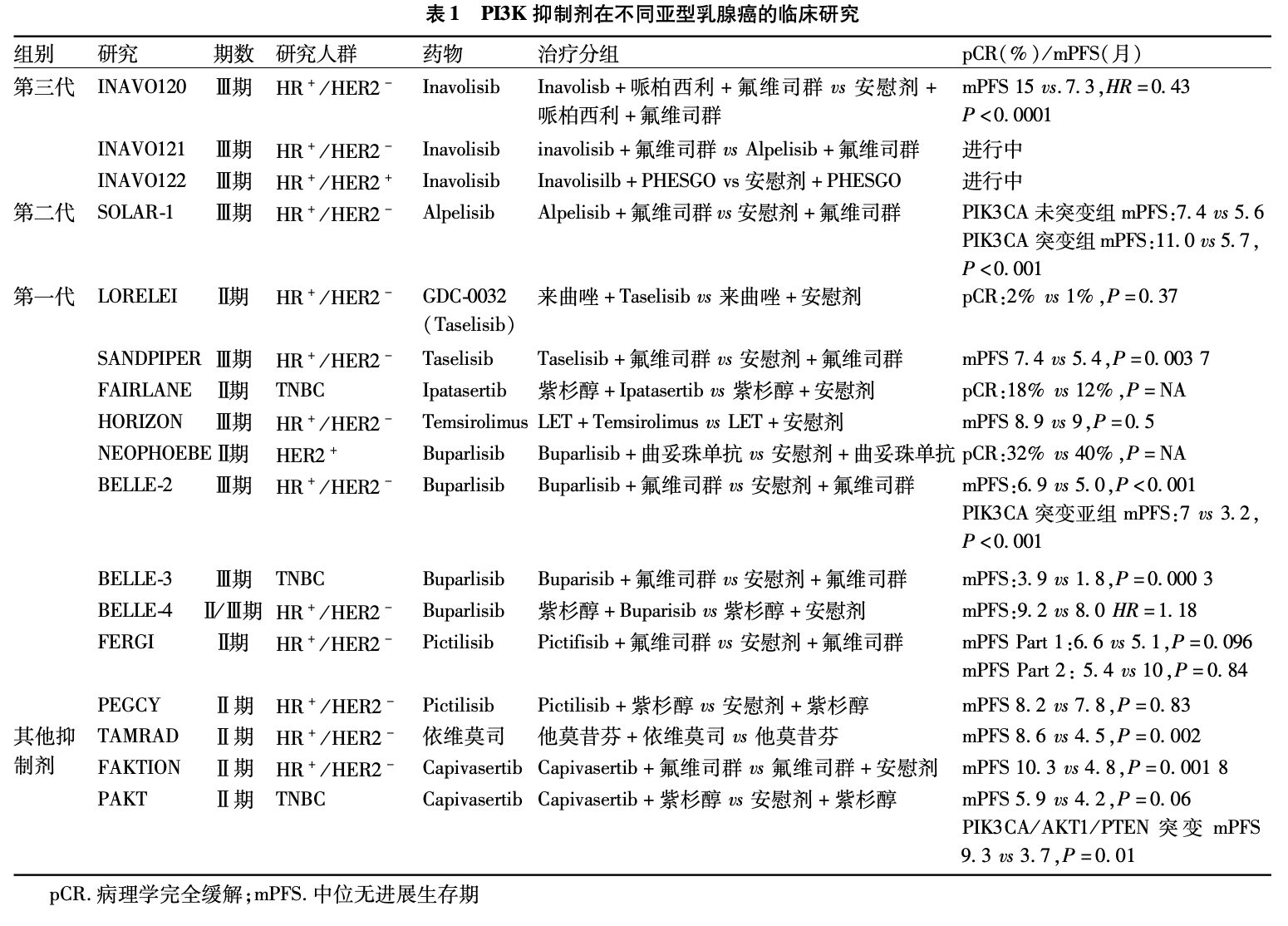
PI3K抑制剂在临床实践中已经有过多重迭代。第一代抑制剂即泛 PI3K抑制剂,可作用于所有的PI3KI类异构体(α、β、δ或 γ)如bu-parlisib(BKM120)和 pictilisib(GDC-0941),其通过影响下游靶点而具有广谱的抑制活性,因此靶点外毒性的风险有所增加。第二代为亚型选择性抑制剂,仅作用于特定的亚型异构体,如PI3Kα选择性抑制剂Alpelisib。SOLAR-1研究比较了Alpelisib联合氟维司群治疗PIK3CA突变的 HR+/HER2-晚期或转移性乳腺癌患者。该研究纳入 572例患者,对患者随机进行 Alpelisib联合氟维司群治疗(169例)或安慰剂联合氟维司群治疗(172例)。主要研究终点显示Alpelisib组患者PFS时间显著长于安慰剂组,中位PFS时间分别为11.0个月和5.7个月(P<0.01)[2]。因此,2019年5月Alpelisib获得美国食 品药品管理局 (Food and Drug Administration,FDA)批准,可联合氟维司群治疗绝经后 HR+/HER2-且PIK3CA突变的晚期或转移性乳腺癌患者[23]。第三 代PI3Kα抑制剂Inavolisib,目前被确立为一线治疗的高选择性PI3Kα特异性抑制剂和突变体降解剂,Inavolisib选择性抑制PI3Kα的催化亚基p10α,对 PI3Kα的选择性是其他PI3K亚型(β、δ、γ)的 30倍以上,同时降解PI3K突变体,实现PI3K/AKT通路持续抑制,与其他PI3K抑制剂相比显著降低药物毒性。III期临床INAVO120研究纳入经组织或循环肿瘤DNA ( circulating tum or D N A , ctD N A ) 检 测 确 定 存在PIK3CA突变的325例患者,结果显示Inavolisib 组,中位PFS延长了7.7个月(分层 HR=0.43,95%CI0.32~0.59;P< 0.01),显著降低了 57%的疾病进展或死亡风险,基于此,Inavolisib也获得了FDA和 NMPA的突破性疗法认证。目前已开展多项针对乳腺癌不同亚型(HR+、HER2+和 TNBC)及不同疾病阶段(早期、晚期 /转移性)的临床研究。部分研究结果信 息见表1。
2 PIK3CA突变在乳腺癌的临床检测现状
2.1 PIK3CA突变检测流程
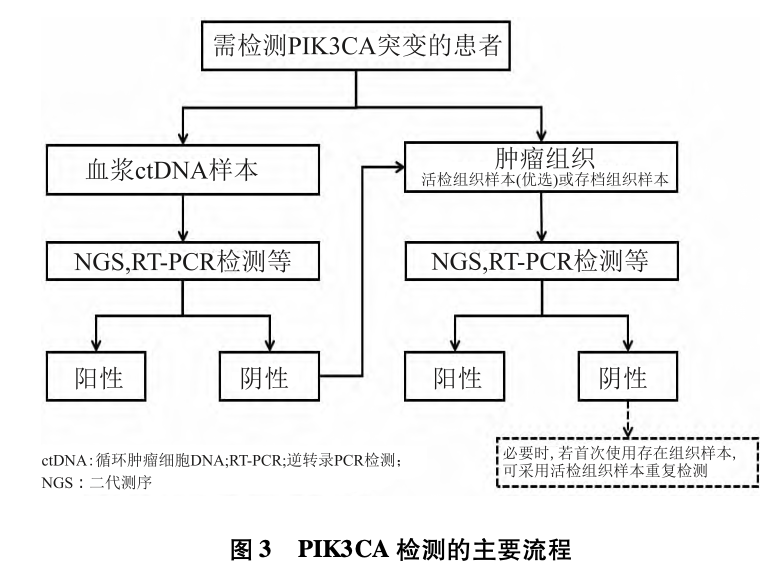
2021年ASCO指南建议,对拟接受Alpelisib联合氟维司群治疗的绝经后 HR+ /HER2-乳腺癌患者,推荐使用二代测序技术(next-generationsequen-cing,NGS)检测肿瘤组织或 ctDNA中的 PIK3CA突变状态。如果 ctDNA中未检测到 PIK3CA突变,则需要进一步行肿瘤
组织检测以避免假阴性。2024年美国国立综合癌症网络
(NationalComprehensiveCancerNetwork,NCCN)乳腺癌临床实践指南建议对所有转移 HR+/HER2-进行PIK3CA突变评估[24]。检测的主要流程如图3所示。
2.2PIK3CA 突 变 标 本 类 型 选 择
研究显示,无论是血浆ctDNA还是肿瘤组织检测的 PIK3CA突变患者,均可从 PI3K抑制剂治疗中获益。但是不同的送检样本,在临床检测PIK3CA突变时仍 存在一定差异 [25]。 ctDNA 检 测具有无创或微创,可 反复取材,收集、处理和分析报告周转时间 (turn- aroundtime,TAT)短等优势 ,同时能克服肿瘤空间 异质性,可相对全面、实时地反映患者的肿瘤分子特征。鉴于目前尚 缺乏针对同时期血浆和肿瘤组织检测一致性的大样本研究, 故建议对血浆 ctDNA检测 PIK3CA突变阴性的患者送检肿 瘤组织。一项纳入 341例 PIK3CA突变人群的研究分析显 示,9%的患者通过肿瘤组织样本检测出 PIK3CA突变;在317例有血浆样本且 PIK3CA突变人群中,通过血浆 ctDNA样本可检测出56%的PIK3CA突变[23]。考虑到血浆样本检 测的便利性及较高的假阴性率,目前多个指南或共识均建议 对血浆ctDNA检测后 PIK3CA突变阴性的患者重新进行肿瘤组织检测,以提高突变的检出率。
PIK3CA突变状态的分布在原发肿瘤和转移瘤中大致相似,可使用活检组织样本或存档组织样本[26]。若 存在新鲜活检组织样品,则优先选择新鲜石蜡包埋肿瘤组织进行检 测,如无法获得新鲜活检组织样品,再考虑以往石蜡包埋肿 瘤组织或切片等。虽然 PIK3CA突变可以在不同时期乳腺癌 中发现,但由于转移性乳腺癌患者治疗中可以产生获得性PIK3CA突变,因此需要检测最新的肿瘤组织样本以获取PIK3CA突变信息,如果无法获取组织样本则首选ctDNA检测。
2.3 PIK3CA突变检测方法选择
目前常用的PIK3CA突变检测方法包括NGS、PCR、Sanger测序、微滴式数字PCR(dropletdigitalPCR,dPCR)、数字PCR-流式技术(BEAM-ing)等,不同检测方法存在一定差异。
2.3.1 NGS检测
NGS又称下一代测序技术、二代测序技术、高通量测序技术,通常可使用肿瘤组织或液体标本(如血浆ctDNA标本等),用于肿瘤的临床诊断、基因组学检测。NGS可检测到PIK3CA常见突变及一些罕见突变,常见的突变分别为p.H1047R、p.E545K、p.E542K,罕见突变为p.N345K(外显子4);p.H1047L(外显子20);p.E726K(外显子13);p.C420R(外显子7);NGS也可以检测到中国人群中的PIK3CA新突变位点,包括p.V34_V346dup(外显子4);p.E418_L422>V、p.P449_E453>Q、p.P449_V461del、p.P449S(外显子7);p.E798N(外显子15);p.Q861fs(外显子17);p.E976K(外显子19);p.A106fs(外显子20)[27]。基于ctDNANGS可检测到激酶结构域、螺旋结构域及其他结构域中的PIK3CA突变位点[28]。2020年10月美国FDA批准了基于NGS的液体活检伴随诊断产品F1LCDx用于检测PIK3CA突变。
2.3.2 PCR检测
PCR是一种体外扩增特定DNA片段的分子生物学技术,已被广泛用于鉴定已知基因组区域的突变。在一项包含1281名HR+转移乳腺癌女性患者的大型未选择队列中,采用FDA批准的RT-PCR检测,该检测涵盖了11个突变(外显子7 p.C420R;外显子9 p.E542K、p.E545A、p.E545D、p.E545G、p.E545K、p.Q546E、p.Q546R和外显子20p.H1047L,p.H1047R,p.H1047Y),均在不同年龄组中检出,多数为单一突变,仅在10例患者中出现多重突变。一项16例PIK3CA已知突变的HR+HER2-乳腺癌患者中,RT-PCR可以检测到原发肿瘤组织中的H1047x、E545x、Q546x,在转移性组织中检测到H1047x、E545x、E542x,原发和转移瘤样本的结果一致性为40.0%。dPCR法可检测晚期乳腺癌患者的血清样品PIK3CA的突变状态,包括外显子9突变(E542K和E545K),外显子20突变(H1047L和H1047R)[29]。目前已有检测PIK3CA突变的PCR试剂盒获批,其中FDA批准QIAGENtherascren PIK3CARGQPCR试剂盒作为Alpelisib的伴随诊断,可以检测组织和(或)外周血ctDNA中的PIK3CA突变。中国也已批准PIK3CA基因突变检测试剂盒(荧光PCR法),用于体外定性检测乳腺癌石蜡包埋组织(FFPE)样本DNA中人类PIK3CA基因的5种热点突变(包括H1047R、H1047L、E542K、E545K、E545D)。
2.3.3 其他基因检测方法
Sanger测序又称一代测序,因其可靠性、可及性和相对较低的成本等优势,Sanger测序成为生物学标志物突变检测的金标准,但该方法的灵敏度较低。一项纳入60例FFPE乳腺样本的研究通过PCR-MS、LNA-PCR测序和标准Sanger测序三种方法,分别评估了乳腺病变中PIK3CA热点突变状态(E542、E545和H1047),其中PCR-MS检测出48例患者存在一种或多种PIK3CA突变(14例E545K,1例E545G,4例E542K,25例H1047R,1例同时具有E545K和E542K,1例同时具有E542K和H1047R,1例具有E545K和H1047R均为E545K和H1047R,1例为E545K和Q546E),12例为野生型,与PCR-MS相比,Sanger测序仅检测到69%的突变,包括H1047R、E545K、Q546E,检出率显著低于PCR-MS,且4例共突变均未检出[30]。Sanger测序一次可以读取60~10bp的碱基,准确性高,但仍具有测序的长度限制、通量低的局限性。 BEAMing是指集合微珠、乳液、扩增、磁性,可以来测量突变型基因和野生型基因的技术。使用该技术检测癌症晚期患者血浆ctDNA中PIK3CA基因突变是可行的,其结果与PCR检测组织DNA结果有较高的一致性(达91%),可检测PIK3CA突变的p.E542K、p.E545K、p.H1047R和p.H1047L位点。该技术能够分析ctDNA分子中的微小变异,其突变等位基因频率的检出限约为0.02%[31]。
3 PIK3CA突变检测的规范化与质控
目前,关于PIK3CA检测,国内尚无统一的检测标准。PIK3CA基因检测应选择有检测能力的医疗机构或选择资质齐全的基因检测机构,检测机构的各项检测流程需通过相关机构认证,确保检测结果准确。PIK3CA突变检测涉及的人员包括检测人员、生物信息分析人员及变异解读人员,相关的人员必须接受技术检测、生物信息分析或变异解读相关的专业培训,并获得相应的资格证书。对于检测过程的操作人员必须经过质量管理体系、操作规程、污染防控等技能的培训,并严格按照标准化操作流程操作,确保检测结果的准确可靠。生物信息分析及变异解读人员应具有生物信息学或者遗学专业背景,并接受基因检测相关培训。变异解读人员应具有遗传咨询师资质或经相关遗传咨询培训合格,基因检测流程复杂,需要规范化的操作流程及严格的质控体系才能保障结果的准确性,保障患者得到精准治疗和管理。在PIK3CA基因检测过程中,要重视多学科合作的重要性,加强临床与病理医师的沟通合作,并促进PIK3CA基因检测数据的共享。
4 总结与展望
鉴于PI3K分子靶向药物在乳腺癌治疗领域的持续获批与应用,特别是针对PIK3CA突变的疗法,该基因突变已成为临床关注的焦点。对于HR阳性/HER2阴性的乳腺癌患者,尤其是内分泌治疗出现进展的病例,精确掌握PIK3CA基因状态,是制定后续个性化治疗策略不可或缺的关键要素。然而,当前PIK3CA基因突变检测的标准化诊疗流程尚显不足,特别是在中国特定患者群体中,关于突变率、具体突变类型的深入 研究,以及高效筛选PIK3CA突变患者的方法,均处 于亟待完善的阶段。随着PI3K靶向药物研发的深入,未来势 必推动PI3K检测与诊断流程的逐步规范化,旨在提升PIK3CA基因突变的检测灵敏度与准确性。这一进程将不仅 优化针对 PIK3CA突变患者的治疗策略,也为乳腺癌的精准 医疗提供更为坚实的临床依据与多样化的治疗选择,从而进一步改善患者的预后。
赵佳宁,刘月平. 乳腺癌PIK3CA突变的临床意义及其检测研究进展[J]. 临床与实验病理学杂志,2024,40(9):973-978. DOI:10.13315/j.cnki.cjcep.2024.09.014.











 苏公网安备32059002004080号
苏公网安备32059002004080号


