神经内分泌肿瘤的药物治疗在过去几十年中取得了显著进展。烷化剂作为一类历史悠久的化疗药物,在神经内分泌肿瘤中,尤其是胰腺神经内分泌肿瘤的治疗中,占据着重要地位。本文为复旦大学附属肿瘤医院陈洁教授对烷化剂的作用机制、发展历史、在不同类型神经内分泌肿瘤中的疗效等内容进行梳理总结,并探讨烷化剂在临床应用中的关键问题和最新进展。
烷化剂的作用机制与分类
神经内分泌肿瘤(NENs)的治疗策略日益多样化和精细化。在系统治疗层面,NENs的抗肿瘤治疗药物主要包括生长抑素类似物、各类靶向药物、化疗、肽受体放射性核素治疗(PRRT),免疫治疗尚处于探索阶段。在这些治疗手段中,化疗占据着重要地位,但其应用需根据NENs的病理类型进行细分。对于分化差的神经内分泌癌(NEC),通常采用以铂类为主的化疗方案;而对于分化良好的NET,则主要依赖于烷化剂。
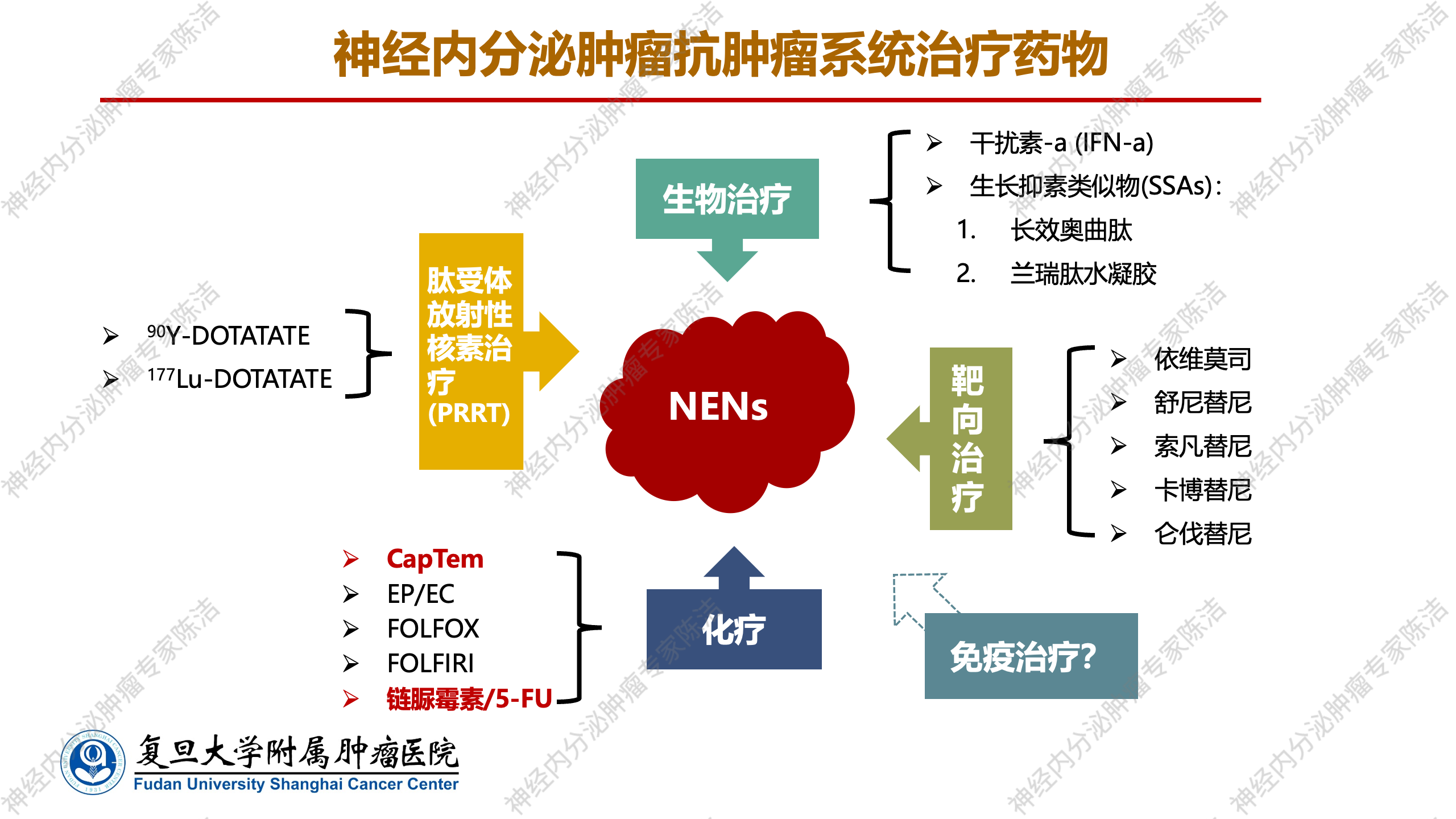
烷化剂是最早用于肿瘤化疗的药物之一,其主要作用机制是通过抑制肿瘤细胞DNA转录为RNA,阻断蛋白质合成。具体而言,烷化剂能够以烷基取代DNA链上的氢原子,形成DNA链间的交联结构,从而阻止DNA的转录,产生细胞毒性、致突变甚至致癌效应。根据化学结构和作用特点,烷化剂可分为六大类(氮芥类、乙撑亚胺与甲撑亚胺衍生物、烷基磺酸酯类、亚硝脲类、三嗪类和铂类抗肿瘤药)。在神经内分泌肿瘤治疗中,主要涉及亚硝脲类和三嗪类。其中,亚硝脲类的代表药物是链脲霉素,而三嗪类的代表药物包括达卡巴嗪和替莫唑胺。

烷化剂在神经内分泌肿瘤治疗中的发展历程
烷化剂在NET治疗中的应用历史悠久,尽管其推广初期步伐缓慢,但其重要性逐渐得以确立。神经内分泌肿瘤早在1907年得以发现,但在上世纪70年代之前,由于缺乏有效药物,临床关注度较低,处于一个“沉寂阶段”。直至上世纪70年代末期,首个化疗药物——达卡巴嗪(DTIC)开始被尝试用于NET的治疗。尽管进展缓慢,但其应用逐步推进:1977年,达卡巴嗪首次进入NET治疗领域;十年后,Surgery杂志发表了其回顾性临床研究;直至2001年,针对胰腺NET,一项前瞻性II期临床研究才得以完成。达卡巴嗪因此成为第一个用于分化良好神经内分泌瘤治疗的化疗药物。随后,第二种烷化剂——链脲霉素(STZ)开始应用于临床,其影响力更为显著。1980年,一项针对胰腺神经内分泌瘤的前瞻性II期临床研究发表在备受瞩目的New England Journal of Medicine(NEJM)期刊,随后的12年,其III期临床研究也同样在该杂志上发表。链脲霉素作为一种沿用至今的化疗药物,其后续的II期临床研究仍在继续进行,与其他化疗药物进行比较,持续探索其应用潜力。然而,链脲霉素目前在中国国内尚未上市。
达卡巴嗪和链脲霉素作为早期烷化剂,其共同特点是需要静脉用药,这在临床使用上带来了一定的不便。进入21世纪,新一代的烷化剂——口服替莫唑胺(TMZ)的出现,解决了给药便利性的问题,标志着烷化剂在NET治疗领域的一次重要进步。从2006年Journal of Clinical Oncology(JCO)期刊发表TMZ的II期临床研究,到2012年进一步的临床试验,再到2022年其用于胰腺神经内分泌肿瘤的前瞻性临床研究也在JCO上发表,一系列研究推动了TMZ的广泛应用。TMZ逐渐成为目前神经内分泌肿瘤化疗中主流的烷化剂,其口服给药的优势和良好的耐受性使其在临床实践中占据了主导地位。这一发展历程充分体现了烷化剂作为“古老但重要”的化疗药物,在神经内分泌肿瘤治疗中不断演进和完善的过程。

达卡巴嗪在神经内分泌肿瘤治疗中的应用
达卡巴嗪(DTIC)是首个应用于NET治疗的烷化剂。在早期探索阶段,一项1983年的小型前瞻性II期临床研究评估了DTIC单药治疗胰腺外神经内分泌肿瘤的疗效,结果显示其中位无进展生存期(PFS)约为4.5个月,总生存期(OS)为11.75个月,整体疗效表现不甚理想。随后,1998年发表的另一项II期临床研究中,DTIC联合氟尿嘧啶和亚叶酸钙的21天治疗方案,在18例患者中仅观察到1例部分缓解(PR)。这些早期研究结果共同表明,无论单药还是联合氟尿嘧啶,DTIC在胰腺外神经内分泌肿瘤中的疗效相对有限。
然而,DTIC在胰腺神经内分泌肿瘤(pNET)治疗中却展现出优势。一项2001年发表于Annals of Oncology的II期临床研究,评估了DTIC在50例可评估疗效的pNET患者中的表现。研究结果令人鼓舞,其客观有效率(ORR)达到33%,中位PFS为10个月,OS为10.9个月。此项研究明确指出DTIC在pNET中取得了令人满意的临床疗效。因此,早期研究便揭示了烷化剂的一项重要特点,即总体而言,烷化剂对胰腺神经内分泌肿瘤的疗效似乎优于胰腺外神经内分泌肿瘤。

链脲霉素在神经内分泌肿瘤治疗中的应用
链脲霉素(STZ)是一种源于革兰氏阳性菌——链霉菌的细胞毒性抗生素。其在动物模型中展现出对胰岛细胞的毒性作用,最初被用于建立糖尿病模型,因其能够特异性摧毁胰岛细胞。基于此特性,研究人员推测其可能对起源于胰岛的神经内分泌肿瘤具有治疗潜力,并率先在pNET中证实了其疗效。
一项具有里程碑意义的III期前瞻性随机对照临床研究于1992年发表在NEJM期刊。该研究比较了STZ联合多柔比星与STZ联合氟尿嘧啶在不可切除的分化良好pNET中的疗效。结果显示,STZ联合多柔比星组的ORR和中位PFS均显著优于STZ联合氟尿嘧啶组,提示STZ与多柔比星的联合方案具有较好的临床效果。STZ在胰腺神经内分泌肿瘤中还进行了多项重要的II期和III期临床试验,不同研究联合方案略有不同,总体ORR 30%~69%,中位PFS 6.9~23.7个月。
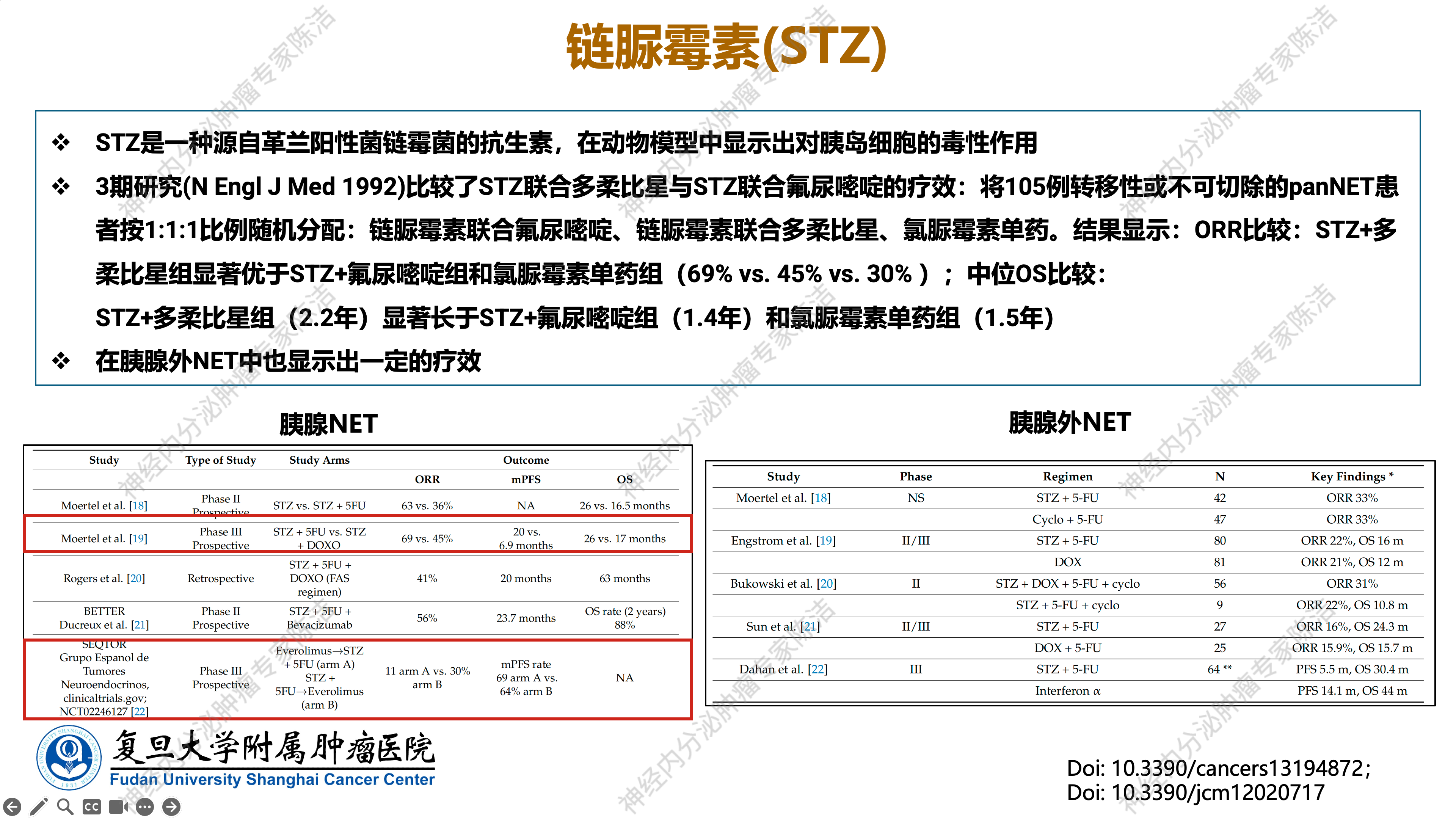
然而,STZ在胰腺以外NET中的表现则相对逊色。尽管进行了一些II期或II/III期临床试验,但STZ在胰腺以外NET中的PFS时间总体上未能达到其在pNET中的疗效水平。
STZ联合氟尿嘧啶的方案与依维莫司在胰腺神经内分泌肿瘤的序贯治疗研究中也得到了广泛关注,该研究是探讨神经内分泌肿瘤药物治疗顺序的重要III期临床研究。研究结果显示,STZ联合氟尿嘧啶与依维莫司无论何者在前、何者在后,总体上均能达到超过20个月的PFS时间。这表明药物的序贯使用对总体的PFS时间影响不大,也提示神经内分泌肿瘤药物之间的排序是一个高度个体化的问题。

替莫唑胺在神经内分泌肿瘤治疗中的应用
进入21世纪,口服替莫唑胺(TMZ)作为新一代烷化剂开始应用于临床。TMZ在体内可转化为与达卡巴嗪相同的活性代谢产物MTIC。由于TMZ口服给药的便利性和更好的耐受性,逐渐取代达卡巴嗪成为NET化疗的重要选择。

早期回顾性研究显示,TMZ单药治疗转移性NET的ORR为15%,PFS为7个月。在联合治疗方案中,最早的联合治疗探索是TMZ联合沙利度胺(沙利度胺具有一定的抗血管生成作用)。这项2006年的前瞻性临床研究评估了该联合方案在包括胰腺NET、胰腺外NET和副节瘤等不同部位NET中的整体疗效,结果显示总体ORR达到约25%,PFS时间约为13.5个月。在7例应答患者中,有5例是pNET,这也提示pNET的效果会更好。此后,在2012年发表的一项II期临床研究中,将沙利度胺替换为更主流的抗血管生成靶向药物贝伐珠单抗。TMZ联合贝伐珠单抗治疗包括胰腺和胰腺外NET的总ORR约为15%。值得注意的是,所有出现PR(部分缓解)应答的病例均发生于胰腺亚组。整体PFS时间为11个月,其中胰腺组PFS约为14个月,胰腺外组为7.3个月。无论是与沙利度胺联合还是与贝伐珠单抗联合,都表明TMZ对pNET的效果优于胰腺外NET。

在上述联合方案之后,替莫唑胺与卡培他滨的联合(CAPTEM),使得肿瘤控制疗效进一步提升。一项2021年发表的、纳入了462例接受CAPTEM化疗的患者(约80%是高分化神经内分泌瘤,以胰腺为主)的研究显示,CAPTEM方案对pNET的ORR接近50%,PFS长达23个月,而对胰腺外NET的ORR为30%,PFS约10个月,再次证实了TMZ对pNET的显著优势。另一项2020年发表的大型回顾性临床研究,评估了CAPTEM方案在100例高分化胰腺内分泌肿瘤中的疗效,其PFS时间也能够达到约21个月,ORR能够达到51%左右。

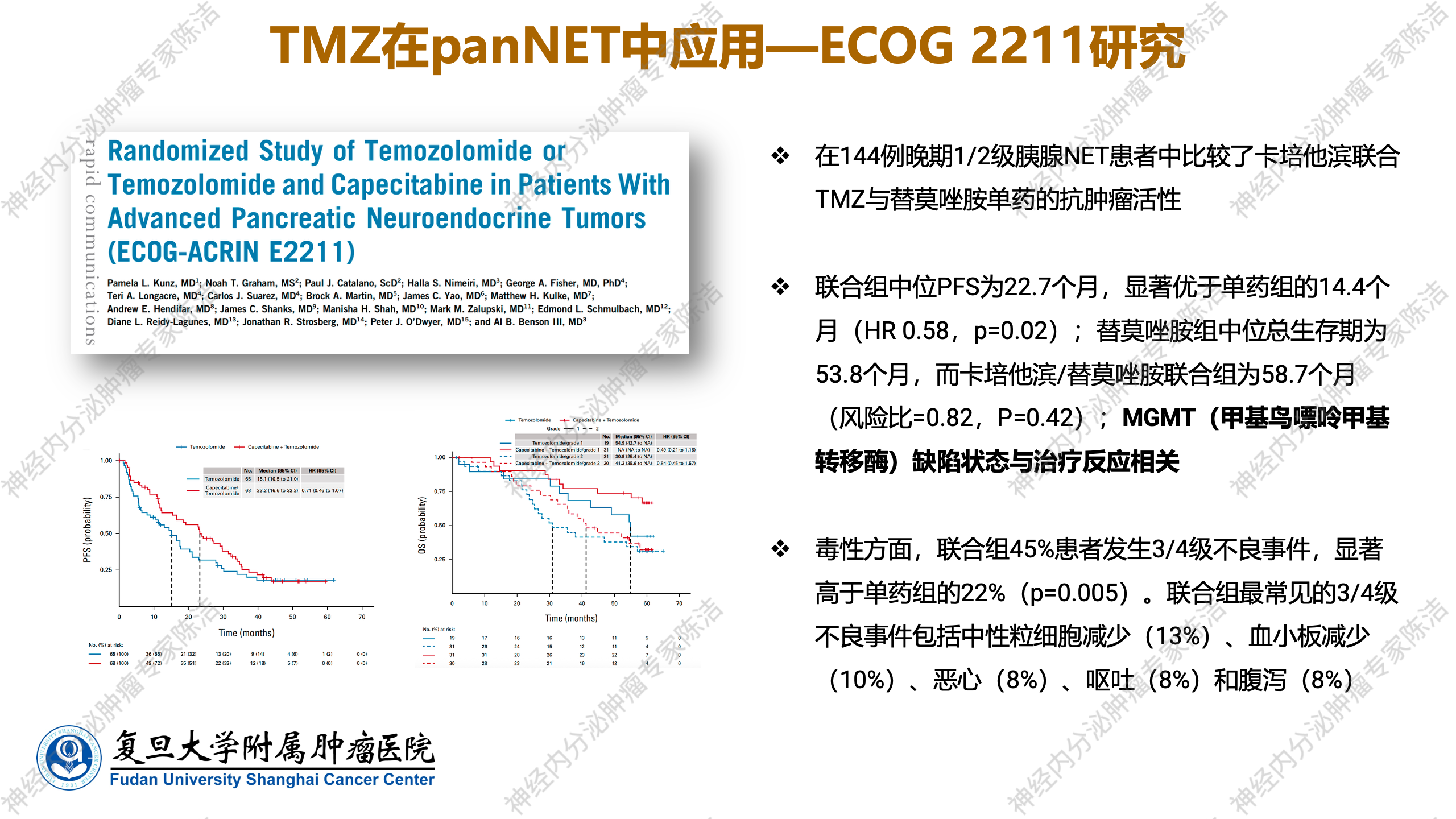
ECOG 2211前瞻性临床研究进一步证实了CAPTEM方案在晚期G1/G2级pNET中的抗肿瘤活性,该研究比较了卡培他滨联合TMZ与TMZ单药的疗效。研究显示,CAPTEM方案的PFS为22.7个月,而单药组的PFS时间为14.4个月,联合治疗优势明显。另外,该研究还证实,MGMT缺失状态与更好的治疗反应相关。
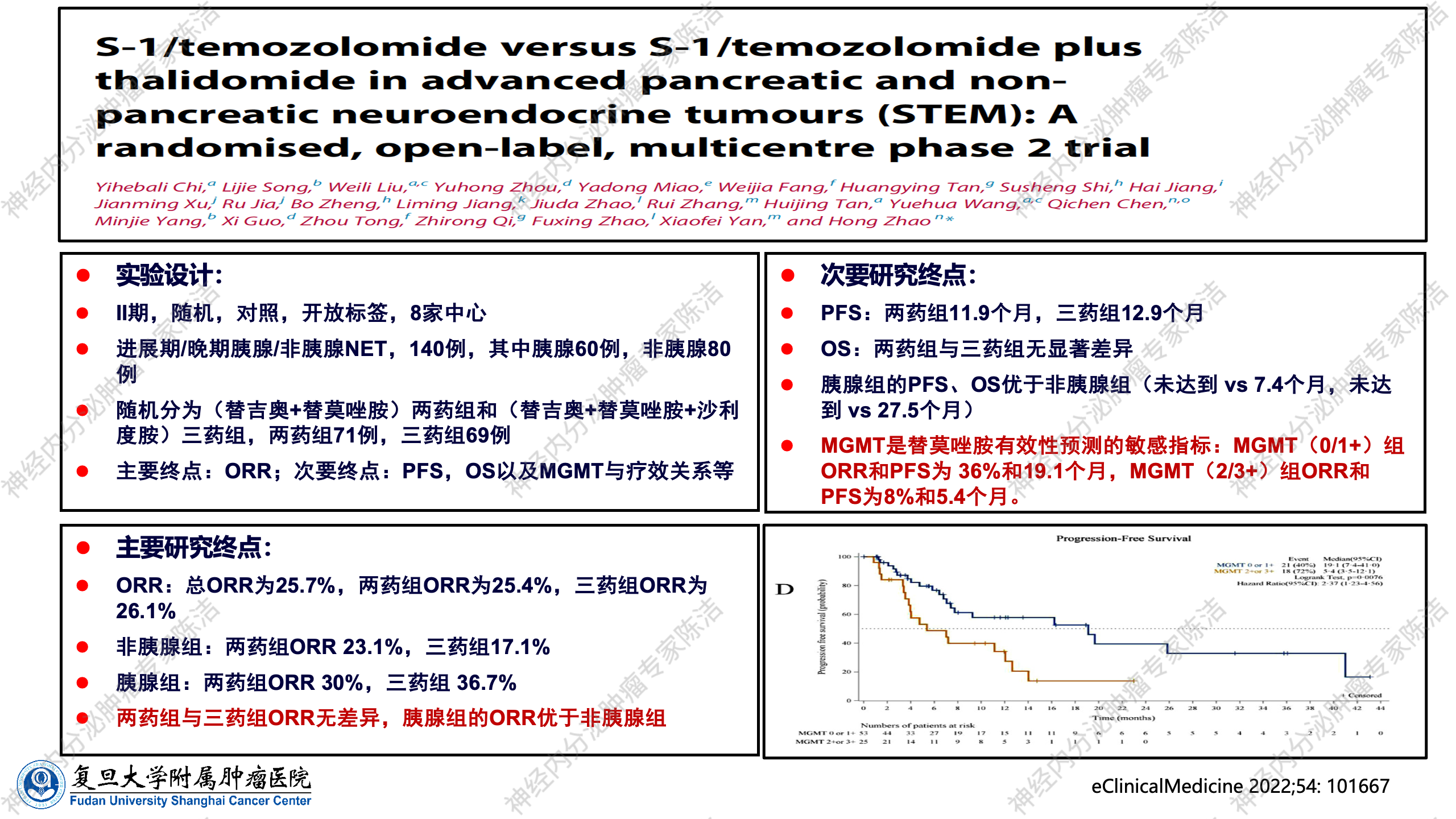
此外,在中国国内,中国医学科学院肿瘤医院也进行了一项前瞻性II期临床研究,评估了TMZ联合替吉奥(一种口服氟尿嘧啶类药物,方案被称为STEM方案),以及TMZ联合替吉奥再加上沙利度胺的三药联合方案,在胰腺和非胰腺NET中的疗效。该研究结论非常贴近临床真实世界:首先,三药联合与两药联合效果相近,即沙利度胺的联合没有太大意义。其次,TMZ联合替吉奥对胰腺和非胰腺神经内分泌肿瘤均具有疗效。第三,无论是PFS还是OS,胰腺组都比非胰腺组更好,再次证实了该联合方案对pNET具有更优疗效。同时,该研究也证实了MGMT表达与TMZ疗效的显著负相关性。
TMZ在pNET中展现出较好的疗效,无论作为单药、联合抗血管生成靶向药物,还是与当前主流的卡培他滨联合应用,均取得了显著的临床获益。此外,TMZ在胰腺外NET中的应用也已有多项临床研究进行探索。总体而言,TMZ在胰腺外NET中的ORR在9%~36%之间,PFS则在6.4个月~15.3个月之间。这种较大的疗效区间波动性主要源于胰腺外NET本身的高度异质性。胰腺外NET涵盖了多个原发部位的肿瘤。此外,不同临床研究纳入的患者群体存在差异,有些研究可能仅聚焦于某一特定部位的NET(如仅纳入肺部NET),而另一些研究则可能纳入了不同分级(包括G1、G2,甚至G3级)的胰腺外NET,与之前主要关注G1、G2级pNET的研究有所不同。因此,这些因素共同导致了TMZ在胰腺外NET中总体疗效数据呈现出较大的变异范围。

CAPTEM方案在G3级神经内分泌肿瘤中的应用及疗效
CAPTEM方案在G3级NET中也表现出不错的疗效。一项北美多中心大样本临床研究纳入了130例胃肠胰NET,其中2/3为胰腺原发,92%的患者使用CAPTEM方案。研究显示,作为一线用药,CAPTEM方案对G3级NET的ORR可达51%,中位OS可达到19.2个月。同样,对G3级NET,胰腺的效果也比胃肠道的效果会更好。

替莫唑胺与卡培他滨联合应用的关键分子:MGMT
基于上述一系列研究,在NET的化疗实践中,TMZ联合卡培他滨的CAPTEM方案已成为临床上的主流选择。这一联合方案之所以能够逐步演进为主流,其核心在于一个重要的分子机制,即对O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)活性的调控。
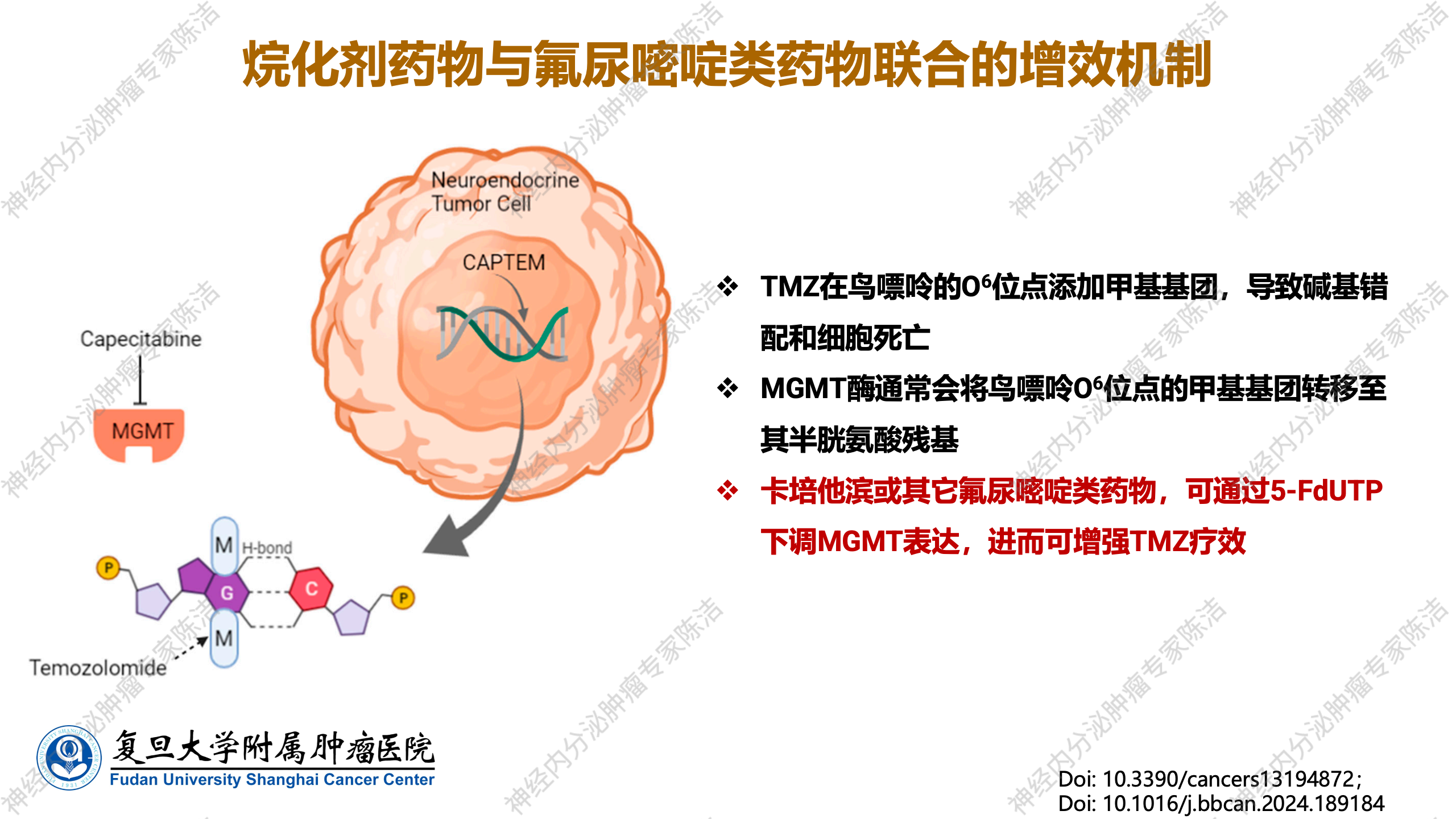
MGMT是一种关键的DNA修复酶,其主要功能是修复由烷化剂在DNA鸟嘌呤O6位点形成的甲基基团损伤。具体而言,MGMT通过将甲基基团转移到自身的半胱氨酸残基上,从而恢复DNA的完整性,有效逆转烷化剂对DNA的破坏作用。因此,MGMT酶的活性水平与烷化剂类化疗药物的敏感性呈负相关关系:肿瘤细胞中MGMT酶活性越高(即表达水平越高),其DNA修复能力越强,烷化剂对肿瘤细胞的杀伤作用就越弱,导致治疗效果不佳。反之,如果肿瘤细胞中MGMT酶活性较低,甚至发生缺失或不表达,则DNA修复能力受损,烷化剂诱导的DNA损伤无法有效修复,从而增强其细胞毒性,使肿瘤细胞对烷化剂更为敏感,治疗效果显著提升。这一基于分子机制的推断,已通过一系列前瞻性和回顾性临床研究的反复验证,确立了MGMT酶表达水平作为预测烷化剂疗效的重要生物标志物。
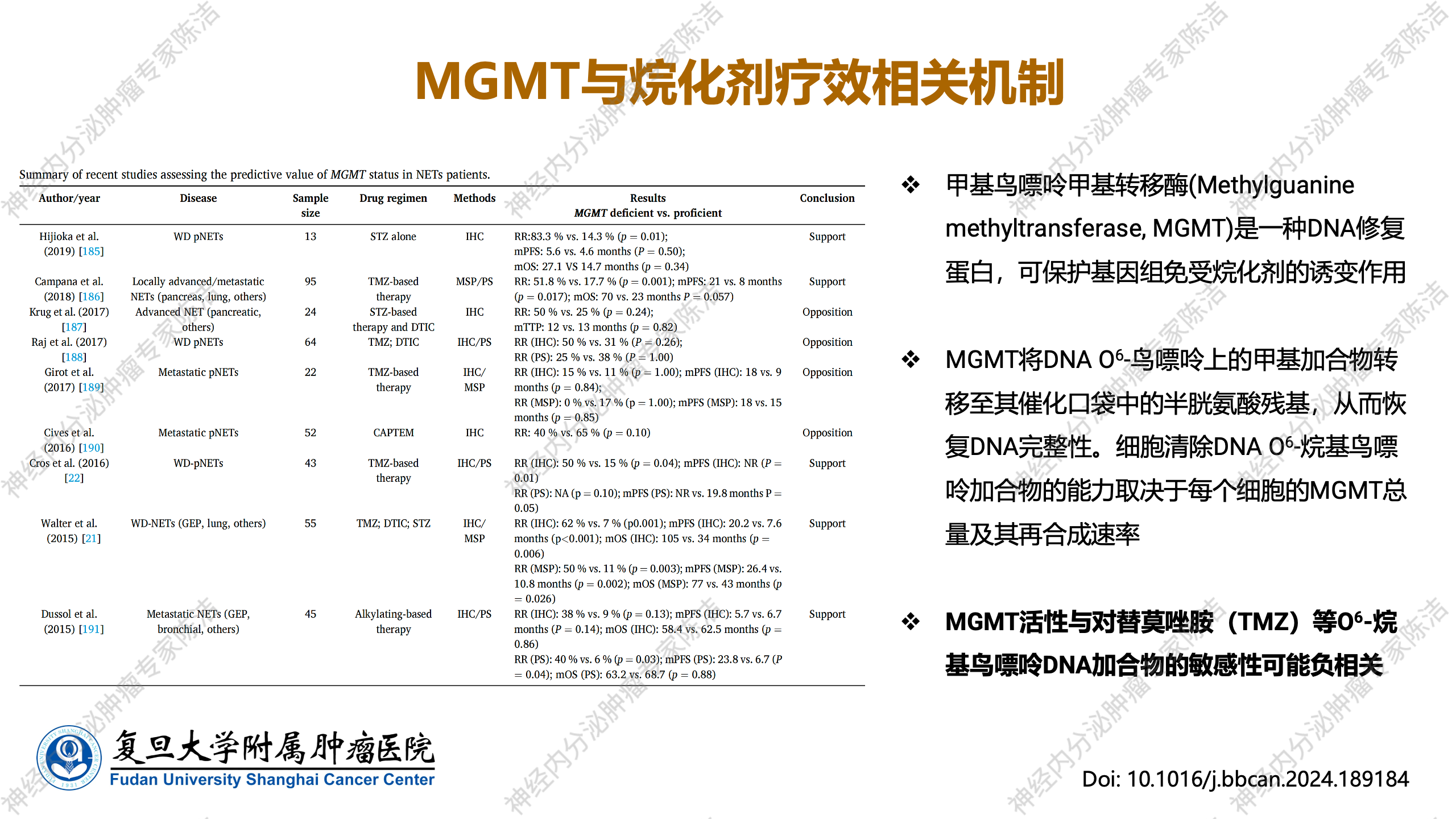
也是基于此分子基础,从基础研究到临床前期研究均已证实,卡培他滨或氟尿嘧啶类药物能够有效下调MGMT酶的表达,进而减弱MGMT的活性,发挥协同增强TMZ对肿瘤细胞DNA的烷化损伤的作用,最终显著提升烷化剂类药物的临床疗效。正是这一协同作用机制,使得TMZ与卡培他滨的联合方案在众多尝试中脱颖而出,成为神经内分泌肿瘤治疗中广为接受且疗效显著的策略。
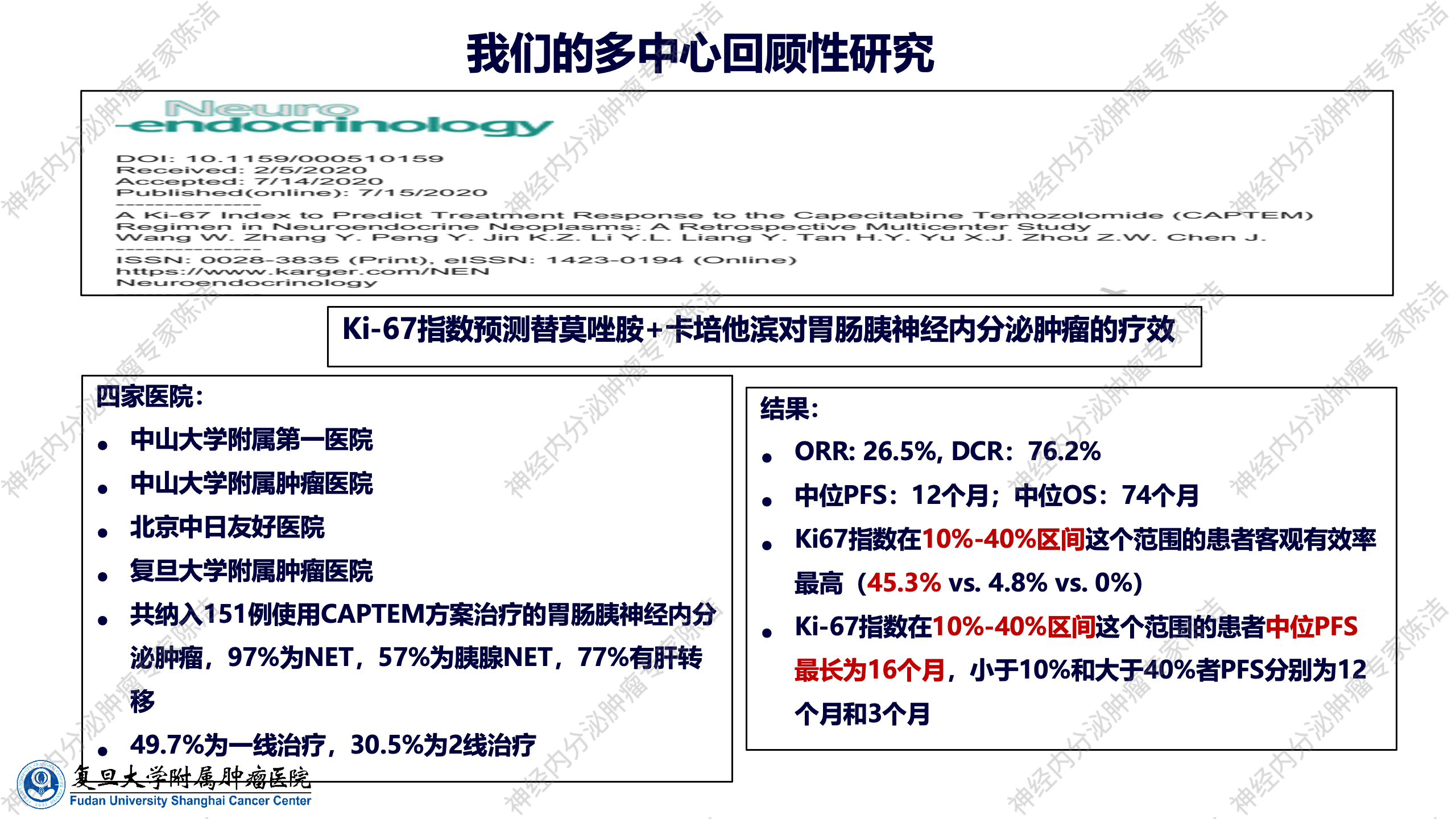
基于Ki-67指数的CAPTEM方案优化应用
我们牵头的一项国内多中心回顾性临床研究,深入探讨了CAPTEM方案在胃肠道及胰腺NET中的疗效。这一研究发现,当肿瘤的增殖指数Ki-67位于10%~40%区间时,CAPTEM方案的临床疗效通常更佳。值得注意的是,这一Ki-67区间恰好涵盖了世界卫生组织(WHO)分级中G2级肿瘤的高增殖区域以及G3级肿瘤的低增殖区域。这表明,Ki-67指数在10%~40%之间的患者群体,是接受CAPTEM方案治疗后最具获益潜力的亚组。鉴于此研究的发现,目前国内的临床指南已根据这一证据对CAPTEM方案的推荐进行了相应的调整,使得Ki-67指数成为临床实践中指导CAPTEM方案选择和优化治疗策略的重要参考依据。
烷化剂在罕见胰腺外神经内分泌肿瘤中的应用
除了在胃肠胰神经内分泌肿瘤中的广泛应用,基于TMZ的化疗方案在一些罕见的NET类型中也展现出一定的治疗潜力。例如,在胸腺神经内分泌肿瘤这一治疗选择极为有限的瘤种中,中山大学附属第一医院团队进行的一项回顾性临床研究评估了CAPTEM方案的疗效。研究结果显示,CAPTEM方案在胸腺神经内分泌肿瘤中取得了约15%的ORR和13个月的PFS,这在当前治疗困境下被认为是相对可观的疗效。目前,该团队正对更大样本量的数据进行进一步分析,以期提供更确凿的证据。

此外,在转移性副神经节瘤这一同样治疗选择稀缺的疾病中,中国医学科学院肿瘤医院在ENETS年会上发布的一项回顾性临床研究,报告了TMZ联合替吉奥(STEM方案)的治疗效果。尽管该研究纳入的样本量相对较小,但其结果令人鼓舞:总疾病控制率达到了100%,且中位PFS和OS均超过20个月。鉴于转移性副神经节瘤可用药物极少,STEM方案在转移性副神经节瘤中的应用值得进一步探索。

烷化剂相关高肿瘤突变负荷与免疫治疗
近年来,TMZ作为烷化剂,其作用机制的探索已扩展到肿瘤微环境的调控,尤其是其在增强免疫治疗效果方面的潜力。研究发现,TMZ能够诱导肿瘤突变负荷(TMB)升高,有望将“免疫冷肿瘤”转化为对免疫检查点抑制剂(如PD-1/PD-L1抑制剂)更敏感的“免疫热肿瘤”。这一现象最初在2022年一项针对MGMT缺陷的转移性结直肠癌研究中被发现:TMZ治疗后TMB升高,随后帕博利珠单抗治疗实现了疾病稳定。

这一突破性发现为NET的治疗带来了新思路。2023年至2024年的多个国际会议报道显示,TMZ治疗的NET,特别是pNET,与结直肠癌类似,也可被诱导产生高突变负荷,从而可能增强后续免疫治疗的疗效。例如,2024年ENETS年会上,来自欧洲的3项回顾性临床研究均证实了这一现象:瑞典研究观察到转移性pNET在烷化剂治疗后出现错配修复缺陷和高突变负荷表型;意大利研究发现TMZ治疗后的pNET肿瘤级别升高并出现高突变负荷;法国研究也显示TMZ治疗后的pNET部分级别进展至G3级,同时出现高突变负荷。




这些研究结果共同提示,经过TMZ治疗后出现高突变负荷的NET病例,后续可能对免疫检查点抑制剂治疗产生应答。鉴于NET患者治疗周期较长,且多会接受以TMZ为基础的烷化剂治疗,因此,对于长期接受烷化剂治疗后肿瘤进展的患者,建议进行再活检。此举旨在评估肿瘤级别变化,并进行基因检测以确认是否存在烷化剂治疗相关的高突变负荷。尽管这种转化为免疫治疗敏感肿瘤的机会可能不常见,但它至少为这些患者提供了一个潜在的治疗新选择。
烷化剂的临床应用中的常见问题
尽管烷化剂在NET治疗中效果显著,但在实际应用中仍面临一些关键问题,同时也有新的研究方向。首先是治疗疗程问题。目前对于TMZ的最佳治疗疗程尚无共识,但有研究提示,TMZ治疗超过12个月会增加继发性血液系统肿瘤的风险。因此,建议在TMZ使用6个月时评估疗效,并考虑是否继续使用,一般不建议治疗疗程超过12个月,以避免累积毒性。在12个月后,可考虑切换至其他治疗(如生长抑素类似物或靶向药物维持治疗),或尽量避免过早使用烷化剂,特别是在未来可能需要接受PRRT的患者中,更需保护骨髓功能。

在NET的临床管理中,烷化剂的长期应用会累积血液系统毒性,因此其疗程并非可以无限延长。一个关键的临床问题是:在烷化剂停用后,如果肿瘤再次进展,是否可以重新使用烷化剂进行“再挑战”治疗,以及其疗效如何?一项具有重要临床指导意义的前瞻性研究专门探讨了这一问题,评估了CAPTEM方案或达卡巴嗪联合氟尿嘧啶方案再次治疗NET的疗效和安全性。

该研究设计高度贴近临床实际,纳入了G1、G2、G3级的pNET患者。在第一阶段,患者接受烷化剂治疗并获得疗效后暂停治疗,每三个月进行复查,直至肿瘤进展。随后,患者重新接受烷化剂治疗,进入第二阶段。通过分析两个阶段的PFS时间、疗效相关因素以及治疗耐受性,该研究为临床决策提供了宝贵依据。研究结果显示,在第一阶段烷化剂治疗中,患者平均接受约8个周期的治疗,ORR约为55%,中位PFS为23.7个月,与既往前瞻性及回顾性研究结果基本一致。更重要的是,在第一阶段治疗结束后,患者的无化疗间隔时间(即治疗暂停期)中位可达14.7个月。这表明患者在停药后并非会立即进展,多数患者能够获得相当长期的“化疗假期”,这对于改善患者生活质量和保护骨髓功能至关重要。
当肿瘤进展后进入第二阶段再挑战治疗时,患者平均接受约4个周期的烷化剂治疗。尽管此时的ORR相对较低,肿瘤更多表现为稳定状态,而非显著缩小,但第二阶段的中位PFS仍可达到9.2个月。这一PFS数据具有重要临床意义,因为与其他靶向药物(如索凡替尼、依维莫司)的中位PFS(通常在10~11个月左右)相比,即使是烷化剂的第二轮使用,其疗效依然可观。这充分证明了烷化剂再挑战策略在临床上的可行性,它能使患者在总的获益时长上得到显著延长,同时又能获得宝贵的休息时间。
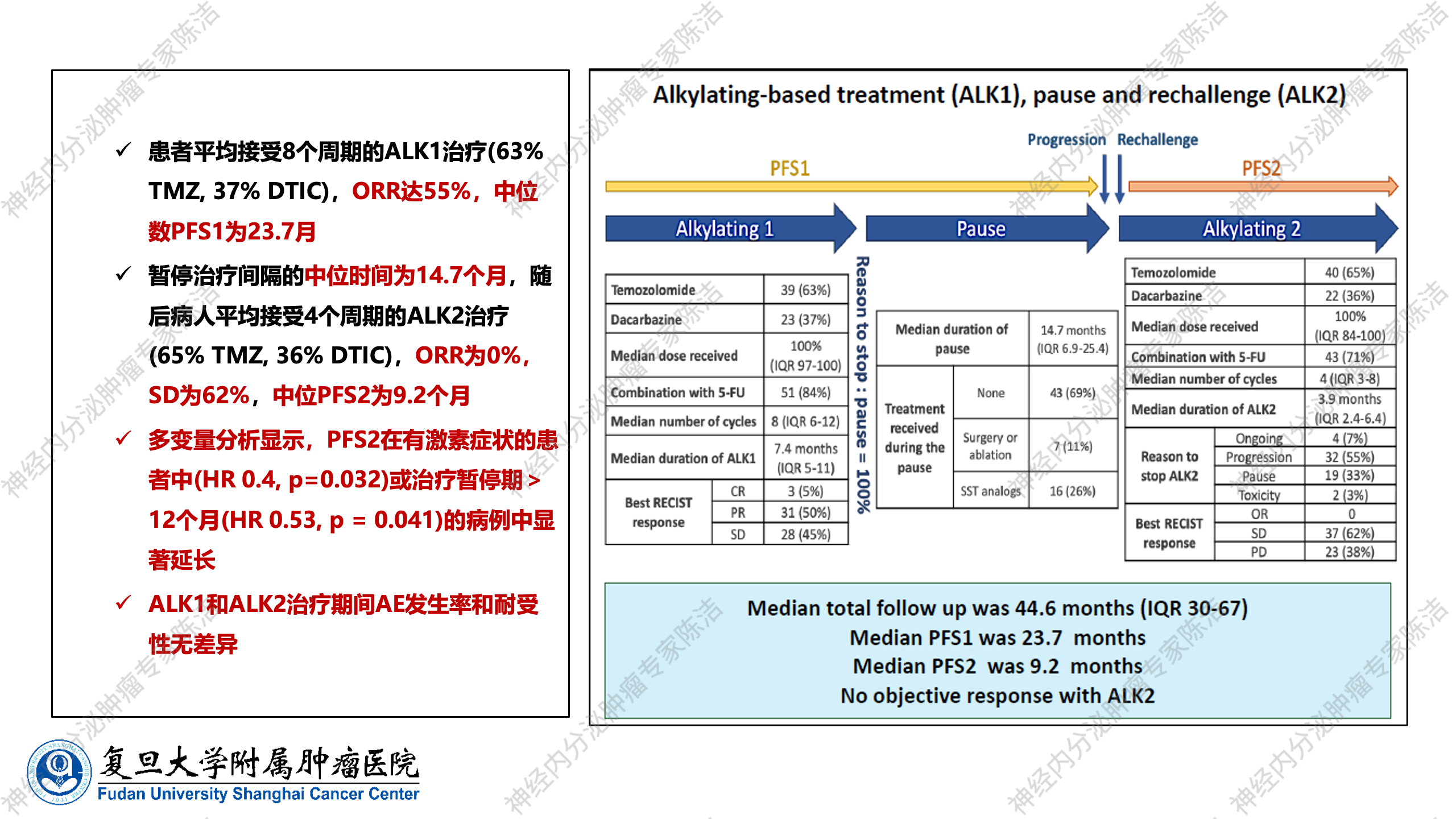
多因素分析进一步揭示,部分患者在再挑战治疗后能获得更好的PFS延长。其中,有激素症状的患者是一个积极因素,而更重要的是,治疗暂停期超过12个月的患者,在重新使用烷化剂后,其第二阶段的PFS(PFS2)表现更优。这提示,充分的休息时间可能有助于恢复肿瘤对烷化剂的敏感性。此外,无论是在第一阶段还是再挑战治疗中,烷化剂的整体耐受性均较好,不良反应发生率无显著差异。因此,这项研究为烷化剂的临床应用提供了重要指导:既要避免长期不间断使用可能导致的累积毒性,又要合理利用再挑战策略,在肿瘤进展后为患者提供有效且可耐受的治疗选择,从而实现患者长期生存获益与生活质量的平衡。
此外,对于部分高分化NET患者可能伴有较差的一般情况,例如体能状态评分较低、存在多种严重的合并症、已经接受过三线或以上的多线治疗,或者存在重要器官功能不全等情况。对于这类身体条件相对较弱,但临床上仍需考虑烷化剂治疗的患者,传统的标准剂量化疗方案可能导致较大的毒性负担。
针对这一特殊患者群体,一项在2024年的ENETS年会上报道的意大利多中心II期临床研究,为我们提供了新的治疗思路:采用低剂量TMZ单药进行节拍化疗。节拍化疗的特点是药物以较低剂量、更频繁的间隔给药,旨在持续抑制肿瘤血管生成和肿瘤细胞增殖,同时最大限度地降低毒副作用。研究结果显示,对于一般情况较差的晚期高分化神经内分泌肿瘤患者,低剂量TMZ节拍化疗总体疗效可观,且安全性良好,患者耐受性较高。因此,这种节拍化疗方式为临床医生处理这类复杂病例提供了一种有效且相对安全的治疗选择。

总结与展望
烷化剂,特别是TMZ,在神经内分泌肿瘤的系统治疗中扮演着不可或缺的角色。从最初的达卡巴嗪到链脲霉素,再到如今广泛应用的TMZ及其与卡培他滨联合的CAPTEM方案,烷化剂在NET的疗效方面展现出显著优势。尽管其长期应用存在血液学毒性风险,但合理的治疗疗程管理和再挑战策略可以最大化患者获益。此外,烷化剂诱导肿瘤高突变负荷的“免疫转化”作用,为未来NET的免疫治疗提供了新的联合策略和研究方向。随着对烷化剂作用机制和临床应用细节的深入理解,相信其在NET治疗中的价值将得到更充分的发挥。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-烷化剂(替莫唑胺)治疗专场回放:
https://doctor.liangyihui.net/#/doc/147423

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。












 苏公网安备32059002004080号
苏公网安备32059002004080号


