2025年5月,辽宁省肿瘤医院张强教授、中国医科大学附属第一医院徐莹莹教授、陆军军医大学第二附属医院朱波教授团队联合开展的TRENDⅡ期临床试验成果发表于《自然》旗下期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=40.8)[1]。该研究首次证实,国产PD-1抑制剂替雷利珠单抗联合无铂、低剂量化疗方案(白蛋白紫杉醇序贯表柔比星/环磷酰胺)用于三阴性乳腺癌(TNBC)新辅助治疗,可实现68.2%的病理完全缓解率(pCR),且严重不良反应发生率显著低于含铂方案,更通过多组学分析揭示了 CDKN1A+ CD8 T 淋巴细胞等新型生物标志物的预测价值,为TNBC新辅助治疗提供了兼具临床实用性与科学前瞻性的中国方案。
【肿瘤资讯】特此邀请张强教授深入分析该研究的结果与意义。
本期特邀专家——张 强 教授
辽宁省肿瘤医院乳腺外科四病区主任,主任医师,医学博士
大连理工大学、中国医科大学及大连医科大学肿瘤外科研究生导师
辽宁省“百千万人才”工程百层次人才
北京癌症防治学会乳腺癌个体化诊疗及MDT专业委员会候任主委
中国抗癌协会乳腺肿瘤整合康复委员会副主任委员
中国医药教育协会乳腺癌MDT学组副主任委员
中华医学会肿瘤分会乳腺学组委员
中国抗癌协会乳腺癌专业委员会委员
中国临床肿瘤学会乳腺癌专家委员会委员
先后在MD.Anderson癌症中心及欧洲肿瘤研究所(IEO)的乳腺科进修学习
研究概述
TNBC因缺乏治疗靶点,复发转移风险高,预后较差。尽管KEYNOTE-522和IMpassion-031等研究显示,新辅助免疫检查点抑制剂(ICI)联合化疗可显著提高pCR,并延长患者生存,但配伍化疗方案的优化及获益人群的筛选仍亟待探索。当前,铂类药物虽为新辅助免疫治疗的主流化疗配伍选择,但其所致的严重骨髓抑制可能通过破坏固有免疫细胞功能影响免疫治疗效果。此外,TNBC 在临床特征和治疗反应上的高度异质性,进一步增加了治疗靶点选择与精准方案开发的难度。因此,明确 TNBC 对免疫治疗应答的分子特征及新型生物标志物,成为筛选免疫治疗获益人群的关键。
替雷利珠单抗是一种靶向程序性死亡蛋白 1(PD-1)的人源化 IgG4 变异型单克隆抗体,凭借高特异性、对 PD-1 的高亲和力、慢解离速率等特性,理论上可更持久地阻断免疫抑制信号,增强抗肿瘤免疫应答。目前,该药物联合化疗已在食管鳞状细胞癌(ESCC)和转移性鼻咽癌等多瘤种的一线治疗中展现生存获益[2,3],并且近期还获得了欧洲药品管理局(EMA)新增的鼻咽癌一线治疗适应症。此前,在中国,替雷利珠单抗已有 14 项适应症获得国家药监局批准,其中 11 项适应症已纳入国家医保药品目录,使其成为目前获批且纳入国家医保药品目录适应症数量最多的本土PD-1抑制剂。在全球范围内,替雷利珠单抗也在欧盟、英国、美国、韩国、瑞士、澳大利亚等国家和地区获批了多项适应症。鉴于替雷利珠单抗在多个瘤种中展现出的良好疗效与安全性,其在TNBC新辅助治疗中的应用潜力值得进一步挖掘,以期为TNBC患者带来更多临床获益。
基于此,张强教授团队开展了单中心、前瞻性、单臂Ⅱ期TREND试验(ChiCTR2000035262),旨在探索替雷利珠单抗联合低剂量化疗方案T-AC(白蛋白紫杉醇100mg/m² 序贯表柔比星75mg/m²+环磷酰胺600mg/m²)用于TNBC新辅助治疗的有效性与安全性,并通过多组学分析挖掘疗效预测生物标志物及肿瘤微环境(TME)动态特征[1]。
研究于2020年11月至2023年6月从辽宁省肿瘤医院入组53例局部进展期TNBC患者(肿瘤最大直径≥2cm 或淋巴结阳性且无远处转移),所有患者接受替雷利珠单抗(200mg q3w×24 周)全程联合化疗,前12周予白蛋白紫杉醇单药,后12周序贯蒽环类联合环磷酰胺。研究的主要终点为pCR,次要终点包括客观缓解率(ORR)和安全性。探索性终点包括疗效与 PD-L1 状态、TME免疫状态和/或遗传谱之间的潜在相关性。
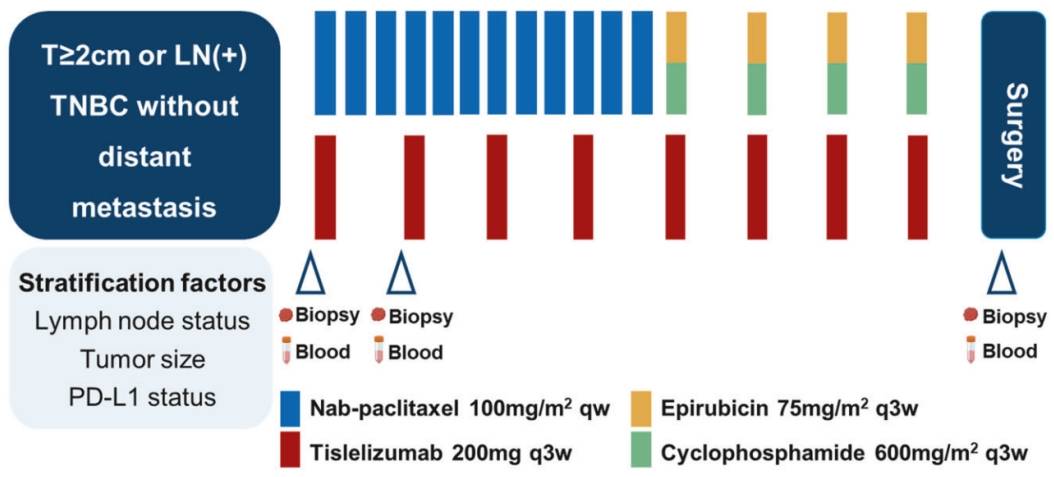 图1. 研究设计
图1. 研究设计
研究结果
基线特征
截至数据截止日期(2023年6月30日),中位随访时间为18.1个月(范围:4.8-31.9个月)。共有53例患者纳入安全性分析集,中位年龄为49岁,52.83%为绝经前。根据美国癌症联合委员会分期手册(AJCC,第八版)进行癌症分期,其中41例患者(77.36%)被诊断为T2期,31例患者(58.49%)为N1期,24例患者(45.28%)为 IIB 期。最终,44 例(83.02%)患者接受了手术,被纳入疗效可评价集(EES)。
疗效与安全性分析
在44例可评估疗效的患者中,30例(68.18%)达到了pCR(图2a),其中14例(31.82%)达到了完全缓解(CR),ORR为93.18%,显示出显著的疗效。此外,研究还观察到,高PD-L1表达水平与更好的pCR相关,PD-L1 CPS≥20组pCR率达89.47%(图2b)。
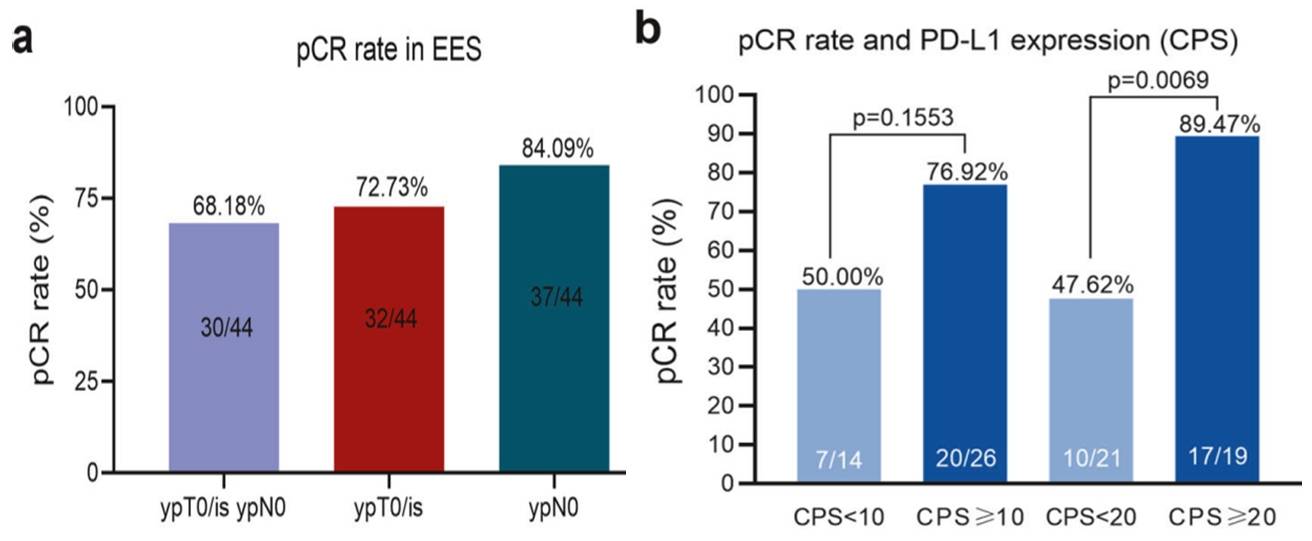 图2. a. 新辅助治疗后原发肿瘤(ypT0/is)和腋窝淋巴结(ypN0)的pCR率,b. 总病理完全缓解(tpCR)率与CPS的关系
图2. a. 新辅助治疗后原发肿瘤(ypT0/is)和腋窝淋巴结(ypN0)的pCR率,b. 总病理完全缓解(tpCR)率与CPS的关系
在安全性方面,90.57%(48/53)的患者经历了至少一次治疗相关不良事件(TRAEs),主要为脱发、恶心、肝损伤和贫血等。其中11.32%(6/53)为≥3级不良事件,主要为肝损伤和中性粒细胞减少。最常见的免疫相关不良反应是甲减和甲亢。
表1. 新辅助治疗期间的TRAEs情况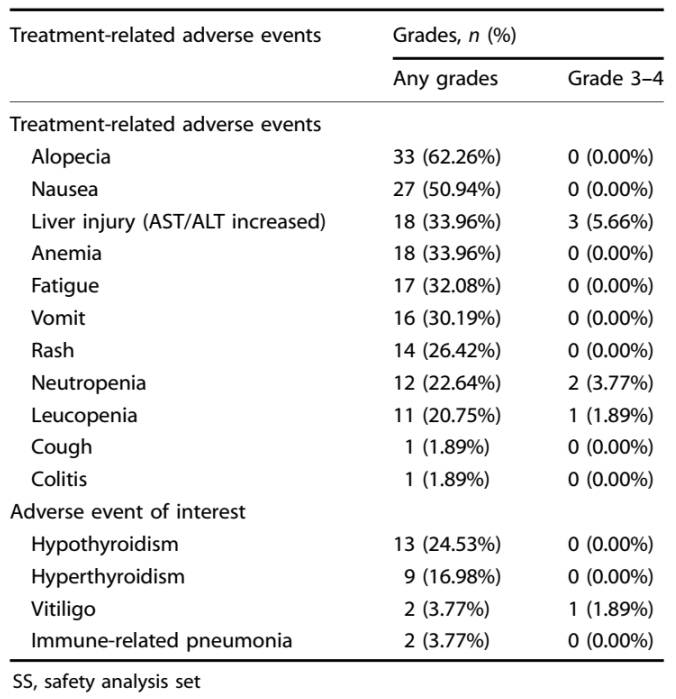
新辅助治疗前的基因表达谱
通过比较pCR与非pCR患者治疗前基因表达谱,发现pCR组新辅助治疗前GABRP、NECTIN4和CADM4基因表达上调,且富集TNF信号通路、T 细胞受体信号通路、JAK-STAT 信号通路、PD-L1表达和PD-1检查点通路等免疫相关通路。而非pCR组脂质代谢相关基因(如FABP3、ACOX2)表达上调。
研究者进一步通过分析新辅助免疫治疗前(C0期)的样本,识别了pCR和非pCR患者之间的三个差异表达基因(DEGs),并构建了一个预测模型。该模型能够显著区分pCR和非pCR患者,并预测新辅助免疫联合化疗的疗效(AUC 0.876;验证队列中的AUC为0.861),为术前筛选获益人群提供了潜在工具。
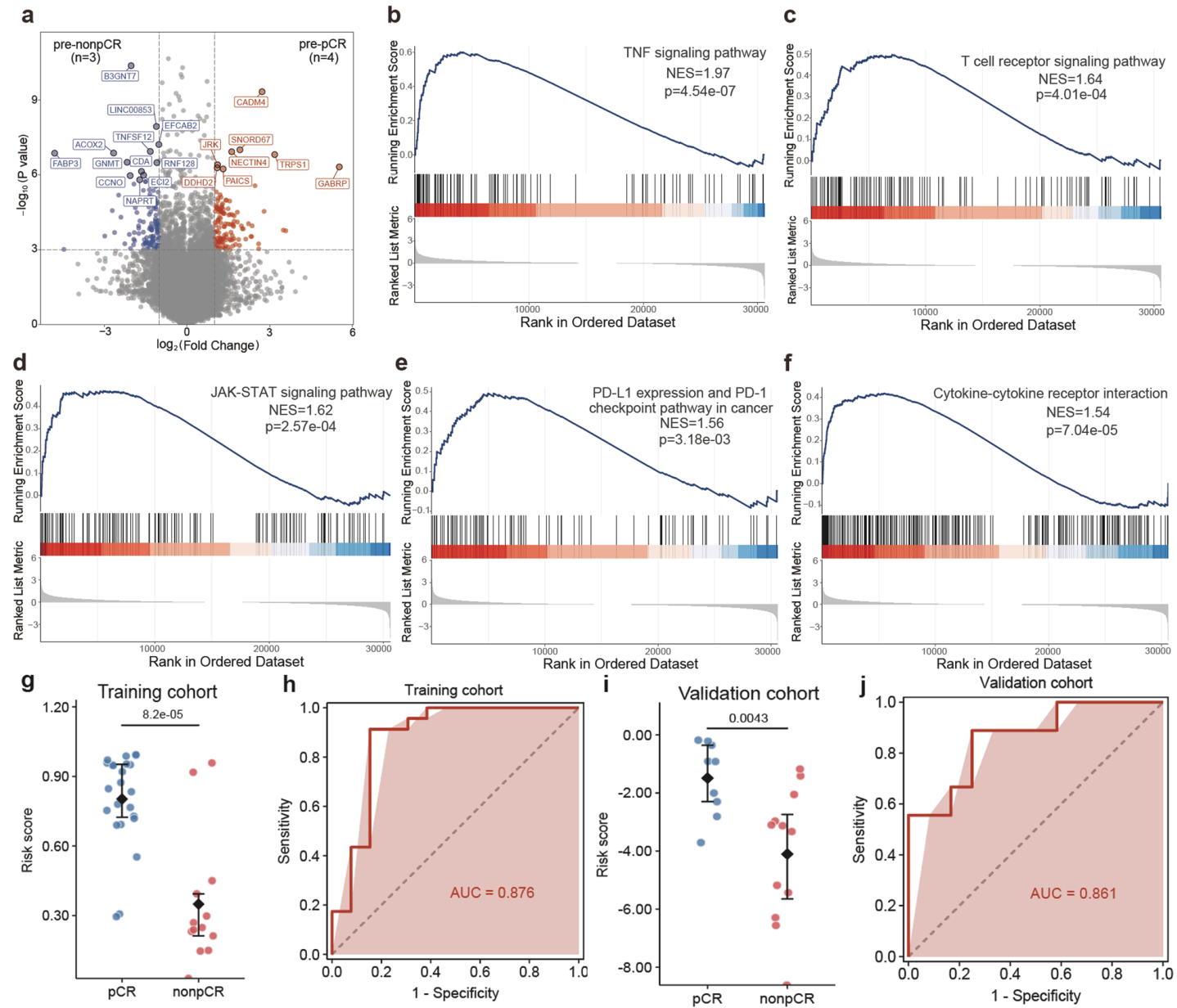 图3. 新辅助治疗前基因表达谱及反应预测指标 a. 基线(新辅助治疗前)pCR与非pCR 患者转录组特征的火山图;b-f. Hallmark TNF信号通路、T细胞受体信号通路、JAK-STAT信号通路、癌症中PD-L1/PD-1检查点通路以及细胞因子-细胞因子受体相互作用的基因集富集分析;g. 训练队列中pCR与非pCR患者预测评分的箱线图;h. 训练队列中预测模型的受试者工作特征曲线(ROC);i. 验证队列中pCR与非pCR患者预测评分的箱线图;j. 训练队列中预测模型的ROC曲线。
图3. 新辅助治疗前基因表达谱及反应预测指标 a. 基线(新辅助治疗前)pCR与非pCR 患者转录组特征的火山图;b-f. Hallmark TNF信号通路、T细胞受体信号通路、JAK-STAT信号通路、癌症中PD-L1/PD-1检查点通路以及细胞因子-细胞因子受体相互作用的基因集富集分析;g. 训练队列中pCR与非pCR患者预测评分的箱线图;h. 训练队列中预测模型的受试者工作特征曲线(ROC);i. 验证队列中pCR与非pCR患者预测评分的箱线图;j. 训练队列中预测模型的ROC曲线。
TME的动态变化
通过对比治疗前后的基因表达变化,发现pCR组在治疗后基因表达变化显著,且在治疗早期(C1)就激活了免疫相关通路,而非pCR组则在治疗后期才表现出类似变化。研究还发现Ki-67表达可预测疗效,一周期治疗后Ki-67表达减少超过30%或与更高的pCR率相关,95%的患者达到了pCR,这一比例显著高于Ki-67减少不足30%的患者(53.33%)。此外,通过聚类分析和GO/KEGG富集分析,发现pCR组在治疗后显示出T细胞激活、淋巴细胞增殖等免疫功能相关通路。这些结果表明,早期免疫激活与治疗疗效密切相关,提示早期治疗监测能及时对治疗方案适应性调整。
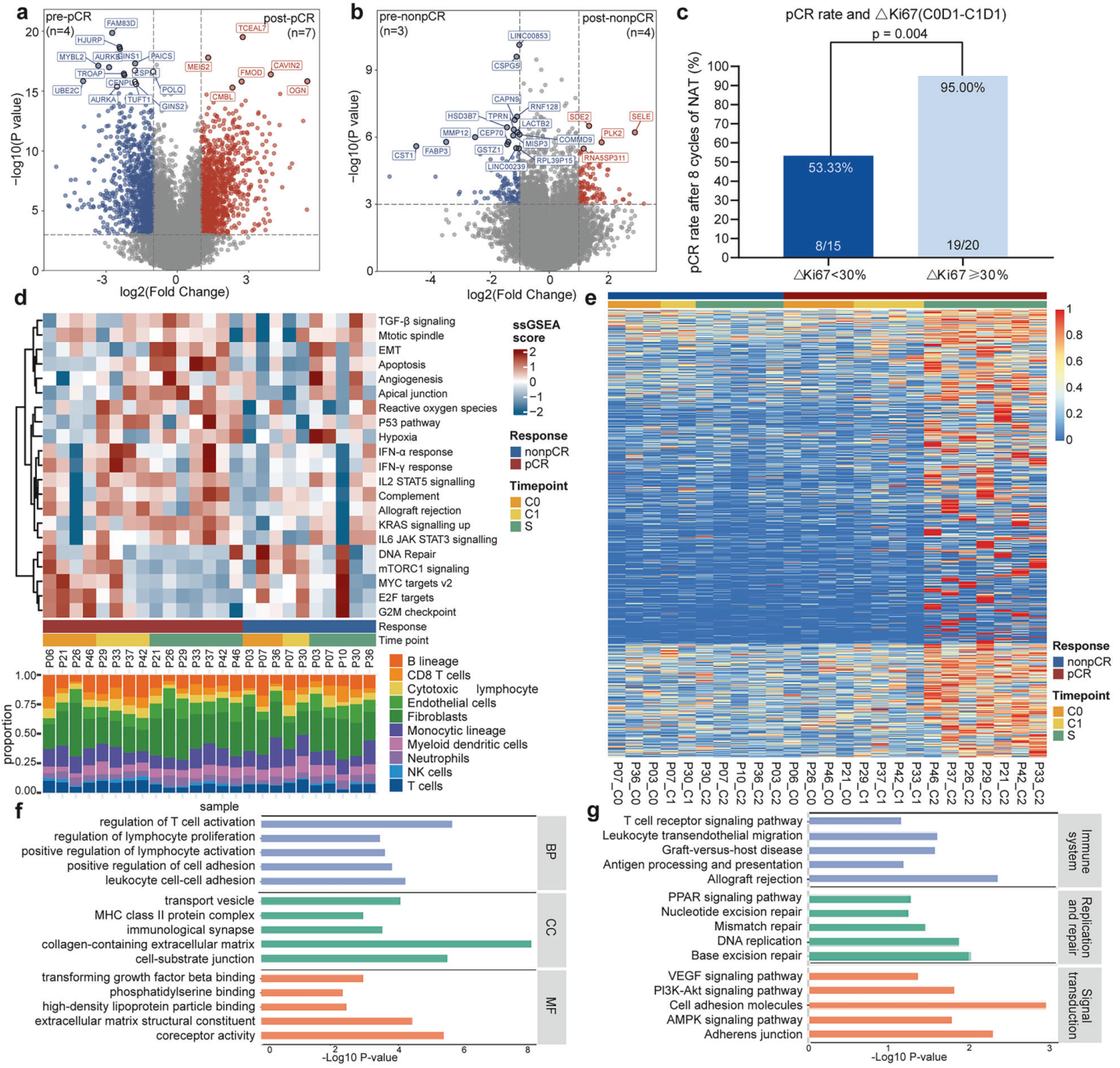
pCR和非pCR患者CD8 T淋巴细胞的转录和克隆多样性
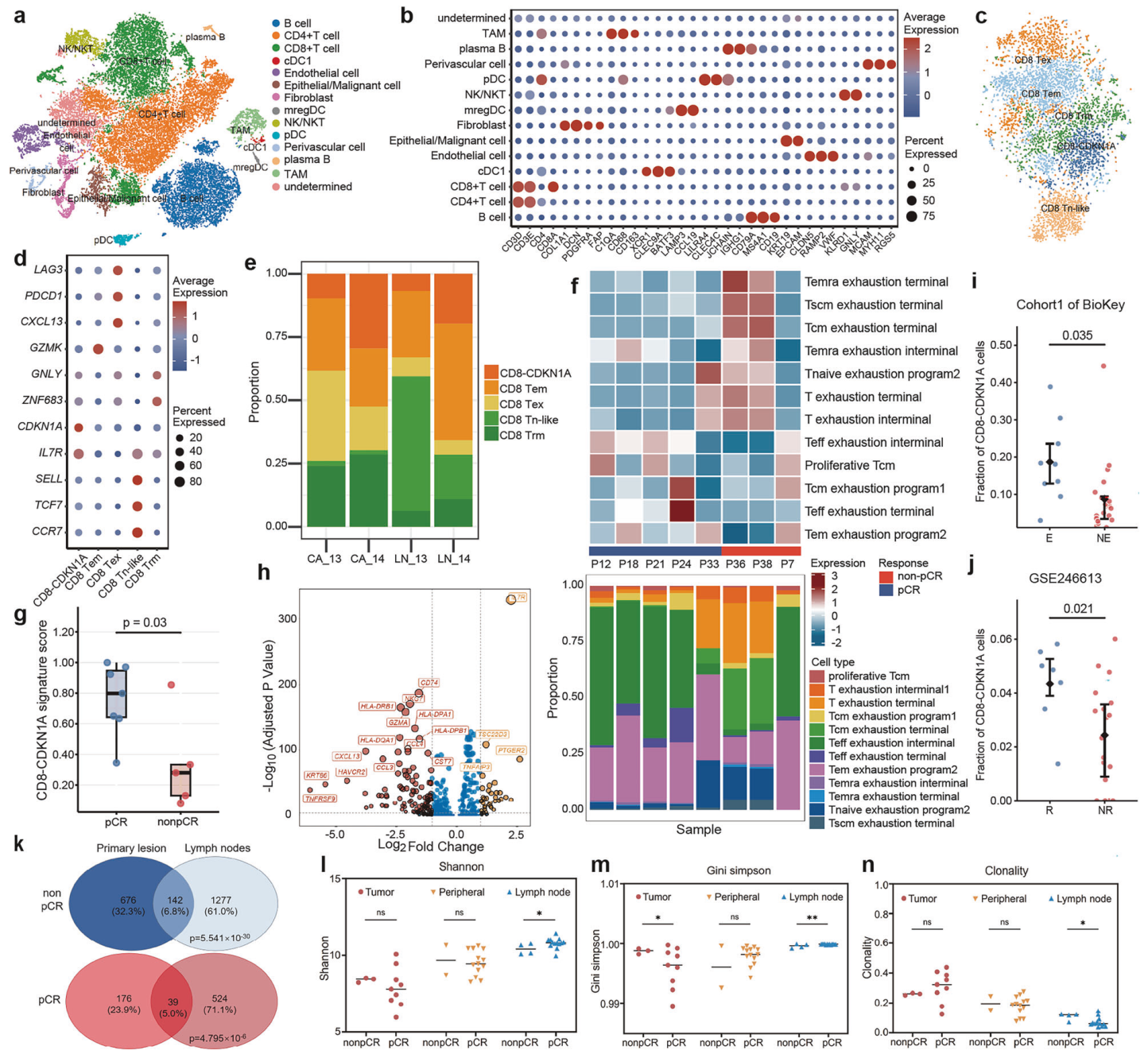
研究发现,CD8 T 淋巴细胞的浸润水平被认为是ICI治疗效果的关键决定因素。非pCR患者中CD8 T淋巴细胞的富集程度更高;高表达CDKN1A的CD8 T淋巴细胞(CDKN1A+ CD8 T淋巴细胞)在pCR患者的原发病灶和淋巴结中富集。为了验证表达CDKN1A+的细胞在 ICI治疗缓解中的意义,研究者构建了CDKN1A+ CD8 T淋巴细胞评分的治疗指数,并分析了该评分与新辅助免疫治疗反应的关系。结果显示,pCR组中CDKN1A+ CD8 T淋巴细胞的富集,表明新辅助替雷利珠单抗可能通过升高的 CDKN1A+ CD8 T 淋巴细胞增加来增强免疫反应。
此外,研究评估了转移性淋巴结和原发肿瘤中CD8 T淋巴细胞的克隆关系差异。分析发现在非pCR和pCR患者的原发肿瘤与转移性淋巴结的CD8 T淋巴细胞中,均存在相似的共享克隆,然而在pCR患者中,淋巴结中TCR多样性增加且克隆性降低。原发肿瘤和外周血样本中则无显著差异。上述观察表明,淋巴结中TCR多样性的增强可能促进对ICI的应答,这使得在新辅助治疗期间及治疗后实现疾病控制成为可能。
研究结论
综上所述,新辅助替雷利珠单抗联合无铂低剂量化疗方案在早期TNBC患者中展现出优异的pCR率,且TRAEs发生率低,安全性特征可控。探索性分析显示,pCR患者在治疗早期即出现免疫应答激活,而新辅助治疗后富集的 CDKN1A+ CD8 T 淋巴细胞可能是介导治疗获益的关键免疫细胞亚群。这些发现为TNBC新辅助免疫治疗提供了重要的临床证据与机制线索。
研究者说
TREND研究首次在TNBC新辅助治疗领域证实,无铂低剂量化疗方案(白蛋白紫杉醇从125mg/m²降至100mg/m²;表柔比星从90mg/m²降至75mg/m²)与替雷利珠单抗的协同组合,可实现68.18%的pCR率,与含铂方案疗效相当,同时将≥3级血液学毒性显著降低至11.32%。
替雷利珠单抗作为我国自主研发的人源化IgG4抗PD-1单克隆抗体,对PD-1具有高度的亲和力和特异性,可更持久阻断免疫抑制信号,同时其药物结构通过 Fc 段基因工程改造,可消除抗体依赖的细胞介导吞噬作用(ADCP),避免了T细胞耗竭这一关键耐药机制,为临床持久应答奠定了基础。因此该方案既保留了蒽环类药物诱导肿瘤免疫原性死亡的能力,通过表柔比星激活树突细胞抗原呈递,为替雷利珠单抗发挥作用创造免疫敏感微环境;同时有利于规避铂类药物对骨髓微环境的破坏,维持T细胞免疫功能。此外在研究人群的组织学特征方面,研究中83%的患者具有较低的肿瘤负荷(T1/T2期),可能通过患者较为完整的免疫微环境放大了免疫治疗获益,这为早期TNBC患者选择中等强度化疗联合免疫治疗提供了关键循证依据。
在免疫治疗反应预测方面,研究通过多组学分析构建了动态疗效预测体系。替雷利珠单抗新辅助治疗前,pCR组已呈现TNF信号通路、T细胞受体通路等免疫通路的显著富集,而脂质代谢基因(如FABP3、ACOX2)高表达则预示耐药风险,提示干预脂代谢通路可能是克服原发性耐药的新方向。同时,我们发现第一周期治疗后Ki-67下降≥30%的患者pCR率高达95%,且免疫通路激活早于病理应答,这一发现为临床建立“治疗中监测”体系提供了依据,有望实现治疗方案的实时优化。
同时,研究发现CDKN1A+ CD8 T 淋巴细胞与治疗反应显著相关。该细胞亚群在pCR组特异性扩增,其独特的"低耗竭(TOX/TIGIT表达下调)、高记忆性(IL7R/GPR183高表达)"特征,使其成为抗肿瘤免疫的持久效应细胞。这一发现具有重要意义,未来CDKN1A+ T细胞或可作为PD-L1的补充预测标志物,精准筛选免疫治疗获益人群,对CDKN1A低表达患者,或可通过CDK4/6抑制剂联合免疫治疗逆转耐药。此外,目前常用的免疫治疗反应评估标准仍聚焦于原发灶的变化,仅报告tpCR和bpCR。我们的分析发现肿瘤引流淋巴结(tdLNs)中 TCR 多样性的增强与pCR显著相关,提示未来疗效评估需纳入淋巴结微环境分析,为腋窝淋巴结处理策略提供了新的理论基础。
总之,TREND研究的结果表明,对于TNBC术前患者,替雷利珠单抗全程联合不含铂类低剂量化疗方案的临床效果和耐受性良好,TRAEs发生率低,且早期免疫相关通路的动态变化有望作为术前免疫治疗效果的预测指标。此外,随着新型靶点药物(如 TROP2 靶向药物)不断涌现,其与免疫治疗的联合应用正成为新的治疗趋势,这将进一步推动 TNBC 新辅助治疗向“机制驱动的精准化”方向发展,相信未来能为 TNBC 患者带来更多获益。
1. Zhang Q et al. Signal Transduct Target Ther. 2025;10:169. doi:10.1038/s41392-025-02254-3
2. Xu, J. et al. Lancet Oncol.24, 483–495 (2023)
3. Yang, Y. et al. Cancer Cell.41, 1061–1072.e4 (2023).
排版编辑:肿瘤资讯-高惠











 苏公网安备32059002004080号
苏公网安备32059002004080号


