2025年6月12日~6月15日,第30届欧洲血液学会(EHA)年会将在“艺术之都”意大利米兰隆重举行。此次大会聚集了众多血液病学领域的顶尖专家与学者,旨在共同探讨血液系统疾病的前沿进展和临床实践成果。2025年5月14日15时30分(当地时间),大会提前公布了近4000项研究的最新成果,涵盖了从基础研究到临床应用的多个层面。摘要一经公布,【肿瘤资讯】第一时间邀请到浙江大学医学院附属第一医院佟红艳教授,就骨髓增生异常综合征(MDS)基础研究进展进行了筛选与点评,内容如下。
博士,主任医师,博士生导师
浙江大学医学院附属第一医院血液科主任
兼骨髓增生异常综合征中心主任、淋巴瘤中心主任
中国病理生理学会实验血液学专委会常务委员
中国抗癌协会中西整合白血病专委会副主任委员
中国抗癌协会血液肿瘤整合康复专业委员会副主任委员
中国抗癌协会血液肿瘤专业委员会MDS/MPN工作组副组长
中国老年医学会血液分会常委兼MDS工作委员会副主任委员
中华医学会医学伦理分会常务委员
中华医学会血液学分会红细胞学组委员
中国女医师协会临床肿瘤血液淋巴专业委员会MDS/MPN学组组长
主持国家自然科学基金面上项目5项,省部级重点项目、领雁计划、省杰青项目等8项;以第一或通讯作者发表在J Clin Invest, JHO, Leukemia, Sci Adv, AJH, Haematologica, EJC等SCI期刊80余篇;以第一完成人获省科技进步二等奖2项,主参国家科技进步二等奖1项、省科技进步一、二等奖6项。

MDS 中炎症和免疫逃逸之间的相互作用与 P53 功能障碍的演变:来自单细胞多组学的见解
标题:THE INTERPLAY BETWEEN INFLAMMATION AND IMMUNE ESCAPE IN MDS WITH P53 DYSFUNCTION EVOLUTION: INSIGHTS FROM SINGLE-CELL MULTI-OMICS
摘要号:S171
类型:Oral
研究背景
伴双等位基因TP53突变的MDS患者生存期缩短且白血病转化风险高。基于2500例MDS队列,该研究近期发现一种非突变性p53功能失调(定义为IHC蛋白高表达)患者具有同样不良预后。Bulk RNA-seq(n=383)和高维流式细胞术(n=77)揭示了免疫抑制性微环境可能驱动这一预后。研究还对15例配对的MDS患者和转白患者骨髓样本进行单细胞多组学纵向分析,发现其中5例存在p53功能失调(双等位TP53突变或TP53野生型伴p53高表达)。
研究目的
描述MDS中CD34+造血干细胞、祖细胞(HSPC)和免疫细胞的异常,以阐明它们在疾病进展和免疫逃避中的作用。
研究方法
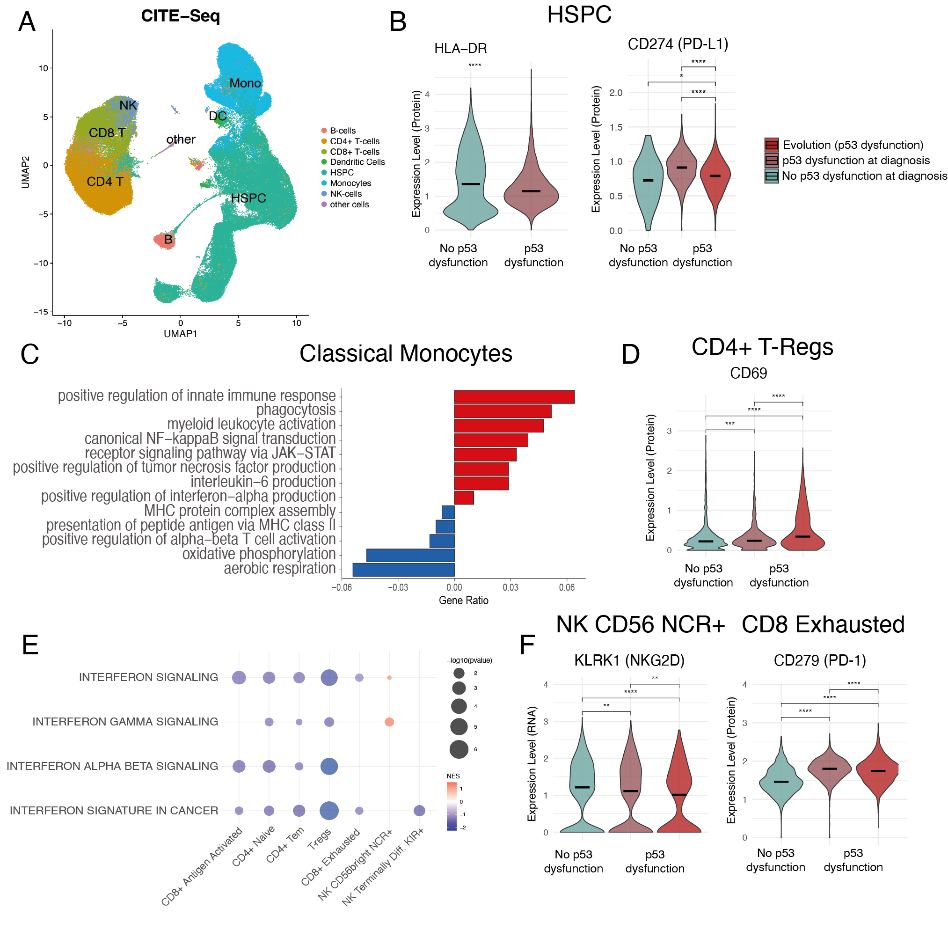
使用143个抗体衍生标签(ADT)对造血干细胞(HSPC)、成熟髓系细胞、CD8+ T细胞、调节性T细胞(Treg)和自然杀伤(NK)细胞进行CITE-seq分析,以评估单细胞水平上的转录和蛋白质表达变化(图1A)。差异表达和通路富集分析发现了关键的分子异常。
研究结果
在伴有p53功能障碍的MDS患者中,CD34+细胞p53靶基因下调,PI3K、RAS、WNT和NF-kB通路激活,提示p53功能障碍并非由基因突变引起。在诊断和病情进展过程中均观察到免疫逃逸机制,包括HLA I-II类蛋白表达降低和免疫逃逸蛋白(CD274/PD-L1、CD35、CD39、CD73、HLA-E)上调(图1B)。
成熟髓系细胞干扰素信号传导和炎症小体相关基因表达增强(NLRP3、CASP1、IL-1β、TLR4),但抗原呈递受损(HLA-DR、CD54、CD11a、T细胞活化标志物)(图1C)。
在p53功能障碍的MDS中,Treg细胞数量更多,CD69、CD39、PD-1和炎症相关基因(S100A9、IRAK2、FOS、S100A8)表达增加,而IFNγ相关基因表达降低,所有T细胞亚群均存在此种情况(图1DE)。
CD8+ T细胞表现出进行性功能障碍,活化受体(CD25、CD40、OX40)减少,耗竭标志物(CD39、KLRG1、PD-1)增多(图 1F)。在进化过程中,耗竭的 CD8+ T 细胞进一步受损,CD28/CD244 下调,检查点分子上调。
NK细胞在诊断期和转化期均存在功能受损,表现为活化受体(NKG2D、NKp30、NKp46、CD244)下调(图1F)及抑制性分子(CD158、PD-1、Siglec-7、KLRG1、TIGIT)增加。
研究结论
本研究揭示了p53功能失调型MDS中存在免疫紊乱的骨髓微环境,其特征为免疫逃逸和T细胞进行性耗竭。与原发性AML不同,p53功能障碍并非通过CD34+祖细胞驱动IFNγ介导的Treg扩增,而是引发独特的髓系驱动的炎症反应。这些异常在白血病转化期持续存在,凸显了炎症与免疫逃逸在疾病进展中的相互作用。靶向免疫功能障碍和炎症通路或可为这一高危MDS亚群提供新型治疗策略。
旁观者CD8 T细胞通过颗粒酶K驱动MDS进展的作用
标题: ROLE OF BYSTANDER CD8 T CELLS PRODUCING GRANZYME K IN MDS PROGRESSION
摘要号:PS1617
类型:Poster
研究背景
最新研究表明,免疫疗法可能为MDS的治疗提供新选择。
研究目的
本研究旨在探究MDS中是否存在可靶向的特异性T细胞应答。为此,采用前沿技术对配对样本外周血和骨髓中的CD8+ T细胞进行了分析。
研究方法
运用质谱流式(45标志物 panel)、TCR测序(分析克隆结构)及体外实验等技术,对配对外周血和骨髓样本中的CD8+ T细胞进行了深入解析,并通过生物信息学方法(UMAP、FAMD等)进行数据整合分析。
研究结果
鉴定出一群独特的骨髓特异性效应CD8+ T细胞(CD69+、PD-1+),具有独特的转录组和细胞因子特征。TCR测序显示该群体存在克隆性扩增,提示抗原驱动激活。进一步通过MHC-I四聚体技术分析抗原特异性发现,这些细胞主要靶向非肿瘤相关抗原(如EBV和HCMV病毒)。这类旁观者CD8 T细胞可表达颗粒酶K(granzyme K),并将其释放至微环境中影响原始细胞,从而揭示了此类T细胞的功能影响。
研究结论
本研究首次揭示了MDS骨髓中一群独特的克隆扩增且高度活化的CD8+ T细胞,为理解该疾病的免疫微环境提供了新视角。这一发现为后续研究及免疫治疗策略的开发奠定了基础。此外,鉴于颗粒酶K在炎症和衰老(如“炎性衰老”)中的已知作用,其在MDS微环境中的存在可能对疾病进展具有更广泛的潜在影响。
基于NGS分析前处理对血浆miRNA谱变异的影响,挖掘MDS特异性诊断标志物
标题:ANALYSIS OF PREANALYTICAL VARIABILITY ON PLASMA MIRNA EXPRESSION PROFILE BY NEXT GENERATION SEQUENCING TO REVEAL SPECIFIC POTENTIAL DIAGNOSTIC BIOMARKERS OF MYELODYSPLASTIC SYNDROME
摘要号:PS1616
类型:Poster
研究背景
微小RNA(miRNA)可作为MDS等肿瘤疾病的潜在无创循环生物标志物。虽然生物学变异对miRNA表达谱的影响已有充分记载,但关于前处理对变异的影响数据仍十分有限——这两类变异对这些分子的临床应用都至关重要。值得注意的是,对于miRNA分析推荐的乏血小板血浆(PPP),其在不同储存时间和温度组合条件下的稳定性数据目前十分匮乏。
研究目的
本研究旨在:1)采用新一代测序技术(NGS)探究PPP样本中前处理变量对miRNA表达谱的影响;2)通过前处理变异的对比分析,鉴定可作为MDS诊断标志物的潜在循环miRNA。
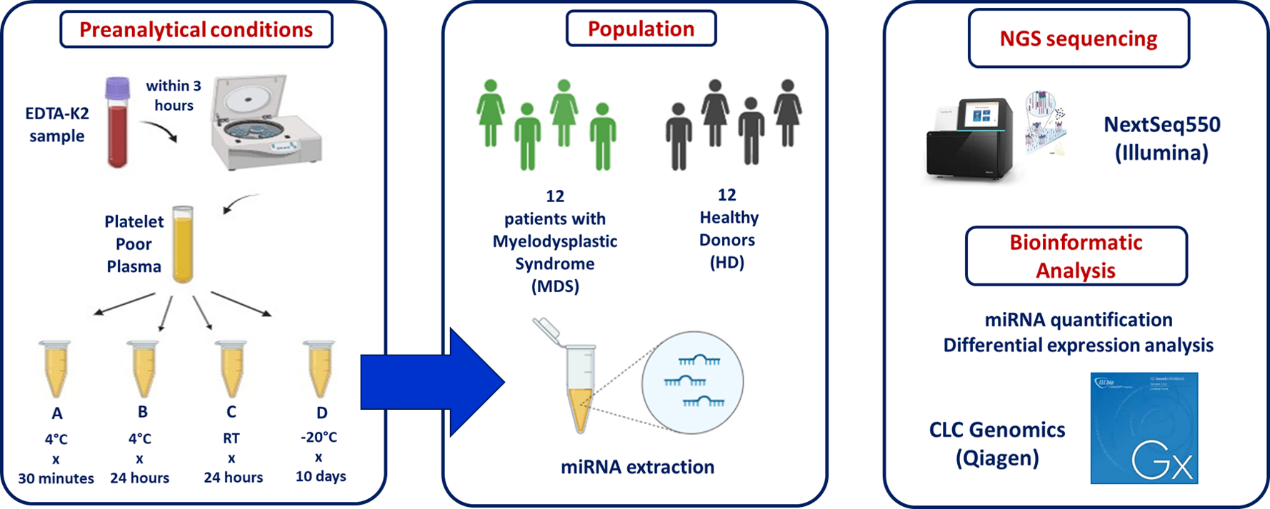
研究方法
采集12例MDS患者和12例性别年龄匹配(平均年龄74±5岁)健康供者(HD)的EDTA K2抗凝血浆样本。3小时内离心获取PPP后分装为四组不同储存条件:A)4℃ 30分钟;B)4℃ 24小时;C)室温(RT)24小时;D)-20℃ 10天。使用QIAseq miRNA文库试剂盒(Qiagen)制备文库,在NextSeq550平台(Illumina)测序,并通过CLC工作台(Qiagen)分析数据。
研究结果
研究发现血浆miRNA表达谱(MEP)受前处理条件显著影响:C组(室温24小时)改变最显著,B组次之,A/D组无显著差异。鉴定出58个在MDS与HD间差异表达的miRNA,其中10个上调miRNA和1个下调miRNA的表达不受前处理条件干扰。受试者工作特征曲线(ROC)分析显示,上调的miR-134-5p区分MDS与HD的效能最佳(特异性和敏感性均>90%)。功能分析表明,该miRNA通过调控PI3K/AKT通路关键转录因子参与MDS发病——该通路在MDS中常呈下调状态。
研究结论
该研究通过NGS技术的无偏倚miRNA表达谱分析,鉴定了MDS的新型潜在诊断标志物,同时证明前处理标准化对实现临床转化研究具有决定性意义。
罗特西普在单细胞水平调控MDS患者造血干细胞转录程序
标题:LUSPATERCEPT MODULATES THE TRANSCRIPTIONAL PROGRAM OF HSPCS OF MDS PATIENTS AT THE SINGLE CELL LEVEL
摘要号:PS1615
类型:Poster
研究背景
罗特西普是一种通过阻断Smad信号通路发挥作用的TGF-β家族抑制剂,是目前治疗低危型骨髓增生异常综合征(LR-MDS)患者贫血最有效的药物。虽然晚期红细胞(Late Ery)被认为是罗特西普的靶细胞,但该药物对其他细胞类型转录组的影响目前尚缺乏研究数据。
研究目的
研究罗特西普治疗后造血干祖细胞(HSPCs)和红系前体细胞的分子特征变化。
研究方法
通过单细胞转录组分析,对5例SF3B1突变阳性LR-MDS患者(其中2例伴TET2突变,1例伴DNMT3A突变,1例伴RUNX1突变)在罗特西普治疗前后分选的骨髓CD34+ HSPCs和红系前体细胞进行分析,评估该药物对造血干祖细胞和红系分化细胞的影响。
研究结果
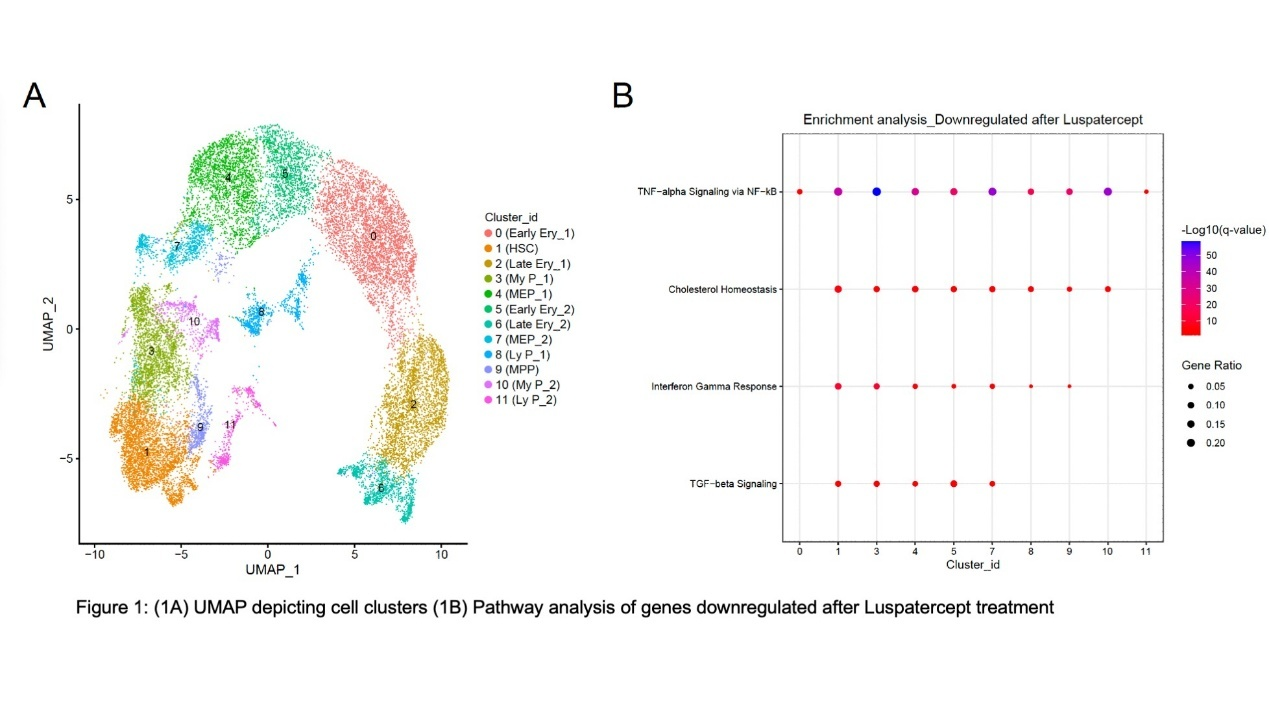
细胞被划分为12个亚群(图3A),基于特征性基因表达谱进行注释。通路富集分析显示,TGF-β信号通路激活主要见于HSPCs和髓系定向祖细胞,而非红系前体细胞(Ery)或巨核-红系祖细胞(MEP),提示罗特西普可能靶向早期造血祖细胞。
治疗后的分子特征分析(图3B)显示:除晚期红系细胞(Late Ery)外,所有亚群均出现TNF-NF-κB和干扰素-γ信号通路相关基因下调。HSPCs、多能祖细胞(MPP)和髓系偏态祖细胞(My P)中与胆固醇稳态(该通路与造血祖细胞增殖和髓系分化倾向相关)相关的基因表达亦下调。值得注意的是,HSCs、髓系祖细胞(My P)和巨核-红系祖细胞(MEP)中TGF-β信号通路相关基因表达降低,但红系前体细胞(Ery)中未见此现象。MEPs和髓系祖细胞(My P)中还观察到G2M细胞周期通路、E2F靶基因等增殖相关信号增强。
研究结论
研究的初步发现表明,罗特西普通过调控炎症、胆固醇代谢、TGF-β信号和细胞增殖相关通路基因的表达,直接作用于HSPCs亚群。这些结果与临床观察到的三系造血改善效应一致,提示TGF-β信号阻断可能在造血过程的不同阶段发挥治疗作用。
骨髓增生异常综合征中红细胞的病理生理异常及其作为潜在诊断与治疗标志物的价值
标题:PATHOPHYSIOLOGICAL ABNORMALITIES OF RED BLOOD CELLS IN MYELODYSPLASTIC SYNDROMES AS POTENTIAL DIAGNOSTIC AND THERAPEUTIC MARKERS
摘要号:PS1614
类型:Poster
研究背景
MDS是一种克隆性造血障碍,以无效造血和向急性髓系白血病(AML)进展的风险为特征。贫血、输血依赖性和高红细胞分布宽度(RDW)与不良临床结局相关。
研究目的
本横断面研究旨在评估未输血低危MDS(LR-MDS)患者(无论是否接受重组促红细胞生成素[rEPO]治疗)的红细胞(RBC)表型,以鉴定疾病的新型外周血标志物,并评估rEPO的影响。
研究方法
LR-MDS患者表现出多种血细胞减少和无效造血标志物,包括有核红细胞(NRBC)计数、RDW、血红蛋白分布宽度(HDW)指数及血浆抗氧化剂水平升高。尽管平均溶血率处于正常范围,但20%的患者高游离血红蛋白(cell-free Hb)水平,这一发现与既往研究结果一致。此外,相当比例患者表现出异常(升高或降低)的渗透性(45%)、机械性(33%)和氧化性(23%)溶血。RBC胞质分析显示Hb氧化增加(高铁/氧合Hb比率:18.3% vs 对照组13.2%),且PPA高于对照组(图4A)。
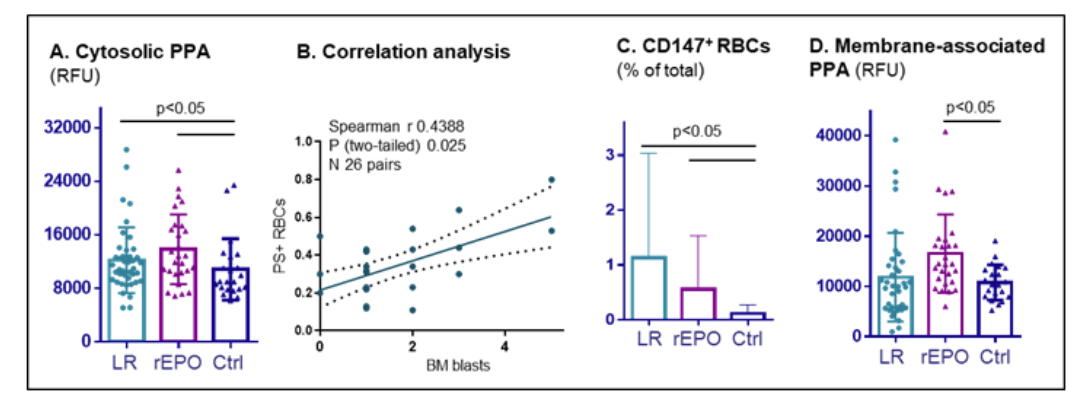
骨髓原始细胞比例与RBC应激标志物(如磷脂酰丝氨酸外翻红细胞比例[PS+ RBCs])呈正相关(图4B)。值得注意的是,循环RBC中表达CD147的比例显著增高(1.13 ± 1.90% vs 对照组0.11 ± 0.16%;60%患者阳性;图4C)。该蛋白在del(5q) MDS红系祖细胞和其他血液恶性肿瘤(如AML)中过表达,与疾病进展和凋亡抵抗相关。在本队列中,CD147表达与无效造血标志物(如网织红细胞、RDW、HDW)、红细胞吞噬作用(IgG膜结合)及RBC氧化缺陷相关。
与未治疗LR-MDS患者相比,rEPO治疗组表现出更高的RDW、HDW、血浆抗氧化剂水平和网织红细胞计数。其RBC呈现氧化和钙应激,表现为膜结合血红素、IgG、补体成分(统计学趋势)及PPA增加(图4D)。CD147表达与未治疗组相当(图4C),但达菲(DARC/Fy)糖蛋白(一种参与炎症调节的趋化因子清除剂)显著降低。在rEPO治疗患者中,PPA与骨髓原始细胞比例、IPSS-R评分和红系病态造血呈正相关,而CD147表达水平与RBC特征(如细胞内钙水平、ICAM4和补体成分表达)相关。
研究结论
MDS相关贫血具有多因素致病机制,需进一步深入研究。骨髓微环境中的关键病理生理因素(如氧化应激和蛋白质损伤调控)可导致基因组不稳定和炎症反应,这些改变在外周血RBC中均有体现。其中,CD147作为一种新兴预后标志物和潜在治疗靶点尤其值得关注。此外,重组促红细胞生成素治疗具有双重生物学及临床效应,包括促进循环RBC的衰老表型。
排版编辑:木子李












 苏公网安备32059002004080号
苏公网安备32059002004080号


