由福建省抗癌协会癌痛专业委员会和福建省抗癌协会中西医整合肿瘤专委会青年委员会主办的【十邑论坛】开播啦!论坛于每周四推出,带您用中文听原汁原味的欧洲肿瘤内科学(ESMO)研究。本期十邑论坛带来Lakshmi Balasubramanian教授分享的转移性胃癌系统治疗的最新进展,强调了以患者为中心的管理和多学科协作的重要性。【肿瘤资讯】特邀三明市第二医院杨兰芳教授进行相关研究解读。
三明市第二医院 肿瘤科 主治医师
癌症控制连续体是一个框架,用于概述癌症的不同阶段,并在转移性胃癌中,强调了个性化治疗、姑息治疗和临终关怀在优化患者结局中的关键作用。跨领域挑战,如了解差异和流行病学,有助于分配资源和制定医疗保健服务及公共卫生战略。
转移性胃癌系统治疗的进展
在转移性胃癌的治疗领域,我们认识到通过整合个性化医疗、姑息治疗以及临终关怀,在优化患者预后方面发挥着至关重要的作用。然而,这一领域也面临着诸多跨学科挑战,例如理解疾病的差异性和流行病学特征,这对于合理分配医疗资源、制定有效的医疗保健服务和公共卫生策略至关重要。
回顾转移性胃癌系统治疗的发展历程,可以清晰地观察到自2010年以来取得的显著进展。在2010年前,我们主要依赖于FOLFOX和卡培他滨等传统的化疗方案。随后,在2010年,曲妥珠单抗获批,而在2014年,雷莫西尤单抗也加入治疗行列。经历了近十年的稳步发展后,自2021年起,该领域的进展明显加速(图1)。
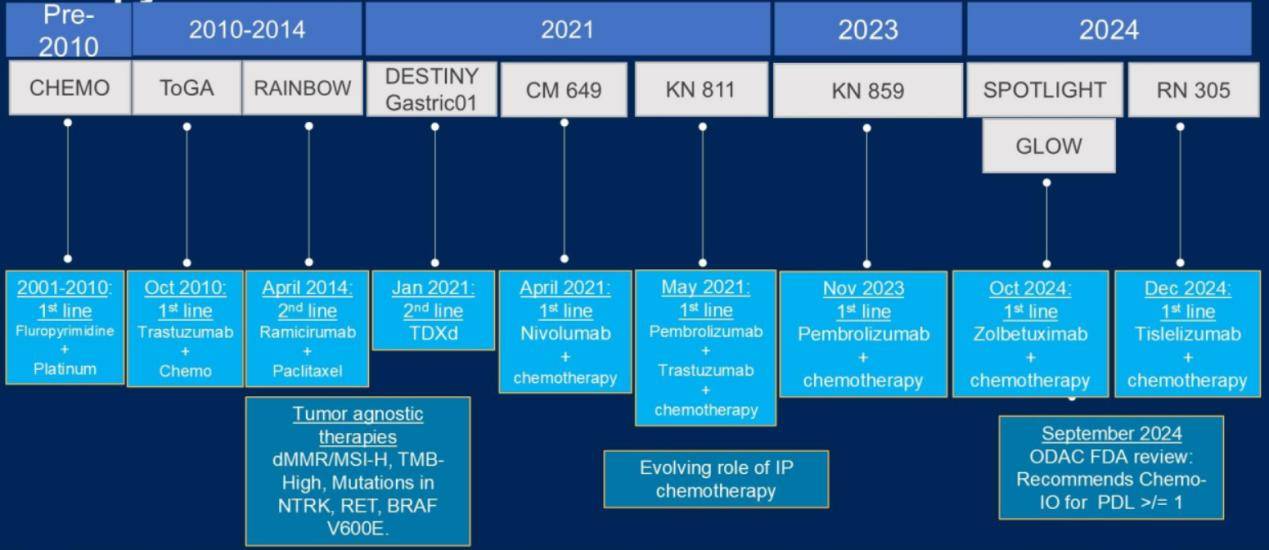
生物标志物检测:精准治疗的基石
在转移性胃癌的治疗领域,生物标志物的检测至关重要,特别是HER2的表达状态。HER2阳性定义为免疫组化结果为3+,或免疫组化结果为2+且荧光原位杂交(FISH)检测呈阳性。基于ToGA试验,曲妥珠单抗联合化疗已获批用于一线治疗HER2阳性转移性胃癌。此外,T-DXd作为一种新型抗体药物偶联物,通过抑制拓扑异构酶I,在HER2阳性胃癌的治疗中展现出显著疗效,其高抗体药物比和旁观者效应使其成为一种潜在的治疗选择。
PD-L1作为另一重要的生物标志物,其检测方法的标准化对于指导免疫治疗至关重要。由于检测方法的多样性,临床实践中曾面临挑战。然而,随着研究数据的不断积累,美国及全球监管机构已逐渐统一标准,推荐使用联合阳性评分(CPS)或肿瘤区域阳性评分(TAP)来评估PD-L1的表达水平。普遍认为,CPS和TAP在评估PD-L1阳性方面具有良好的相关性。目前,多种免疫检查点抑制剂已获批用于PD-L1阳性转移性胃癌的治疗。Claudin 18.2是一种紧密连接蛋白,在胃癌的恶性转化过程中过度表达,成为潜在的治疗靶点。在非脱钙福尔马林固定石蜡包埋组织中,若至少75%的存活肿瘤细胞呈现中至强度的膜染色,则认为Claudin 18.2表达阳性。
因此,在一线治疗前,对HER2、MMR/MSI、PD-L1和Claudin 18.2的检测至关重要。在后续治疗中,建议在疾病进展前重复检测HER2,以确定是否适合二线靶向治疗。若一线治疗未进行二代测序(NGS),则应在后续治疗中考虑进行,以全面评估MMR、MSI、TMB、NTRK、RET、BRAFV600E等相关基因的状态,为患者制定个体化的治疗策略(图2)。

临床案例解析:生物标志物指导下的治疗决策
在转移性胃癌的临床治疗中,个体化治疗方案的制定至关重要。以一位37岁的年轻女性为例,该患者因腹胀、腹痛、早饱和体重减轻等症状就诊,影像学及病理学检查确诊为胃高级别腺癌。该患者HER2免疫组化结果为1+,FISH结果待定,PD-L1 CPS评分为5,Claudin 18.2表达阳性,提示患者对免疫治疗和靶向Claudin 18.2的治疗可能获益。
针对HER2阴性的转移性胃癌,多项临床研究为转移性胃癌的化疗联合免疫治疗提供了有力证据。CHECKMATE 649研究显示,纳武利尤单抗联合化疗显著改善了患者的中位总生存期,尤其在PD-L1 CPS评分大于或等于5的患者中,获益更为显著,同时无进展生存期(PFS)和客观缓解率(ORR)也得到改善。KEYNOTE 859研究进一步证实了帕博利珠单抗联合化疗的疗效,所有患者的中位总生存期均得到改善,且在PD-L1 CPS评分大于或等于10的患者中,总生存期(OS)改善更为明显,PFS和ORR也均得到改善。最近批准的RATIONALE-305研究显示,替雷利珠单抗联合化疗可改善PD-L1 TAP评分大于或等于5的患者以及所有患者的总生存期。然而,PD-L1低表达(小于1)或阴性患者的治疗仍是临床挑战。
2024年9月,FDA肿瘤药物咨询委员会对化疗联合免疫检查点抑制剂的总生存期数据进行了分析,结果显示PD-L1表达小于1的患者始终未能从免疫治疗中获益。因此,FDA建议PD-L1 CPS或TAP评分至少为1或更高时,方可考虑联合应用免疫检查点抑制剂。
临床实践指南对于转移性胃癌的治疗决策至关重要。2024年12月,NCCN指南推荐PD-L1 CPS评分小于5的患者可考虑纳武利尤单抗联合化疗(IIB类推荐),而2022年ASCO指南建议PD-L1 CPS评分为0的患者不联合使用纳武利尤单抗。EMA和欧盟委员会的批准则更为严格,明确要求PD-L1阳性方可使用免疫治疗,并根据PD-L1表达水平推荐不同的药物。
在临床实践中,医生需综合考虑患者的临床特征、生物标志物表达水平和治疗目标,制定个体化的治疗方案。对于PD-L1高表达(大于或等于5)的患者,纳武利尤单抗或替雷利珠单抗联合化疗,以及PD-L1高表达(大于或等于10)的患者,帕博利珠单抗联合化疗,已成为治疗共识。
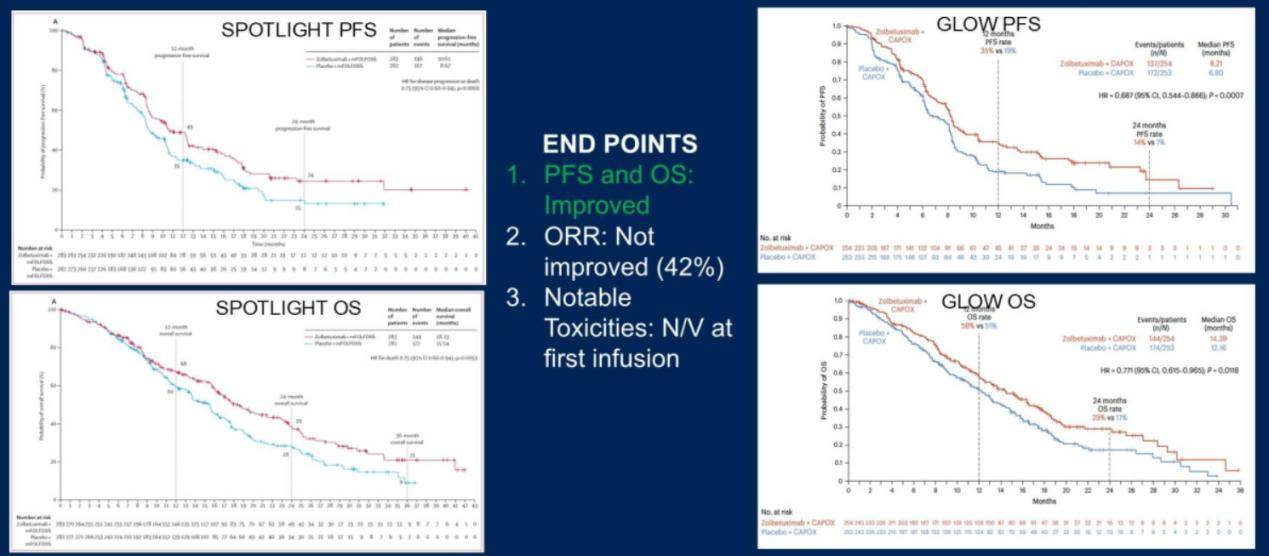
靶向Claudin 18.2:佐妥昔单抗的临床应用与安全性
佐妥昔单抗是一种靶向Claudin 18.2的单克隆抗体,SPOTLIGHT和GLOW研究显示,佐妥昔单抗联合化疗可改善患者的无进展生存期和总生存期,但恶心、呕吐等毒性反应较为显著(图3)。
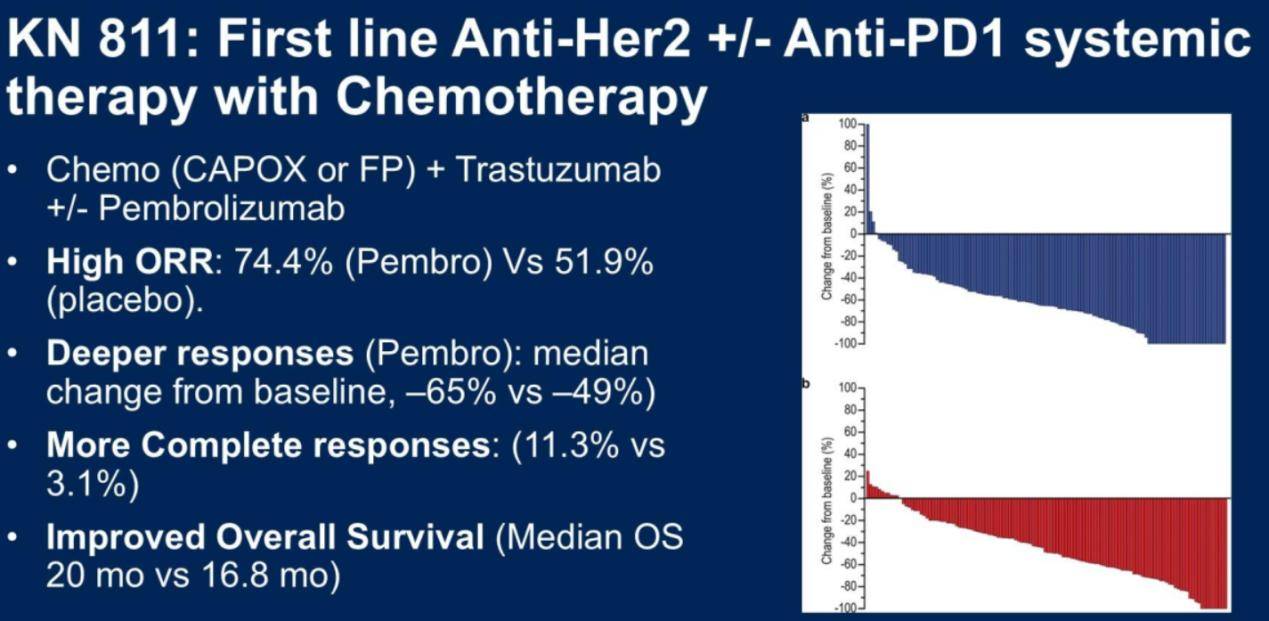
HER2阳性胃癌的免疫联合靶向治疗:Keynote 811研究解读
对于HER2阳性的转移性胃癌,Keynote 811研究显示,帕博利珠单抗联合曲妥珠单抗和化疗可显著提高客观缓解率,尤其在HER2免疫组化2+或3+且FISH阳性的患者中,疗效更为显著(图4)。
二线及特殊类型胃癌的治疗进展
在转移性胃癌的二线治疗中,T-DXd在Destiny Gastric01研究中展现出显著疗效,优于医生选择的治疗方案。该药物具有极高的客观缓解率,与某些胰腺癌治疗方案的效果相当,并能带来更深层次的缓解,延长中位反应持续时间,显著提高患者的总体生存率,包括12个月的生存率。然而,临床应用中需密切关注T-DXd可能引起的间质性肺病,这是一种严重的毒性反应。
腹膜癌,特别是腹膜转移的胃癌,是一个具有挑战性的治疗领域。对于局限性腹膜转移且腹膜癌指数(PCI)较低的患者,细胞减灭术联合腹腔热灌注化疗(HIPEC)是一种潜在的治疗选择。2023年12月更新的NCCN指南强调,对于此类患者,实现腹膜细胞学阴性是治愈性治疗的标准。
腹腔化疗包括常温腹腔化疗、双向化疗、腹腔灌注化疗以及细胞减灭术联合腹腔加压气溶胶化疗(PIPAC)。对于PCI较高的患者(大于10),HIPEC联合腹腔内化疗仍被视为研究性治疗。腹腔化疗可以通过在腹壁内置入输液港(NIPEC)进行,类似静脉输液。这种方式适用于肿瘤负荷较低的特定患者。
综合治疗与患者支持
多学科协作在转移性胃癌,尤其是腹膜转移胃癌的治疗中扮演着至关重要的角色。对于计划接受细胞减灭术的患者,术前需进行充分的评估和准备,确保患者是合适的候选人。通常情况下,患者应在术前接受至少三个月的全身治疗,以控制全身疾病进展。细胞减灭术可以联合或不联合HIPEC进行。对于腹膜癌指数(DPCI)小于或等于10的患者,建议考虑此治疗方案,但并非必须在临床试验中进行。
辅助护理协调在转移性胃癌的治疗中同样不可或缺。医护人员应努力缩小患者获得护理与临床实践变化之间的差距。生物标志物检测是指导个体化治疗的关键,多学科协作则能更好地整合新兴技术和治疗策略,为患者提供全面的诊疗服务。
大家可以自行下载对应幻灯,再配合本音频听,效果更好。
排版编辑:xiaodong











 苏公网安备32059002004080号
苏公网安备32059002004080号


