表皮生长因子受体(EGFR)突变是非鳞状非小细胞肺癌(NSCLC)常见的突变类型之一,近年来,随着肺癌精准诊疗的快速发展,EGFR-TKI已成为EGFR敏感突变晚期NSCLC的一线标准治疗,三代EGFR-TKI由于疗效和安全性的优势,已成为临床治疗的首选,但耐药情况仍无法避免。第三代EGFR-TKI耐药后如何改善EGFR突变晚期NSCLC患者的生存及生活质量是当前的关注问题。
概述
非小细胞肺癌(NSCLC)是最常见的肺癌病理类型,约占85%,主要包括腺癌、鳞状细胞和大细胞癌[1]。表皮生长因子受体(EGFR)基因突变是观察到的最常见驱动突变。在中国NSCLC人群中,EGFR突变比例为28.2%[2],在肺腺癌中,该比例可达50.2%[3]。EGFR-TKI的引入改变了晚期EGFR突变NSCLC患者的治疗模式。基于关键3期试验的阳性数据[4-8],第三代EGFR-TKIs已被批准用于EGFR敏感突变的NSCLC患者的一线治疗。然而第三代EGFR-TKI治疗后的疾病进展仍然不可避免,管理耐药仍然是一个挑战,因此三代EGFR-TKI耐药的机制及其临床应对策略是目前靶向治疗研究领域的热点之一。
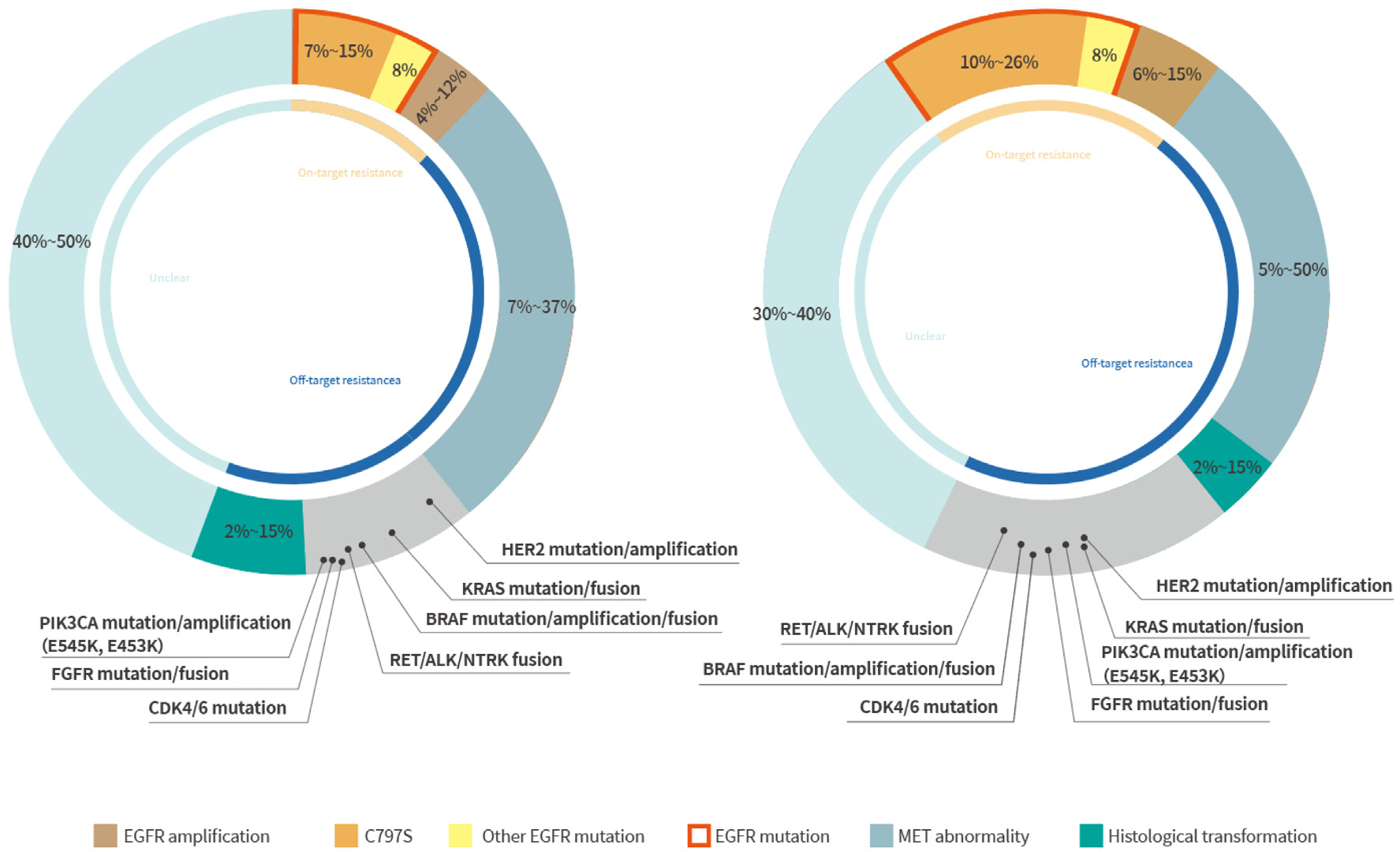
三代EGFR-TKI的耐药机制复杂,包括EGFR依赖性耐药、非EGFR依赖性耐药以及未知耐药,其中EGFR C797S突变和MET异常分别是EGFR依赖性耐药和非EGFR依赖性耐药中占比较高的耐药机制,其中一线耐药后EGFR C797S突变占7-15%,MET异常占7-37%[1]。
双抗联合化疗治疗
对于三代EGFR-TKI一线治疗后广泛进展患者,当前指南推荐铂类为基础的双药化疗方案,中位PFS约为5个月[1],存在较高的临床未满足需求,目前尚无针对三代TKI耐药后的靶向治疗方案。
埃万妥单抗联合含铂双药化疗(ACP方案)在2024年8月被FDA批准用于EGFR敏感突变NSCLC的二线治疗。NCCN指南已推荐ACP方案作为EGFR敏感突变奥希替尼治疗进展后的唯一首选方案(1类证据);2024 CSCO指南更新了Ⅳ期EGFR敏感突变NSCLC后线治疗部分,文字描述增加了ACP方案。埃万妥单抗是一种胞外靶向EGFR和MET的双特异性抗体,通过EGFR依赖性耐药和非EGFR依赖性耐药双重机制克服奥希替尼耐药,触发免疫细胞趋化活性和受体降解;化疗介导的肿瘤细胞死亡可能会增强免疫细胞介导活性。ACP方案是首个针对三代TKI耐药的靶向治疗方案,其被FDA获批及被指南推荐均基于III期MARIPOSA-2研究的结果。
MARIPOSA-2研究结果显示[9],ACP方案治疗奥希替尼单药治疗期间或之后进展的EGFR敏感突变NSCLC的中位PFS为6.3个月,降低疾病进展和死亡风险52%;颅内中位PFS长达12.5个月,降低颅内进展和死亡风险45%;亚洲人群获益更显著,研究者评估的中位PFS为10.3个月,降低疾病进展和死亡风险61%;ORR为化疗组2倍左右(64% vs 36%);随访时间从8.7个月延长到18.1个月[10],ACP方案OS获益明显,HR值由0.77降为0.73,ACP方案相较化疗组的18个月OS率分别为50%和40%;ACP方案安全性可控,输液反应(IRR)、静脉血栓栓塞症、皮疹可以通过预防性给药进行管理,另外埃万妥单抗皮下注射剂在申报上市中,PALOMA-2和PALOMA-3研究数据显示,埃万妥单抗皮下注射剂可显著提高给药便利性并显著的发降低IRR发生[11, 12]。
HARMONi-A研究是一项随机、双盲、多中心的III期研究[13],旨在评估依沃西单抗(PD-1/VEGF双特异性抗体药物)联合化疗对比化疗在EGFR-TKI 经治失败EGFR突变转移性NSCLC患者的疗效和安全性。结果显示,依沃西单抗联合化疗可显著改善患者中位PFS(7.1个月vs.4.8个月,HR=0.46),且各亚组PFS全面获益,OS有获益趋势但未达到统计学差异。
免疫联合化疗和抗血管治疗
IMpower151是一项治疗非鳞NSCLC(含50%的EGFR/ALK突变人群)的Ⅲ期研究[14],旨在评估阿替利珠单抗(A)联合贝伐珠单抗(B)及卡铂(C)和紫杉醇(P)方案对比BCP方案的疗效与安全性,其结果显示ABCP组和BCP组的中位PFS分别为9.5个月和7.1个月,未达到统计学显著性;未产生临床意义上的OS改善。在EGFR/ALK+亚组中,在BCP方案基础上添加阿替利珠单抗对PFS没有增益(8.5 vs. 8.3个月;HR=0.86)。
ORIENT-31研究是一项前瞻性、双盲、多中心III期研究[15],旨在探索信迪利单抗联合化疗和抗血管生成药物在EGFR-TKI治疗失败的EGFR突变的晚期NSCLC患者的疗效和安全性。该研究纳入了第一、二代EGFR-TKIs一线治疗耐药且EGFR T790M阴性或接受奥希替尼治疗耐药的晚期非鳞状NSCLC患者。结果显示信迪利单抗+抗血管生成药物+化疗相较化疗的中位PFS有统计学意义的改善 (7.2 vs 4.3个月),但中位OS无显著差异;信迪利单抗+抗血管生成药物+化疗组≥3级TRAE发生率为56%,最常见AE为血液学毒性,需关注免疫相关AE。
对EGFR-TKI治疗后疾病进展的晚期EGFR突变NSCLC接受ICI为基础的不同治疗模式进行荟萃分析[16],共纳入17项单臂临床研究和15项随机对照研究(N=2886),结果显示免疫检查点抑制剂(ICI)+抗血管+化疗较ICI+化疗 (HR=0.71, 0.59-0.85) 和ICI单药 (HR=0.30, 0.22-0.41) 均展现出更优的PFS;不同ICI治疗模式的OS无显著差异;安全性结果显示,相较其他ICI治疗模式,ICI+抗血管+化疗的任何级别AEs和严重AEs的发生率更高,需特别关注。
对于靶向治疗耐药后的EGFR突变NSCLC患者,相较其他ICI治疗策略,免疫联合化疗和抗血管治疗可作为优化的治疗选择;但相应毒性的增加和管理也需要在临床实践中关注。
抗体偶联药物(ADC)治疗
Datopotamab deruxtecan(Dato-DXd)是一种靶向trop2的ADC,TROPION-Lung01研究是一项全球、多中心、III期注册临床研究,评估了Dato-DXd对比多西他赛在经治、有或无靶向基因突变(AGA)的局部晚期/转移性NSCLC患者中的疗效和安全性,研究设置了双主要终点——BICR评估的PFS和OS。结果显示[17],Dato-DXd vs 多西他赛的中位PFS为4.4个月 vs 3.7个月(P=0.004),达到了主要终点;但OS的最终分析显示,中位OS未达到统计学差异,Dato-DXd vs 多西他赛的中位OS为12.9个月 vs 11.8个月(P=0.530)。
EVOKE-01研究是一项比较戈沙妥珠单抗对比多西他赛治疗含铂化疗和抗PD-(L)1治疗期间或之后发生进展的晚期/转移性NSCLC的开放性、全球、多中心、随机III期研究,主要终点为OS。结果显示[18],中位OS未达到统计学差异,戈沙妥珠单抗 vs 多西他赛的中位OS为11.1个月 vs 9.8个月(P=0.0534)。亚组分析结果显示,在既往抗PD-(L)1治疗无反应(SD/PD)的患者中,戈沙妥珠单抗的中位OS延长了3.5个月(11.8个月 vs 8.3个月),OS数值上有改善;戈沙妥珠单抗 vs 多西他赛的中位PFS为4.2个月 vs 3.7个月(P=0.0534)。
Patritumab deruxtecan(HER3-DXd)是采用DXd-ADC技术开发的靶向HER3的ADC。HERTHENA-Lung01是一项开放标签、关键II期研究,评价了HER3-DXd在既往接受过EGFR-TKI和含铂化疗的EGFR突变NSCLC病例中的疗效和安全性,结果显示[19]三代EGFR-TKI治疗后ORR为29.2%,中位PFS为5.5个月,中位OS为11.9个月。一项III期、全球多中心、随机对照试验HERTHENA-Lung02正在进行中[20],评估HER3-DXd与含铂化疗在EGFR-TKI耐药病例中的疗效和安全性。
总结
第三代EGFR-TKI是目前EGFR突变晚期NSCLC患者标准一线优选,其一线治疗进展后耐药机制复杂,及时明确耐药机制有助于后续临床决策的制定和新型策略的开发,期待未来更多策略助力第三代EGFR-TKI耐药后的治疗和探索,以进一步延长EGFR突变晚期NSCLC患者生存。随着未来更多的新药和新疗法问世,将为患者带来更多新的希望,也为临床实践提供重要的指导。
[1] Qing Zhou, Hongyun Zhao, Shun Lu, et al. Consensus on the lung cancer management after third-generation EGFR-TKI resistance. Lancet Reg Health West Pac, 2025, 53: 0.
[2] Gou LY, Wu YL. Prevalence of driver mutations in non-small-cell lung cancers in the People’s Republic of China. Lung Cancer (Auckl), 2014, 12: 1-9. doi:10.2147/LCTT.S40817.
[3] Shi Y, Li J, Zhang S, et al. Molecular epidemiology of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology - Mainland China subset analysis of the PIONEER study. PLoS One, 2015, 10: e0143515. doi: 10.1371/journal.pone.0143515.
[4] Lu S, Dong X, Jian H, et al. AENEAS: a randomized phase III trial of aumolertinib versus gefitinib as first-line therapy for locally advanced or MetastaticNon-small-cell lung cancer with EGFR exon 19 deletion or L858R mutations. J Clin Oncol. 2022;40(27):3162–3171.
[5] Shi Y, Chen G, Wang X, et al. Furmonertinib (AST2818) versus gefitinib as first-line therapy for Chinese patients with locally advanced or metastatic EGFR mutation-positive non-small-cell lung cancer (FURLONG): a multicentre, double-blind, randomized phase 3 study. Lancet Respir Med. 2022;10(11):1019–1028.
[6] Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018;378(2):113–125.
[7] Lu S, Zhou J, Jian H, et al. Befotertinib (D-0316) versus icotinib as first-line therapy for patients with EGFR-mutated locally advanced or metastatic non-small-cell lung cancer: a multicentre, open-label, randomised phase 3 study. Lancet Respir Med. 2023;11(10):905–915.
[8] Cho BC, Ahn MJ, Kang JH, et al. Lazertinib versus gefitinib as firstline treatment in patients with EGFR-mutated advanced non-small cell lung cancer: results from LASER301. J Clin Oncol.
2023;41(26):4208–4217
[9] Passaro A, et al. Ann Oncol. 2024;35(1):77-90. Jin-Yuan Shih, et al. ESMO Asia. 2023. LBA11.
[10] Passaro A, et al. Ann Oncol. 2024;35(1):77-90. Sanjay Popat, et al. ESMO 2024. LBA54.
[11] Sun Min Lim et al..2024 ASCO LBA 8612.
[12] Natasha B. Leighl, et al. 2024 ASCO. Oral LBA8505.
[13] Li Zhang, et al. ASCO 2024. Abstract 8508.
[14] C. Zhou, et al. WCLC 2023. OA09.06.
[15] Lu S, Wu L, Jian H, et al. Sintilimab plus chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer with disease progression after EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): second interim analysis from a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Respir Med. 2023;11(7):624–636.
[16] Zhao Y, et al. Lancet Oncol. 2024 Aug 16:S1470-2045(24)00379-6.
[17] Jacob Sands, et al. ESMO 2024. OA08.03.
[18] Marina Chiara Garassino, et al. WCLC 2024. OA08.06.
[19] Yu HA, Goto Y, Hayashi H, et al. HERTHENA-Lung01, a phase II trial of patritumab deruxtecan (HER3-DXd) in epidermal growth factor receptor-mutated non-small-cell lung cancer after epidermal growth factor receptor tyrosine kinase inhibitor therapy and platinum-based chemotherapy. J Clin Oncol. 2023;41(35):5363–5375.
[20] Mok T, Wu Y, Nishio M, et al. 1195TiP HERTHENA-Lung02: a randomized phase III study of patritumab deruxtecan vs platinumbased chemotherapy in locally advanced or metastatic EGFRmutated NSCLC after progression with a third-generation EGFR TKI. Ann Oncol. 2022;33:S1095.
CRC Code: EM-177250
Approved Date: 2025.2.27
排版编辑:肿瘤资讯-TJ
✅ “本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。强生创新制药不支持、不鼓励任何未被批准的药品/适应症使用。”
✅ “本资料中涉及的AE/SS/PQC已按照公司的要求上报。”(适用于含AE/SS/PQC的资料)











 苏公网安备32059002004080号
苏公网安备32059002004080号


