2025年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)于1月23~25日在美国旧金山顺利召开,各国学者在这项医学盛会上分享消化道肿瘤领域新成果,共话前沿进展及其影响。值此良机,特邀解放军总医院戴广海教授分享胰腺癌与胆道恶性肿瘤领域重磅报道内容,与同道重温学术热点。
专家简介
肿瘤学博士,主任医师,教授
解放军医学院、南开大学博士研究生导师
解放军总医院肿瘤医学部肿瘤内科 主任
第六届中央保健委员会会诊专家
第三届中央军委保健委员会会诊专家
2020年第四届国之名医-卓越建树称号获得者
中国研究型医院学会精准医学与肿瘤MDT专业委员会主任委员
中国医师协会结直肠肿瘤专委会MDT专业委员会主任委员
中华医学会肿瘤学分会结直肠肿瘤学组副主任委员
CSCO理事,胆系肿瘤专委会、胰腺癌专家委员会副主任委员
智慧医学专委会常委;胃癌、大肠癌专委会委员
胰腺癌
化疗:一线治疗方案优化
Overall survival (OS) of patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with first-line (1L) FOLFIRINOX (FFX): Bridging the gap between the NAPOLI 3 trial and real-world practice.
NAPOLI-3研究与真实世界对比:NAPOLI-3 Ⅲ期研究结果证实,与吉西他滨+白蛋白紫杉醇(gem/NabP)相比,NALIRIFOX方案(伊立替康脂质体 + 5-氟尿嘧啶/亚叶酸[5-FU/LV] + 奥沙利铂)一线治疗mPDAC患者可显著提高患者生存期(11.1个月 vs 9.2个月,HR=0.83,p=0.04),但NALIRIFOX对比FOLFIRINOX(FFX)的疗效差别尚不清楚。
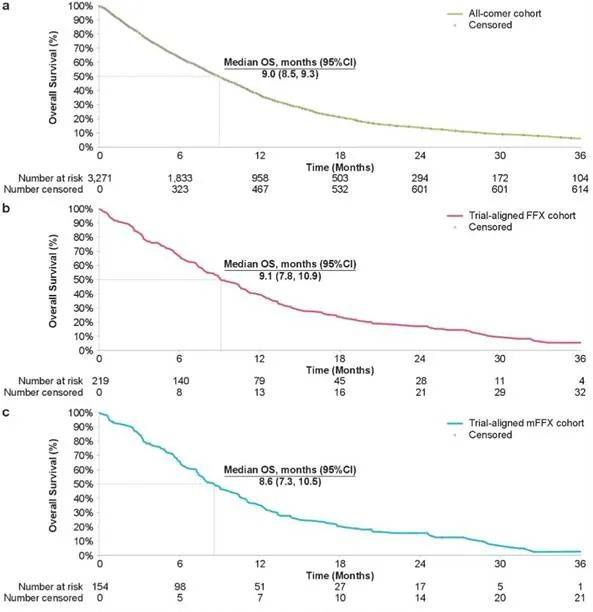
一项回顾性研究纳入了真实世界一线接受FFX方案治疗mPDAC患者,分为三个队列:1)全体患者(n=3271);2)符合NAPOLI 3试验入组标准的患者(n=219);3)队列2中接受改良FOLFIRINOX(mFFX)方案的亚组患者(n=154)。
结果显示,各组患者基线特点相似,FFX治疗下三组中位OS分别为9.0个月、9.1个月和8.6个月。从数值上看,NAPOLI 3研究中NALIRIFOX治疗后OS更优,但还需分析患者基线特征,以正确评估两种方案的相对疗效。
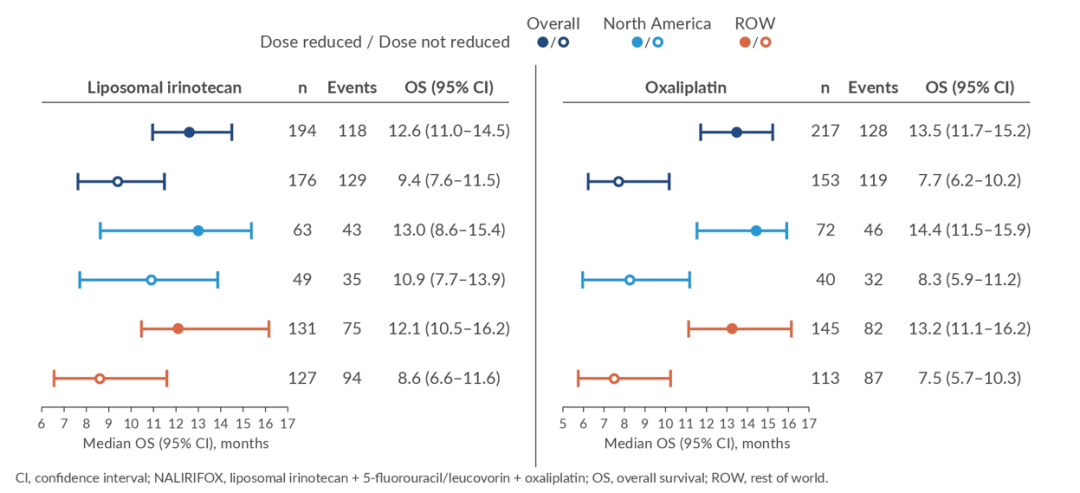
Effect of dose adjustments on overall survival (OS) in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with NALIRIFOX: A post hoc analysis of NAPOLI 3.
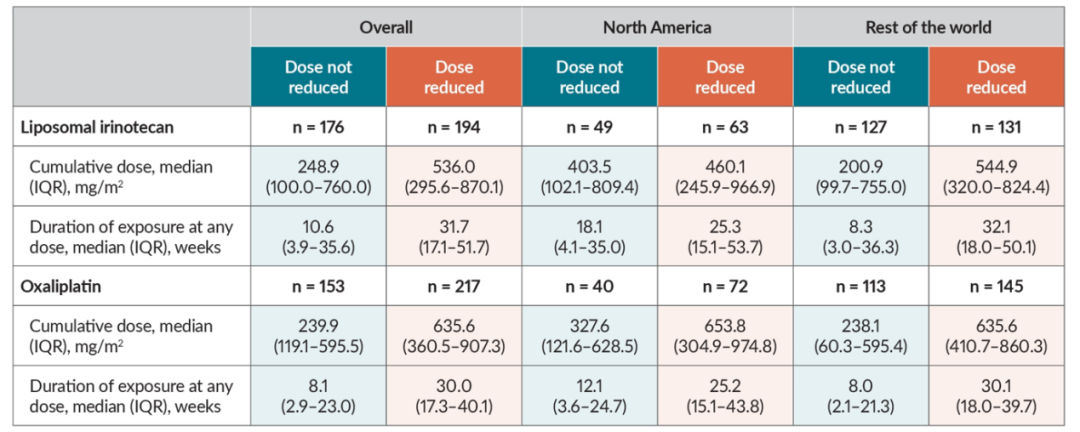
伊立替康脂质体剂量调整对OS的影响:基于NAPOLI 3研究结果,NALIRIFOX方案已被FDA和EMA获批用于mPDAC的一线治疗,但NALIRIFOX剂量调整对OS的影响尚未被充分研究。因此,NAPOLI 3事后分析纳入370例接受NALIRIFOX方案治疗的mPDAC患者,根据患者的耐受性,对伊立替康脂质体(n=194)和奥沙利铂(n=217)的剂量进行调整,分析不同剂量水平下的OS。
结果显示,与未减少伊立替康脂质体或奥沙利铂剂量患者相比,减少剂量不影响患者的OS,在北美和世界其他地区接受治疗的患者中也观察到类似的结果。此外,接受减量治疗的患者比未接受减量治疗的患者中位暴露时间更长,累积剂量更高,较长的治疗时间和更高的治疗完成率可能与更长的OS相关。本项事后分析表明,伊立替康脂质体或奥沙利铂的剂量减少不会影响患者的OS,因此,未来有望进一步优化NALIRIFOX治疗方案的制定。
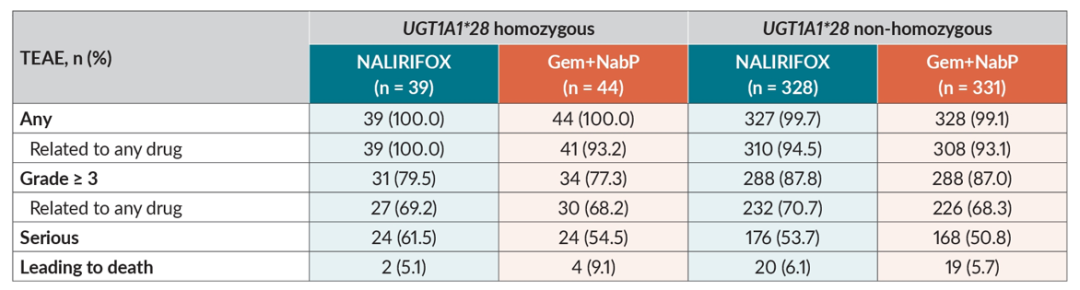
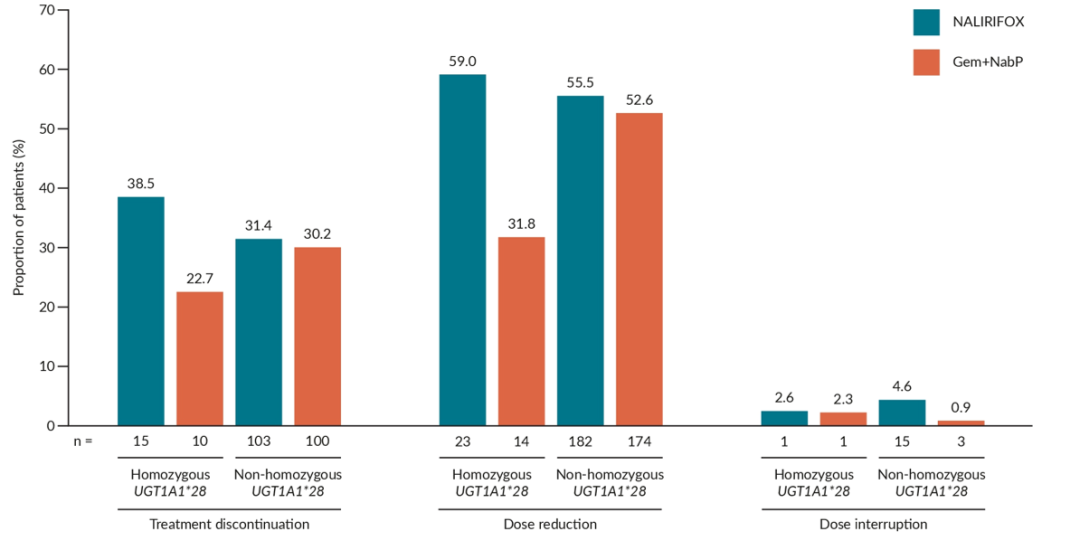
Impact of UGT1A1*28 polymorphism on tolerability in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with NALIRIFOX in NAPOLI 3.
UGT1A1*28多态性对耐受性的影响:伊立替康活性代谢物SN-38经肝酶尿苷二磷酸葡萄糖醛酸转移酶1A1 (UGT1A1)和胆汁排泄清除,且UGT1A1*28(基因型7/7)纯合性与UGT1A1活性降低有关,因此本事后分析旨在分析UGT1A1*28(基因型7/7)纯合性对NAPOLI 3研究患者在治疗中出现的不良事件(TEAE)发生率的影响。
结果显示,TEAE的发生率(包括≥3级TEAE和严重TEAE)在UGT1A1*28纯合子组和非纯合子组之间相似。在NALIRIFOX组中,UGT1A1*28纯合子患者对比NAPOLI 3所有患者,报告频率最高的TEAE分别为腹泻(59.0% vs 70.5%)、恶心(56.4% vs 59.5%)、呕吐(46.2% vs 39.7%)以及贫血(41.0% vs 26.2%)。在吉西他滨联合白蛋白紫杉醇(Gem+NabP)组中,两组报告频率最高的TEAE分别为恶心(45.5% vs 42.7%)、疲劳(45.5% vs 37.7%)、腹泻(45.5% vs 36.7%)以及贫血(40.9% vs 40.4%)。在NALIRIFOX组中,TEAE导致治疗中断、剂量减少或剂量中断的发生率在UGT1A1*28纯合子组和非纯合子组之间没有显著差异。由此可见,UGT1A1*28状态不影响NALIRlFOX方案的安全性与后续剂量调整的需求。但该结论受到UGT1A1*28纯合子患者数量较少的限制。
靶向治疗:新药研发与探索
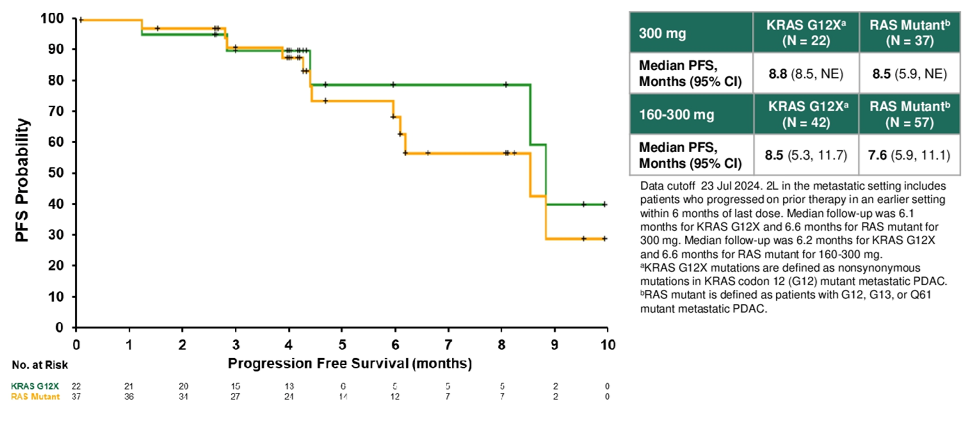
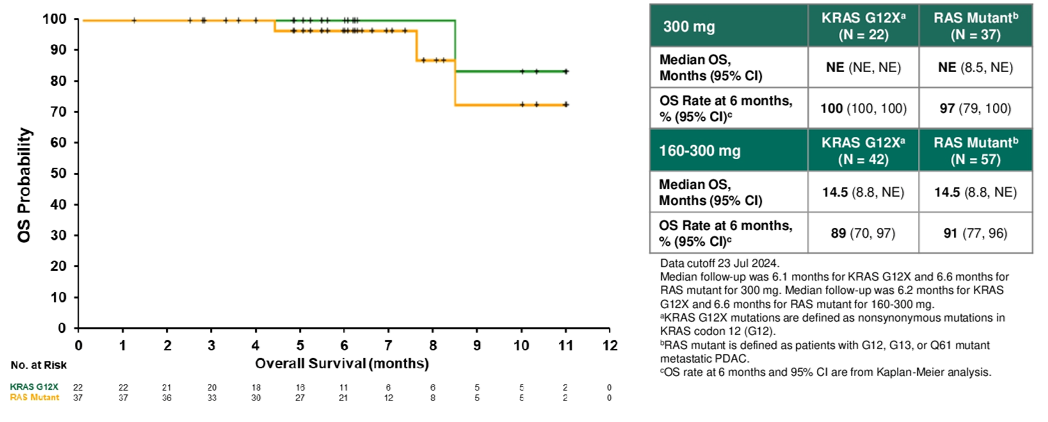
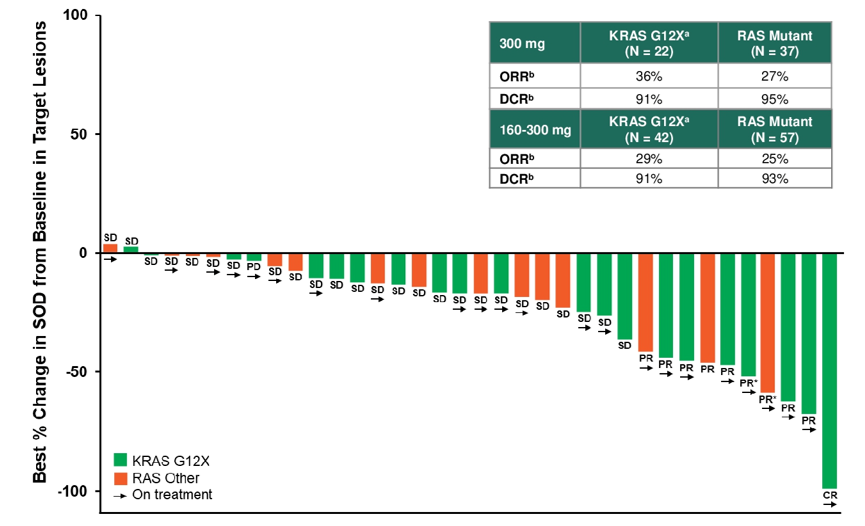
Safety, efficacy, and on-treatment circulating tumor DNA (ctDNA) changes from a phase 1 study of RMC-6236, a RAS(ON) multi-selective, tri-complex inhibitor, in patients with RAS mutant pancreatic ductal adenocarcinoma (PDAC).
RMC-6236的Ⅰ期研究:RAS突变是胰腺癌的主要致癌驱动因素,Daraxonrasib(RMC-6236)是一种RAS(ON)多选择性三复合物抑制剂,可直接抑制失控的RAS(ON)信号传导。本Ⅰ期研究纳入127例RAS突变PDAC患者,84%为KRAS G12X突变患者,其中41例(32%)为KRAS G12D突变、41例(32%)为KRAS G12V突变、25例(20%)为KRAS G12其他突变;20例(16%)为RAS其他突变。评估不同剂量下Daraxonrasib二线治疗的疗效与安全性。
结果显示,在剂量为300 mg QD的情况下,Daraxonrasib显示出可控的安全性,治疗相关不良反应(TRAE)多为1-2级,仅出现1例4级TRAE,未观察到5级TRAE。此外,和接受160-300 mg Daraxonrasb治疗的PDAC患者相比,300 mg剂量下患者PFS、OS和ORR均更优。因此,研究者选取300 mg QD剂量标准Daraxonrasb,进行全球随机Ⅲ期RASolute 302研究,该研究将对比Daraxonrasib和化疗作为先前接受过治疗的转移性PDAC患者二线治疗的价值。
Preliminary result of a phase Ⅰb study: Efficacy and safety of FG-M108 plus gemcitabine/nab-paclitaxel as first-line (1L) treatment in patients with Claudin18.2-positive locally advanced unresectable or metastatic (LA/m) pancreatic cancer.
FG-M108联合化疗的Ⅰb期研究:FG-M108是一种增强抗体依赖性细胞毒性(ADCC)的抗CLDN18.2单克隆抗体,在胃癌一线治疗中显示出显著的疗效。本次大会上,该开放标签、多中心的Ⅰb期研究报告了300mg/m² FG-M108在胰腺癌一线治疗中的安全性和疗效。
研究纳入32例CLDN18.2中高表达且未经治疗的局部进展期/转移性胰腺癌患者,接受FG-M108+吉西他滨+白蛋白紫杉醇一线治疗。结果显示,所有患者均出现任意级别的TEAE,其中15例(46.9%)出现≥3级FG-M108相关TRAE。最常见的TRAE为贫血、恶心和低白蛋白血症。
患者的中位随访时间为9.5个月,最长治疗时间为13个月。经研究者评估,9例患者达确认的PR,2例患者达未确认的PR,ORR为34.4%,疾病控制率(DCR)为100.0%。中位缓解持续时间(DOR)达到9.8个月,中位PFS为9.7个月。
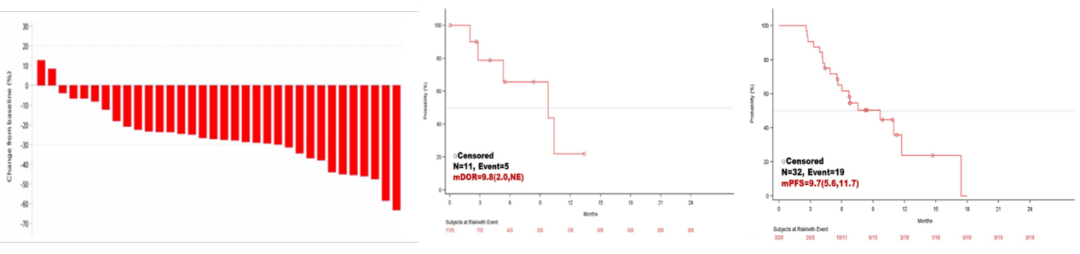
经独立审查委员会(IRC)评估,16例患者达确认的PR, 1例达未确认的PR,ORR为53.1%,DCR为100.0%,中位PFS达到9.9个月。OS数据尚未成熟,生存的23例患者的中位OS为17.4个月。
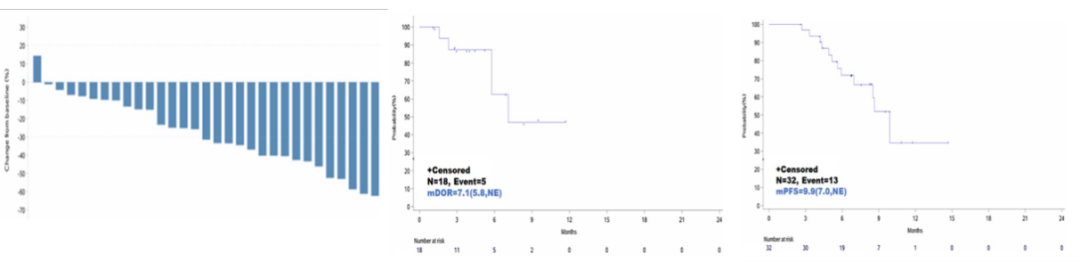
FG-M108联合化疗作为CLDN18.2阳性胰腺癌患者的一线治疗,耐受性良好,尤其是在CLDN18.2高表达的患者中显示出令人鼓舞的生存结果,值得进一步研究。
免疫治疗:探索新策略与联合方案
Clinical outcomes of immunotherapy in metastatic pancreatic carcinoma: A systematic review and meta-analysis.
转移性胰腺癌免疫治疗的荟萃分析:传统的治疗方式,如化疗和放疗,对于转移性胰腺癌疗效有限,本荟萃分析旨在探讨免疫治疗作为转移性胰腺癌的潜在治疗选择。
研究根据PRISMA指南检索PubMed、Cochrane、Embase和Clinicaltrials.gov数据库资料,共纳入834例患者、17项报告转移性胰腺癌免疫治疗结果的研究,包括4项I期研究(23.5%)、2项Ib期研究(11.8%)、1项Ib/II期研究(5.9%)、5项II期研究(29.4%)、1项回顾性研究(5.9%)和4项前瞻性研究(23.5%)。免疫治疗方案包括GVAX、曲美木单抗、间皮素特异性嵌合抗原受体T细胞、度伐利尤单抗、帕博利珠单抗、canerpaturev、sotigalimab、纳武利尤单抗、CO-1.01、异体自然杀伤细胞免疫治疗、抗EGFR嵌合抗原受体修饰T细胞、双特异性抗体武装T细胞和clivatuzumab tetraxetan等。
中位随访时间为17.8个月后,中位OS为7.9个月,中位PFS为4.6个月,ORR为16%(95% CI 0.09-0.26,I²=70,p<0.01,n=426)。部分缓解(PR)率为13%(95% CI 0.09-0.26,I²=67%,p<0.01,n=272)。疾病稳定率(SD)为28%(95% CI 0.2-0.39,I²=59%,p<0.01,n=277)。疾病进展率(PD)为36%(95% CI 0.23-0.52,I²=34%,p=0.22,n=68)。最常见的不良事件为贫血、腹泻和血小板减少。
本荟萃分析表明,新型免疫治疗在转移性胰腺癌中显示出有希望的结果。未来需要开展新的临床试验,以跟进当前早期研究的结果。
胆道恶性肿瘤
靶向治疗:真实世界验证精准治疗的重要性
Real-world impact of matched targeted therapy on survival in advanced biliary tract cancer: An international collaborative study.
匹配靶向治疗的真实世界研究:一项国际多中心研究旨在评估靶向治疗对晚期胆道恶性肿瘤(BTC)患者生存的真实世界影响。入组患者均至少接受了30天的姑息性系统治疗,并被分为三类:1. 无可靶向治疗突变组(n=566):肿瘤无靶向治疗的突变患者。2. 未匹配组(n=231):携带可靶向治疗的突变但未接受匹配治疗的患者。3. 匹配组(n=135):携带可靶向治疗的突变并且在任一治疗线接受了匹配靶向治疗的患者。使用Kaplan-Meier方法估算OS。
结果显示,与其他组相比,匹配组的中位OS显著更长,达21.4个月;未匹配组的3年OS率最低(7%),显著低于无可靶向治疗突变组(19%)和匹配组(33%)(p<0.0001)。
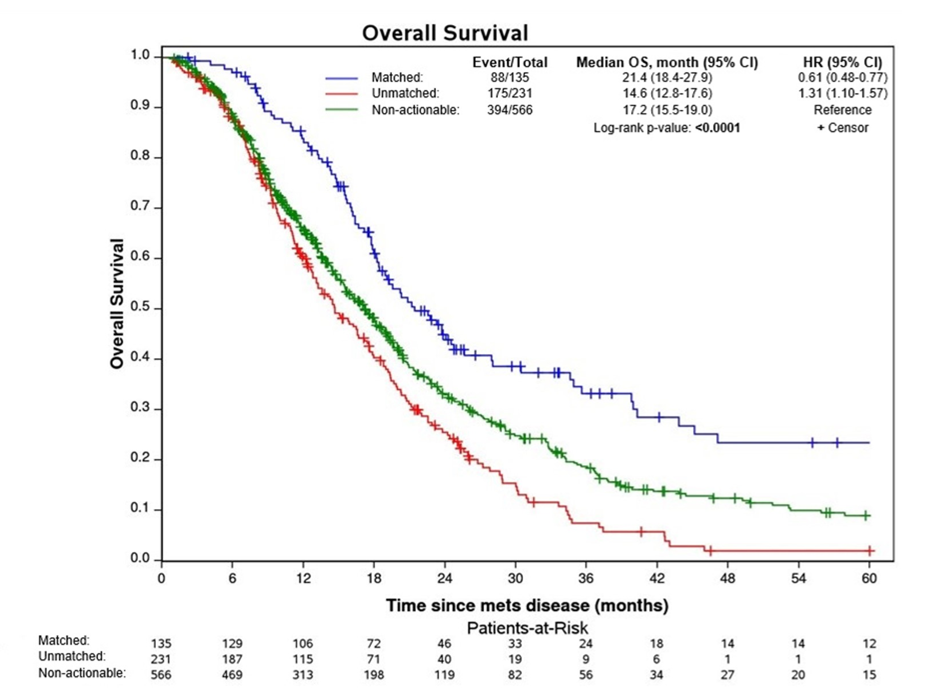
多变量Cox回归模型中,对诊断时年龄>65岁、性别、既往原发肿瘤切除以及参与中心等因素进行调整后,采取匹配的靶向治疗与OS改善相关(HR=0.61,95% CI 0.47-0.78)。
大会披露的另一项对比全球胆管癌数据的真实世界研究同样指出,携带FGFR2融合的患者中位OS最长,为23.3个月,其次是IDH1突变(19.3个月)和TMB > 10 mut/Mb(17.8个月)患者,而BRCA1/2突变、HER2扩增和KRAS G12C/D突变的患者中位OS分别为16个月、15.5个月和11.6个月。
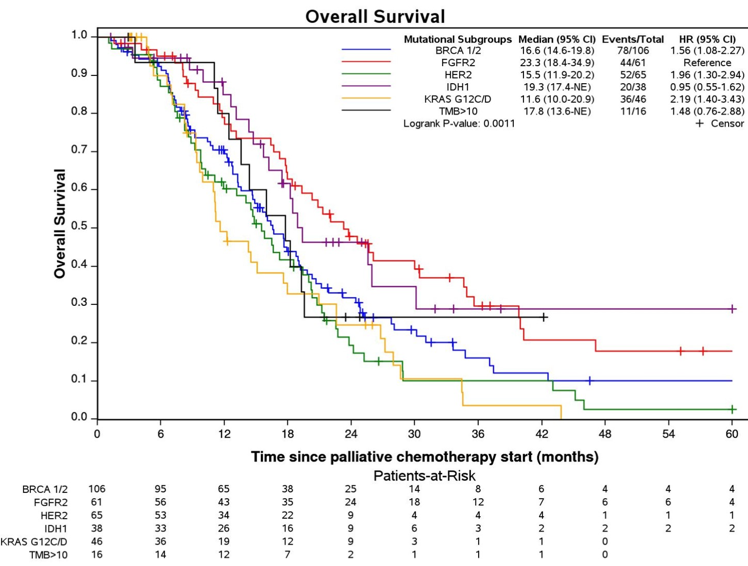
本研究是迄今为止最大规模的证实匹配的靶向治疗能够改善有对应分子靶点的晚期BTC患者生存的真实世界证据。对于符合条件的患者延迟使用靶向治疗会导致显著更差的生存结果。约25%到44%的患者在一线治疗后可能不再符合治疗条件,延迟使用靶向药物可能会导致患者失去生存机会,这些发现强调了更早使用靶向治疗以及提高药物可及性的重要性。
基因图谱与分子检测
Extra-hepatic (ehCCA) and intra-hepatic cholangiocarcinomas (iCCA): A genomic landscape comparison of peri-hilar (phCCA), common bile duct (cbdCCA) and gallbladder (gbCCA) with iCCA.
基因组图谱比较分析:本研究使用综合基因组图谱(CGP),比较phCCA(n=110)与cbdCCA(n=743)、gbCCA(n=2983)和iCCA(n=9187)的基因组突变(GA)情况,包括FGFR2、IDH、ERBB2、BRAF以及免疫药物应答预测因子(MSl状态、TMB和PD-L1)等。
结果显示,gbCCA的GA/肿瘤率显著更高(p=0.0001)。与iCCA相比,其他三组FGFR2和IDH相关突变的发生率显著更低。gbCCA中,BRAF、CDKN2A、MTAP和PIK3CA的GA与phCCA和cbdCCA相似。在ehCCA中,ERBB2的GA频率最高,为16.5%,显著高于iCCA(P<0.0001)。与gbCCA相比,phCCA和cbdCCA中KRAS(包括KRAS G12C)GA频率更高(P=0.0015),TP53 GA在gbCCA中最高。与免疫药物相关的生物标志物,如基因组杂合性缺失(gLOH)/同源重组缺陷(HRD)和错配修复(MMR)基因组特征状态的频率在所有组中相似。
综上,ehCCA亚型具有特征性的GA谱,这些特征可能会影响治疗选择。与iCCA相比,ehCCA中FGFR2和IDH1的GA频率较低。相比之下,可靶向的ERBB2和KRAS G12C在ehCCA中比在iCCA中更为常见。
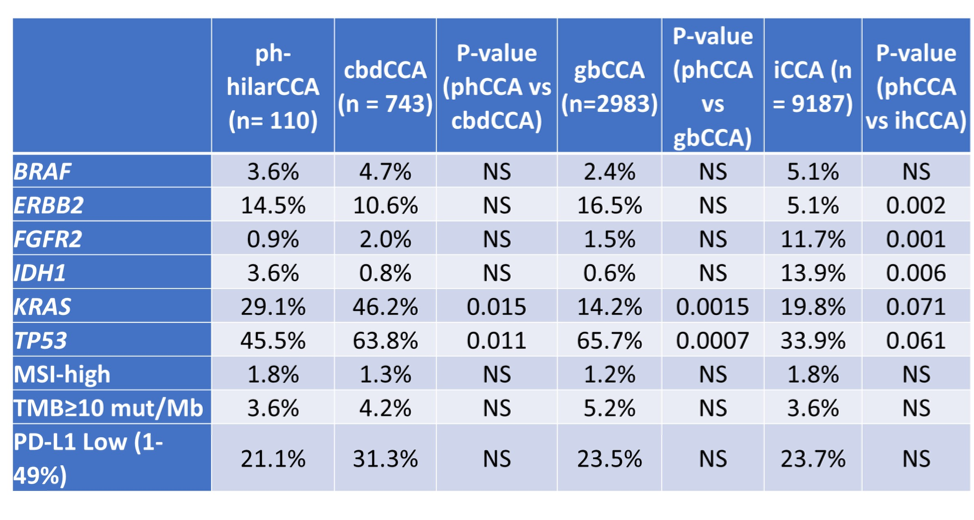
免疫治疗:一线联合化疗应用策略
Real-world survival differences in advanced biliary tract cancer patients with ctDNA detected IDH1 mutations and FGFR2 fusions receiving first-line gemcitabine-cisplatin with and without immunotherapy.
一线化疗与免疫治疗预后:基于TOPAZ-1和KEYNOTE-966试验,吉西他滨+顺铂(GemCis)联合度伐利尤单抗或帕博利珠单抗是转移性胆道恶性肿瘤(mBTC)的标准一线治疗方案。但对于存在可靶向治疗的突变患者,免疫治疗的加入可能导致更差的预后。为此,本真实世界研究对比ctDNA检测到IDH1突变(IDH1+)或FGFR2融合(FGFR2+)的mBTC患者仅接受GemCis治疗与GemCis联合免疫检查点抑制剂(GemCis+IO)治疗的预后结果。
研究筛选出GuardantINFORM(Guardant Health)数据库中4840例mBTC患者,其中412例为IDH1+,154例为FGFR2+。
结果提示,与一线接受GemCis+IO 的IDH1+ mBTC患者相比,IDH1阴性(IDH1-)患者的OS数值上更优(18.6个月 vs 16.0个月,p=0.075)(图A);对于一线仅接受GemCis的患者,两组OS相似(25.3个月 vs 30.0个月,p=0.23)(图B)。
与之不同的是,一线接受GemCis+IO 的FGFR2+和FGFR2-患者之间OS相似(18.6个月 vs NR,p=0.5)(图C);对于一线仅接受GemCis的患者,FGFR2+患者OS显著更优(43.0个月 vs 25.1个月,p=0.004)(图D)。
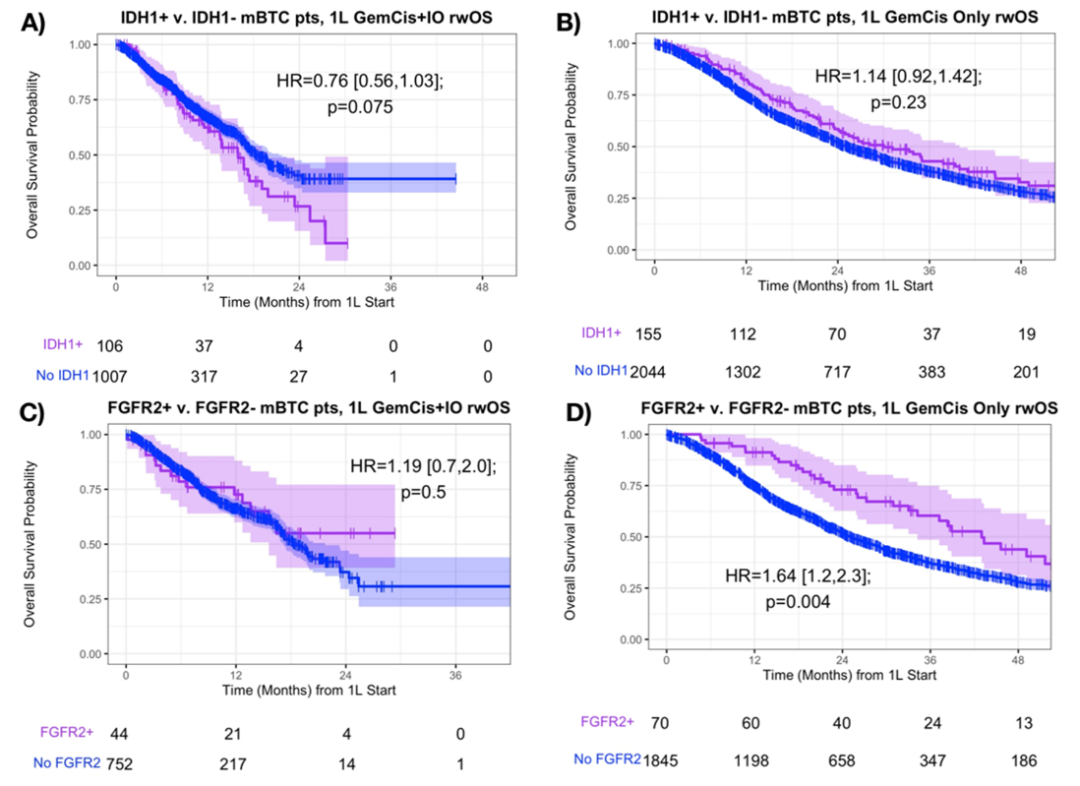
对于IDH1+患者,与接受GemCis+IO的相比,接受GemCis的患者OS显著更优(16.0个月 vs 20.0个月,p<0.001);FGFR2+患者中也观察到相似的情况(NR vs 43.0个月,p=0.005)。但在IDH1+患者和FGFR2+患者中均观察到,不论仅接受GemCis还是接受GemCis+IO,真实世界至后线治疗时间(TTNT)和至停药时间(TTD)均无显著差异。
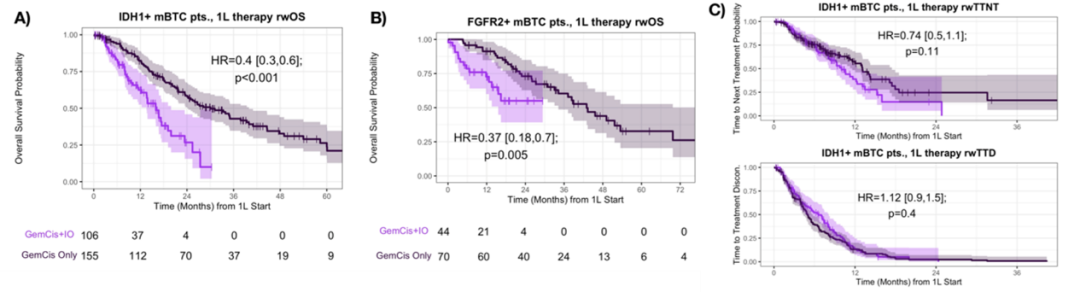
在有二线治疗信息的IDH1+患者中,艾伏尼布是最常见的二线治疗药物(38.1%)。一线接受GemCis的IDH1+患者的rwTTNT(19.1个月 vs 3.2个月,P<0.01)(图A)和rwTTD(3.6个月 vs 3.0个月,P=0.04)(图B)均显著长于接受GemCis+IO的患者。
此外,接受一线GemCis和二线艾伏尼布治疗的患者的真实世界OS不仅比接受一线GemCis+IO和二线艾伏尼布治疗患者更优(49.0个月 vs 16.7个月,P=0.004);也比接受一线GemCis+IO和二线其他治疗的患者更优(33.9个月 vs 16.7个月,P=0.0021)(图C)。
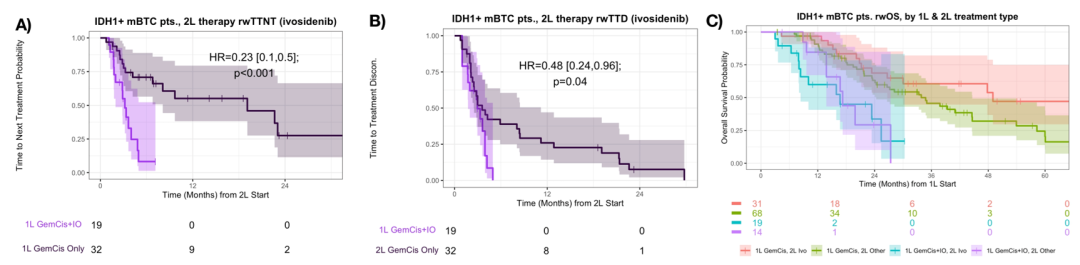
综上,对于lDH1+和FGFR2+的mBTC患者,一线GemCis基础上添加免疫治疗后,真实世界OS更差。接受一线GemCis+IO治疗的lDH1+ mBTC患者,无论二线治疗类型如何,其真实世界TTNT、TTD和OS均较差。数据表明,具有可靶向治疗突变的mBTC患者在没有免疫治疗的情况下可从GemCis一线治疗中获益。这些发现凸显了初诊时应进行全面基因组分析,以帮助一线治疗方案选择,但具体作用还需进一步验证。
结语
2025年ASCO GI大会上,胰腺癌和胆道恶性肿瘤领域展示了诸多令人瞩目的前沿进展,为临床治疗提供了新的启示。一方面,随着对肿瘤生物学和免疫微环境的深入了解,通过基因检测和分子标志物的筛选,无疑能为患者制定更加个性化的精准治疗方案。另一方面,NALIRIFOX等一线治疗方案的改进与探索的不断深化,有望进一步延长患者的生存。此外,新型靶点的挖掘、RMC-6236和FG-M108等新药研发将为胰腺癌带来更多治疗选择。胆管癌治疗中靶向治疗的重要性日益凸显,多项指南推荐患者进行IDH1、FGFR2、HER2等基因检测,并进行匹配的靶向治疗,以期取得更优的预后。例如,IDH1突变晚期胆管癌患者可选择艾伏尼布靶向治疗。期待未来出现更多的高质量研究,将前沿进展转化为切实的临床获益,推动胰腺癌和胆道恶性肿瘤治疗领域的持续发展。
1. Paul Cockrum, et al. Overall survival (OS) of patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with first-line (1L) FOLFIRINOX (FFX): Bridging the gap between the NAPOLI 3 trial and real-world practice. 2025 ASCO GI NO.690.
2. Anjan J Patel, et al. Effect of dose adjustments on overall survival (OS) in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with NALIRIFOX: A post hoc analysis of NAPOLI 3. 2025 ASCO GI NO.716.
3. Maen Abdelrahim, et al. Impact of UGT1A1*28 polymorphism on tolerability in patients with metastatic pancreatic ductal adenocarcinoma (mPDAC) treated with NALIRIFOX in NAPOLI 3. 2025 ASCO GI NO.717.
4. Ignacio Garrido-Laguna, et al. Safety, efficacy, and on-treatment circulating tumor DNA (ctDNA) changes from a phase 1 study of RMC-6236, a RAS(ON) multi-selective, tri-complex inhibitor, in patients with RAS mutant pancreatic ductal adenocarcinoma (PDAC). 2025 ASCO GI NO.722.
5. Funan Liu, et al. Preliminary result of a phase Ib study: Efficacy and safety of FG-M108 plus gemcitabine/nab-paclitaxel as first-line (1L) treatment in patients with Claudin18.2-positive locally advanced unresectable or metastatic (LA/m) pancreatic cancer. 2025 ASCO GI NO.729.
6. Moazzam Shahzad, et al. Clinical outcomes of immunotherapy in metastatic pancreatic carcinoma: A systematic review and meta-analysis. 2025 ASCO GI NO.688.
7. Binbin Zheng-Lin, et al. Real-world impact of matched targeted therapy on survival in advanced biliary tract cancer: An international collaborative study. 2025 ASCO GI NO.536.
8. Oluseyi Abidoye, et al. A global comparative study on real-world clinical and genomic differences in advanced biliary tract cancer. 2025 ASCO GI NO.628.
9. Parth J Sampat, et al. Extra-hepatic (ehCCA) and intra-hepatic cholangiocarcinomas (iCCA): A genomic landscape comparison of peri-hilar (phCCA), common bile duct (cbdCCA) and gallbladder (gbCCA) with iCCA. 2025 ASCO GI NO.630.
10. Richard D. Kim, et al. Real-world survival differences in advanced biliary tract cancer patients with ctDNA detected IDH1 mutations and FGFR2 fusions receiving first-line gemcitabine-cisplatin with and without immunotherapy. 2025 ASCO GI NO.548.
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


