肿瘤相关性贫血(CRA)常见于恶性肿瘤患者,尤其在血液系统恶性肿瘤患者中,贫血的发生概率明显高于实体瘤患者,且输血需求巨大1-3。化疗药物是导致贫血的主要原因,严重影响患者的生活质量和疾病预后4。传统治疗手段如红细胞生成刺激剂(ESA)和输血虽然在一定程度上能够缓解贫血,但不可避免地伴随血栓及心血管事件风险的增加5-7。在此背景下,红细胞成熟剂罗特西普在临床案例中展现出能够有效改善血液肿瘤化疗后贫血的作用,为血液肿瘤化疗后贫血的治疗开辟了新的路径。近期,厦门大学附属中山医院胡嘉升教授就血液肿瘤化疗相关性贫血的内容进行了分享。现整理如下,以飨读者。
厦门大学附属中山医院主任医师,医学博士 ,硕士生导师
福建省医学会血液学分会委员
福建省中西医结合学会血液病学分会委员
福建省医师协会血液内科分会造血干细胞移植学组委员
厦门医师协会委员
福建省抗淋巴瘤联盟第一届委员会委员
血液肿瘤治疗后贫血现状与病因:输血负荷重,骨髓抑制是主要原因
贫血是肿瘤患者常见的并发症,30%~90%的肿瘤患者会发生CRA5。相关研究发现,血液系统恶性肿瘤患者普遍存在贫血,且面临较大的输血需求。尤其在急性髓系白血病(AML)、骨髓异常增生综合征(MDS)以及多发性骨髓瘤(MM)患者中,输血负荷相较于其他血液肿瘤较大,且主要通过输注红细胞来缓解贫血症状3。然而,伴随而来的输血依赖问题加剧了患者的再入院频率,严重影响了患者的生存时间与生活质量8。
从CRA的发生机制上来看,失血、溶血、红细胞生成减少、促红细胞生成素(EPO)水平下降等均可能影响导致CRA的发生,而化疗药物的使用是主要原因5。一项来自法国的多中心回顾性研究发现,在接受化疗药物治疗后,血液系统恶性肿瘤患者相较于实体瘤患者更容易发生化疗相关性贫血(CIA)2。除此之外,不同的化疗方案引起的CIA的发生率具有一定的差异,但总体来看,CIA的发生率会随着化疗剂量的增多而增高,两者呈现剂量依赖性9。
为什么会出现CIA?研究发现,化疗药物会通过引起造血干/祖细胞细胞周期停滞,或红系造血细胞凋亡影响骨髓造血功能,进而诱发贫血,这也是化疗药物导致CRA的主要作用机制10。除此之外,化疗会引起持续残留骨髓损伤,对骨髓造成几乎不可恢复的影响,可能导致血液肿瘤患者出现移植后植入功能不良的问题;额外的造血应激如巩固治疗周期或自体干细胞移植可能加速骨髓干细胞损伤,进展为更严重的疾病状态如MDS;同时,化疗引起的DNA损伤会激活p53-p21Cip1/Waf1和/或p16Ink4a-RB通路,诱导造血干细胞(HSC)衰老,直接导致贫血的发生11,12。
除了对骨髓和HSC的影响,化疗药物还会刺激促炎因子如干扰素(IFNs)、白细胞介素(IL)-1β、IL-6和肿瘤坏死因子(TNF)-α等的表达,导致炎症反应的发生;还可能引起药物代谢酶(DMEs)活性的改变,加重药物清除率降低和药物毒性风险增加等不良反应13。因此,在血液肿瘤的治疗过程中,应充分认识到化疗对机体的深远影响,并采取有效的措施来减轻化疗对机体的损伤、促进恢复。
血液肿瘤化疗相关性贫血的管理:罗特西普可作为潜在治疗手段
目前针对血液肿瘤CIA的治疗,以输血和ESA为主4。然而,这两种方法均伴随着不容忽视的风险与挑战。输血虽然能有效缓解贫血症状,但可能引发输血依赖及一系列与治疗相关的并发症;而就ESA来看,尽管《中国肿瘤相关贫血诊治专家共识(2023版)》已对ESA的治疗时机与剂量给出了明确指导5,但Meta分析揭示ESA的使用与静脉血栓栓塞(VTE)的风险显著增加相关,特别是在血液系统恶性肿瘤患者中,其VTE风险相较于实体瘤患者更为显著6;同时,研究人员在MM和MDS患者中也观察到了与ESA治疗相关的VTE、心肌梗死(MI)和中风等血栓风险和心血管事件风险14。因此,对于血液肿瘤患者而言,采取恰当的治疗措施以优化贫血管理、减少输血依赖及降低ESA相关风险显得尤为关键。
罗特西普作为一种全球首创且目前唯一的红细胞成熟剂,可减少无效红细胞的生成,并促进晚期红细胞成熟,内源性改善无效造血,降低输血负担(图1)15。
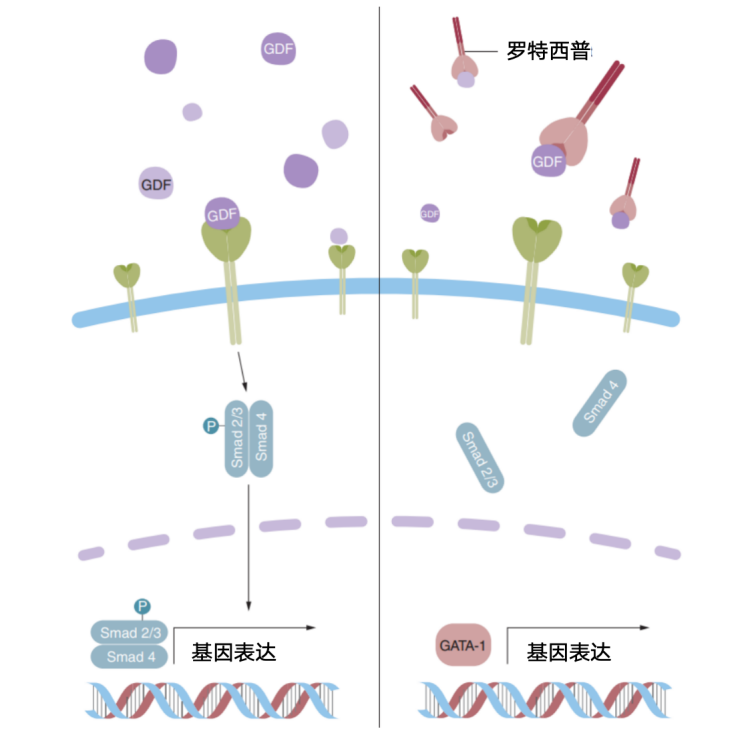
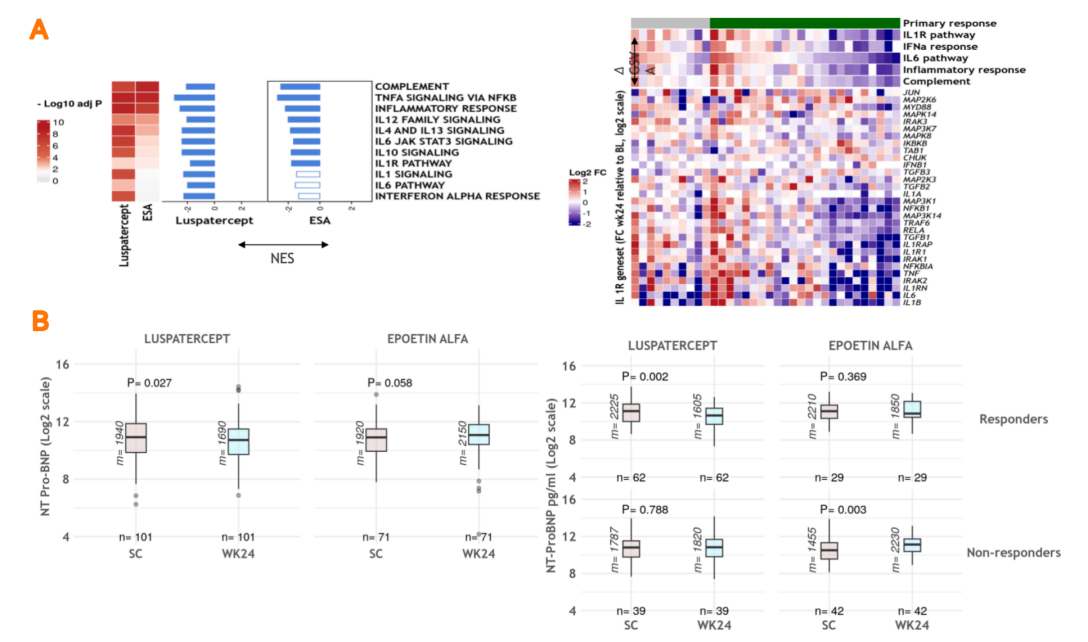
II期BEYOND研究和III期BELIEVE研究分别发现,罗特西普能够显著提高非输血依赖型β-地中海贫血患者的血红蛋白水平,减少输血依赖型β-地中海贫血患者的输血负荷16,17;III期COMMANDS研究证实罗特西普治疗一线治疗输血依赖的较低危MDS,在1-24周期间实现脱离输血≥12周且平均Hb增加≥1.5g/dL的患者比例是ESA的近2倍(60.4% vs 30.8%,P < 0.0001)18;COMMANDS研究生物标志物分析显示,罗特西普能够下调IL-1信号传导、IL-6通路和IFNα反应,减轻炎症水平(图2A),同时降低患者的氨基末端脑钠肽前体(NT-proBNP)水平,提示其在减轻心衰方面具有潜在作用(图2B)19。
另外,相关动物模型研究对于罗特西普治疗化疗引起的贫血的使用时机进行了探索,在化疗性贫血大鼠模型中发现,在化疗结束第11天开始使用罗特西普改善CIA是一个比较理想的治疗时机(图3)20。

罗特西普治疗化疗相关性贫血的病例分享
病例展示
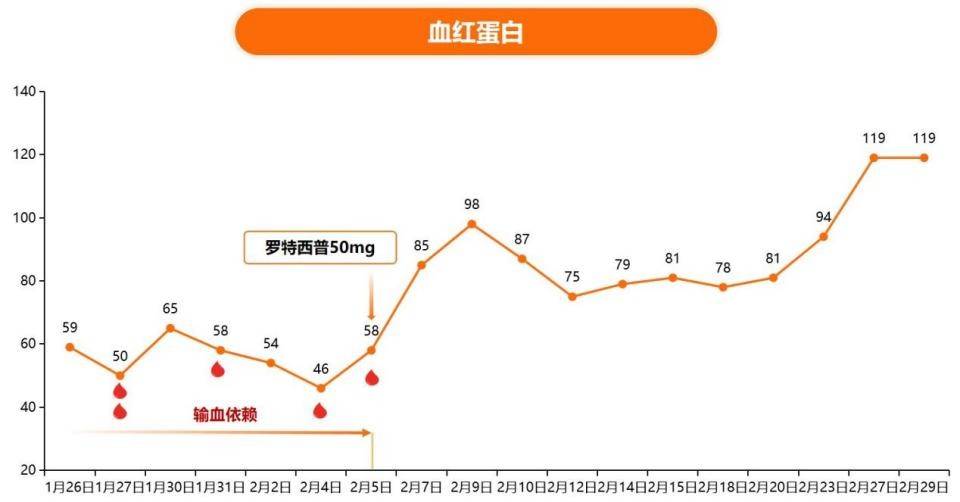
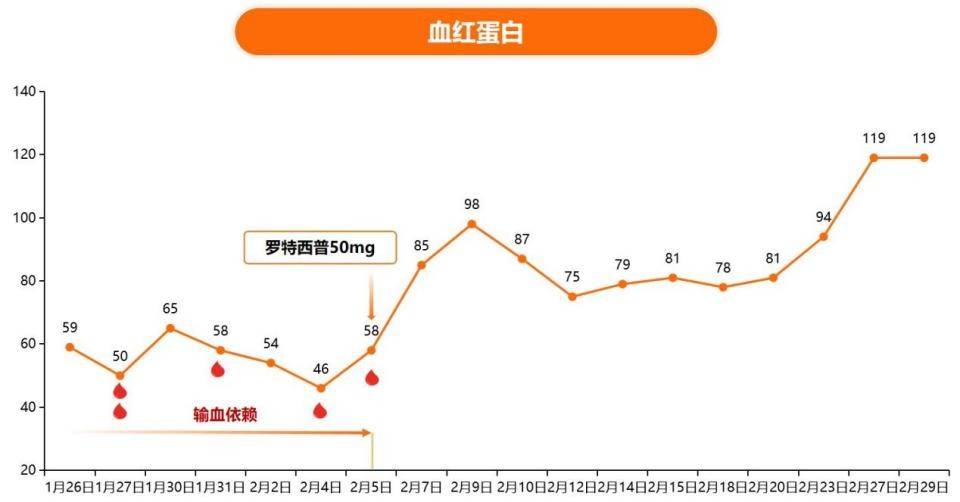
病例一:
患者:林XX
年龄:57岁
性别:女
诊断:T淋巴母细胞淋巴瘤(IV期A组IPI1分)
治疗:2024-01-06起予CAT方案化疗
病例二:
患者:翁XX
年龄:34岁
性别:女
诊断:急性B淋巴细胞白血病
治疗:2024-01-30起予VP方案降低肿瘤负荷治疗;2024-02-02~02-23予贝林妥欧单抗治疗
病例三:
患者:史XX
年龄:65岁
性别:女
诊断:多发性骨髓瘤(IgA-K型D-S分期III,ISS II期,R-ISS II期A组)
治疗:苯达莫司汀300mg-2d+马法兰250mg-2d
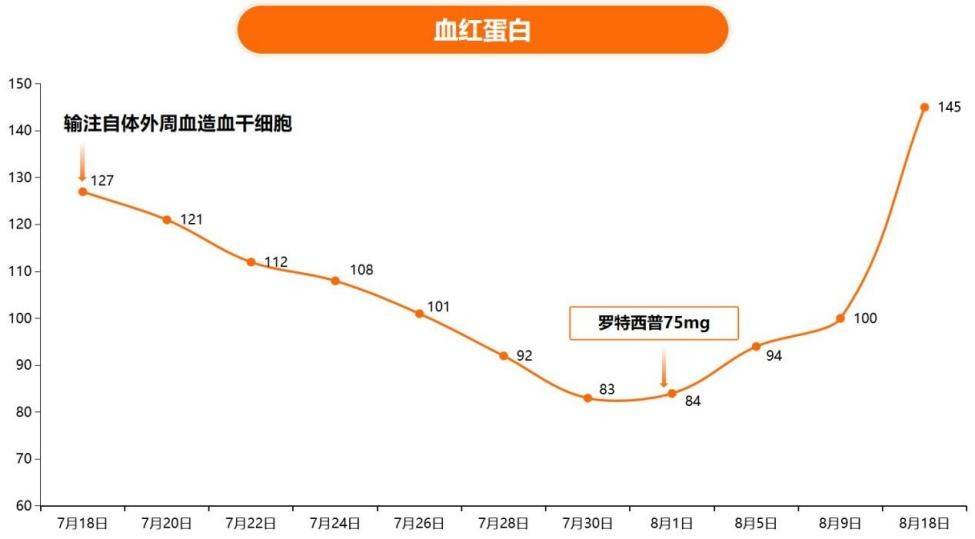
从上述三个临床案例中可以清晰观察到,罗特西普作为一种潜在的治疗手段,展现出在改善血液肿瘤患者化疗后贫血症状方面的积极效果。这些初步成果不仅为患者带来了新的治疗希望,也预示着该药物在这一领域具有广泛的应用前景,也有待临床试验来进一步验证。
总结
罗特西普作为一种首创红细胞成熟剂,已经在多个临床试验中展现出显著改善无效造血所致贫血、减轻输血负荷的能力。此外,罗特西普在改善骨髓微环境、降低炎症水平、减轻心衰风险方面也展现出积极作用。临床案例显示,罗特西普在血液肿瘤化疗后有效改善贫血,虽然有待进一步临床实验验证,但总体而言,罗特西普为血液肿瘤化疗后贫血的治疗开辟了新路径,带来了治疗的新希望。
1. Knight K, Wade S, Balducci L. Prevalence and outcomes of anemia in cancer: a systematic review of the literature. Am J Med. 2004;116 Suppl 7A:11S-26S.
2. Clarke H, Pallister CJ. The impact of anaemia on outcome in cancer. Clin Lab Haematol. 2005;27(1):1-13.
3. Zhao J, Rydén J, Wikman A, et al. Blood use in hematologic malignancies: a nationwide overview in Sweden between 2000 and 2010. Transfusion. 2018;58(2):390-401.
4. 沈岚,陆舜. 化疗相关性贫血[J]. 中华内科杂志, 2023, 62(3): 242-246.
5. 中国抗癌协会肿瘤临床化疗专业委员会, 中国抗癌协会肿瘤支持治疗专业委员会. 中国肿瘤相关贫血诊治专家共识(2023版)[J]. 中华肿瘤杂志, 2023, 45(12):1032-1040.
6. Gao S, Ma JJ, Lu C. Venous thromboembolism risk and erythropoiesis-stimulating agents for the treatment of cancer-associated anemia: a meta-analysis. Tumour Biol. 2014;35(1):603-613.
7. Horváth-Puhó E, Suttorp MM, Frederiksen H, et al. Erythropoiesis-stimulating agents and cardiovascular events in patients with myelodysplastic syndrome and multiple myeloma. Clin Epidemiol. 2018;10:1371-1380.
8. Medeiros BC. Non-zero-sum game of transfusions: EOL in leukemia. Blood. 2018;132(7):676-678.
9. Xu H, Xu L, Page JH, et al. Incidence of anemia in patients diagnosed with solid tumors receiving chemotherapy, 2010-2013. Clin Epidemiol. 2016;8:61-71.
10. van den Boogaard WMC, Komninos DSJ, Vermeij WP. Chemotherapy Side-Effects: Not All DNA Damage Is Equal. Cancers (Basel). 2022;14(3):627.
11. Wang Y, Probin V, Zhou D. Cancer therapy-induced residual bone marrow injury-Mechanisms of induction and implication for therapy. Curr Cancer Ther Rev. 2006;2(3):271-279.
12. Shao L, Wang Y, Chang J, et al. Hematopoietic stem cell senescence and cancer therapy-induced long-term bone marrow injury. Transl Cancer Res. 2013;2(5):397-411.
13. Tao G, Huang J, Moorthy B, et al. Potential role of drug metabolizing enzymes in chemotherapy-induced gastrointestinal toxicity and hepatotoxicity. Expert Opin Drug Metab Toxicol. 2020;16(11):1109-1124.
14. Horváth-Puhó E, Suttorp MM, Frederiksen H, et al. Erythropoiesis-stimulating agents and cardiovascular events in patients with myelodysplastic syndrome and multiple myeloma. Clin Epidemiol. 2018;10:1371-1380.
15. Longo, F., Tesio, N., Piolatto, A., Ferrero, G. B., & Piga, A. (2021). Luspatercept for the Treatment of β-Thalassemia: from Preclinical Research to Clinical Practice and Beyond. Future Rare Diseases, 1(4).
16. Taher AT, Cappellini MD, Kattamis A, et al. Luspatercept for the treatment of anaemia in non-transfusion-dependent β-thalassaemia (BEYOND): a phase 2, randomised, double-blind, multicentre, placebo-controlled trial. Lancet Haematol. 2022;9(10):e733-e744.
17. Cappellini MD, Viprakasit V, Taher AT, et al. A Phase 3 Trial of Luspatercept in Patients with Transfusion-Dependent β-Thalassemia. N Engl J Med. 2020;382(13):1219-1231.
18. Della Porta MG, Garcia-Manero G, Santini V, et al. Luspatercept versus epoetin alfa in erythropoiesis-stimulating agent-naive, transfusion-dependent, lower-risk myelodysplastic syndromes (COMMANDS): primary analysis of a phase 3, open-label, randomised, controlled trial. Lancet Haematol. 2024;11(9):e646-e658.
19. Hayati S, et al. ASH 2023 [Abstract #1845]
20. Suragani RN, Cadena SM, Cawley SM, et al. Transforming growth factor-β superfamily ligand trap ACE-536 corrects anemia by promoting late-stage erythropoiesis. Nat Med. 2014;20(4):408-414.
排版编辑:肿瘤资讯-XZY











 苏公网安备32059002004080号
苏公网安备32059002004080号


