胆道恶性肿瘤(BTC)是一组起源于胆道上皮细胞的高度异质性肿瘤。晚期患者占比最大,而传统化疗疗效非常有限,免疫和靶向等新型抗肿瘤治疗手段带来了新的希望,正在逐步革新指南、改变实践、改善现状。岁末年初是总结过去、鉴往知来的关键节点。值此一年一度的重要时刻,特邀中山大学附属肿瘤医院赵明教授系统盘点和解读2024年BTC领域靶向治疗相关进展,与大家共享前沿、共启新程。
专家简介
中山大学附属肿瘤医院 华南恶性肿瘤防治全国重点实验室
教授,主任医师,博士生导师,科室副主任(主持工作)
2006年获得中山大学肿瘤学博士学位;2011.5-2013.9 美国哈佛大学医学院Brigham and Women’s Hospital:Research Fellow;2008.4西班牙巴塞罗那BCLC访问学习
发表及共同发表论文100余篇,参与及制定、修订国内及国际原发性肝癌及肝癌介入治疗多项指南;作为第一负责人承担国家、省部级、国家重点研发专项子课题、中山大学5010计划、国际多中心III期、研究者发起的临床研究等课题二十余项,牵头制定肝动脉灌注治疗中国专家共识(Hepatology International 2024)
国家卫生健康委员会能力建设和继续教育肿瘤学专家委员会(首届) 委员
国家癌症中心肝癌质控专家委员会(首届) 委员
中国抗癌协会(CACA)肿瘤介入专业委员会副主任委员(第六届);化疗免疫专家委员会主任委员;肝癌专业委员会委员
中国医药教育协会介入微创专业委员会副主任委员(第三届)
中国临床肿瘤学会(CSCO) 肝癌专家委员会常务委员;介入专业委员会常务委员
广州肿瘤微创介入专业委员会(GACA)主任委员(第三届),广州抗癌协会常务理事
荣获第八届羊城好医生(2022); 广东省最具实力的中青年医生(2019)
靶向需求,精准发力
——可干预靶点承载预后改善希望
70%以上的BTC患者发病时已达晚期,失去了根治性手术机会[1],系统治疗成为其延长生存的主要手段。一线治疗中,免疫检查点抑制剂治疗的加入打破了单纯化疗长期以来的疗效瓶颈,生存期获得一定程度的延长,但BTC具有高度的分子异质性,基于分子分型实施个体化靶向和免疫治疗是精准肿瘤学时代大势所趋,也是进一步改善BTC患者预后的重要“支点”。
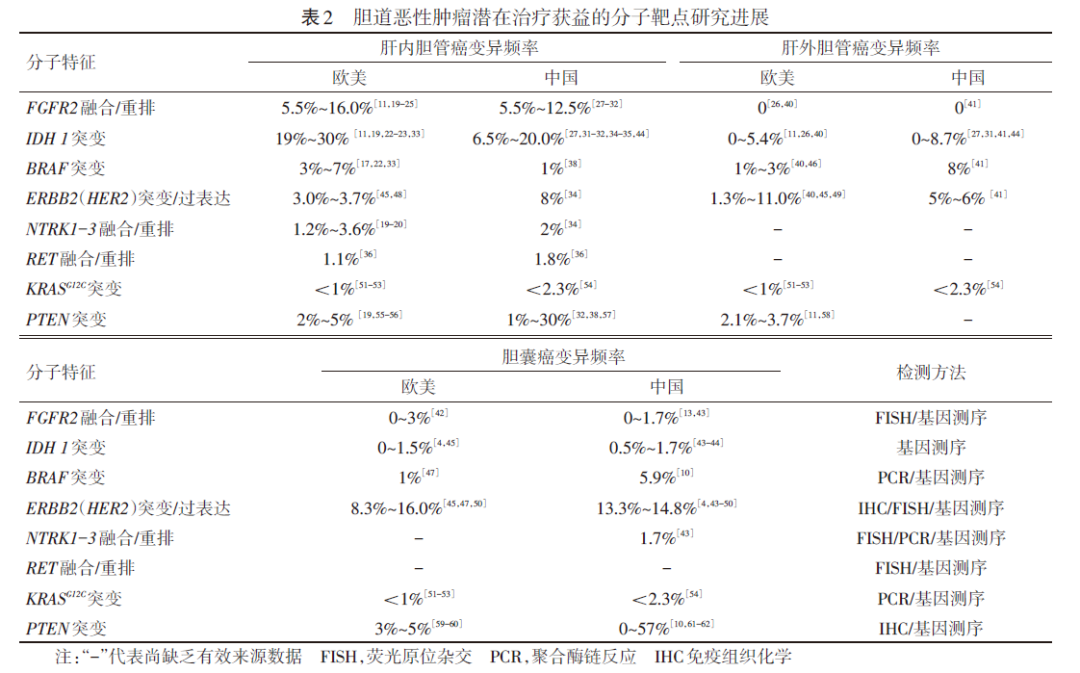
研究显示,约半数BTC患者携带当前可干预的基因变异[2]。2024年发布的《中国抗癌协会胆道恶性肿瘤靶向及免疫治疗指南(2024)》[3]总结了目前已知BTC可干预靶点在不同部位、不同地区患者中的阳性率(表1),凸显了靶向治疗推动BTC领域进步的巨大潜力。
“凡益之道,与时偕行”
——写进2024指南里的靶向诊疗进展
紧跟国际步伐
2024年4月9日至11月27日期间,NCCN相继发布了《BTC临床实践指南》2024年第1版至第5版,几乎每一版更新中都有靶向治疗相关内容,体现了这一精准治疗手段在BTC领域日益增长的权重。
2024年第1版中,分子检测条目中新增了KRAS G12C突变(表2);RET融合阳性不可切除或转移性BTC一线治疗中,塞普替尼应用范围去掉了2023年第3版中限定的“仅胆管癌”,扩大为BTC;HER2阳性BTC二线治疗新增了Tucatinib+曲妥珠单抗(2A类);并新增了KRAS G12C突变这一分子分型,二线治疗推荐使用Adagrasib(2A类)。
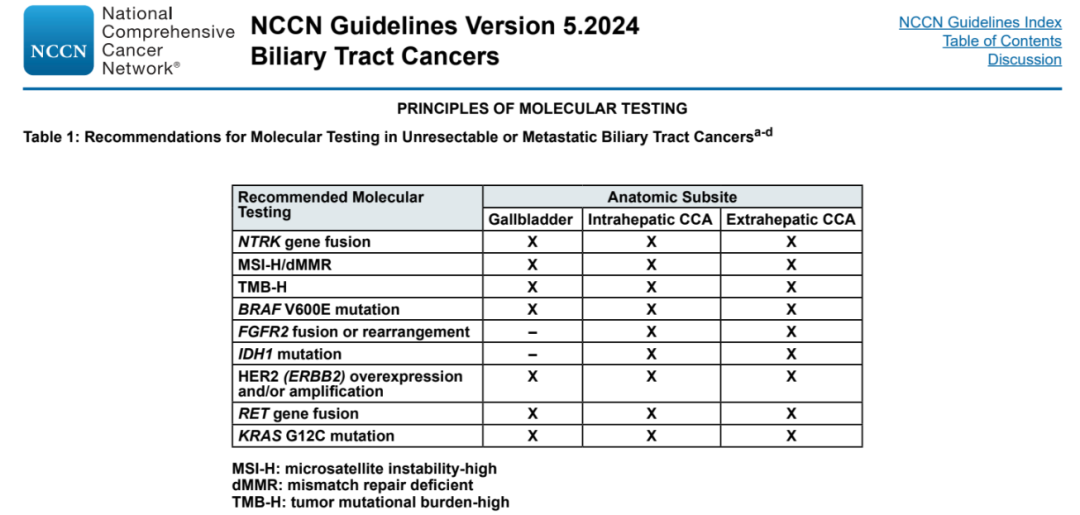
2024年第2版中,HER2阳性BTC二线治疗新增推荐了德曲妥珠单抗用于IHC3+患者(2A类)。2024年第3版中,NTRK融合阳性BTC一线治疗新增推荐了Repotrectinib(2A类),也可用于二线及后线治疗。2024年第5版中,HER2阳性BTC二线治疗新增推荐了泽尼达妥单抗用于IHC3+患者(2A类)。
当前,NCCN指南中靶向治疗的阵列已经颇为“热闹”(图1),值得注意的是,艾伏尼布依然是唯一拥有1类证据的推荐药物。

遵循中国规范
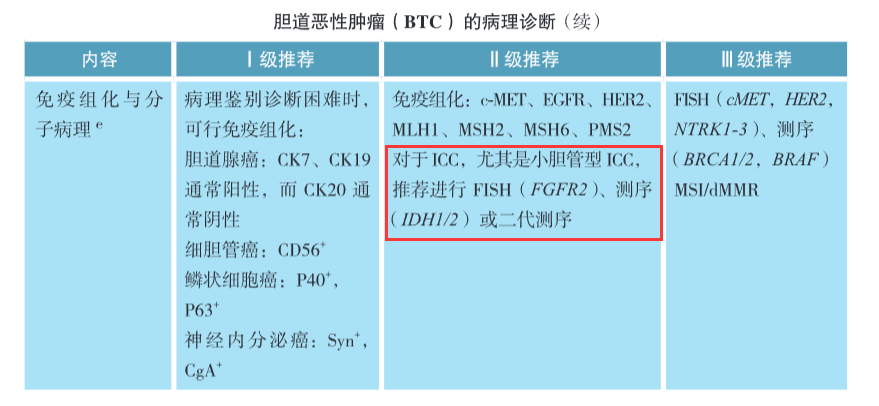
中国临床肿瘤学会(CSCO)2024版《胆道恶性肿瘤诊疗指南》基于国内外循证医学证据、充分结合我国国情,对BTC的分子检测及靶向治疗进行了分级推荐。免疫组化与分子病理诊断的Ⅰ级推荐均为免疫组化鉴别诊断标志物;Ⅱ级推荐中特别强调,“对于ICC,尤其是小胆管型ICC,推荐进行FISH(FGFR2)、测序(IDH1/2)或二代测序”(表3)。
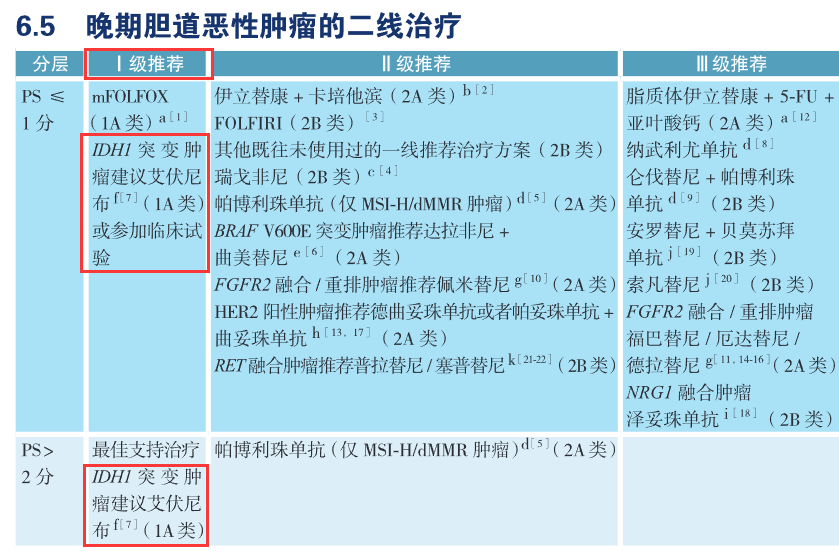
晚期BTC一线靶向治疗中,目前仅有NTRK抑制剂被列入表格(Ⅱ级推荐),Ⅲ级推荐中鼓励符合精准用药条件的所有BTC患者参加临床研究,肯定了一线治疗时即进行基因检测、寻找靶向治疗机会的积极意义。二线靶向治疗中,仅有IDH1抑制剂艾伏尼布被纳入Ⅰ级推荐(1A类证据),Ⅱ级和Ⅲ级推荐涵盖了目前有一定证据的其他可干预靶点(表4)。
 这些融合国内外进展并契合我国国情的指南/共识不仅为临床提供了规范性指引和实践依据,同时也映照了靶向治疗在BTC领域日渐重要的地位。
这些融合国内外进展并契合我国国情的指南/共识不仅为临床提供了规范性指引和实践依据,同时也映照了靶向治疗在BTC领域日渐重要的地位。
“星星之火,可以燎原”
——每个靶点一小步,汇成领域一大步
2024年,尽管多数靶点研究进展有限,但汇集起来,对整个BTC领域而言,依然具有重要意义。
IDH1/2突变:开拓联合策略,深入真实世界
IDH1是目前BTC中变异阳性率最高的靶点之一,如表1中所示,IDH1突变率在中国肝内胆管癌(ICC)患者中约6.5%~20%[3]。基于ClarIDHy研究[4]的出色阳性结果,艾伏尼布开启了全球BTC精准治疗时代。目前,该药物已然向联合治疗探索和真实世界研究迈出了步伐。
多项研究提示了艾伏尼布与免疫治疗、抗血管生成治疗及化疗联合治疗协同增效的潜力与前景,有望进一步提升疗效、延长患者生存期。
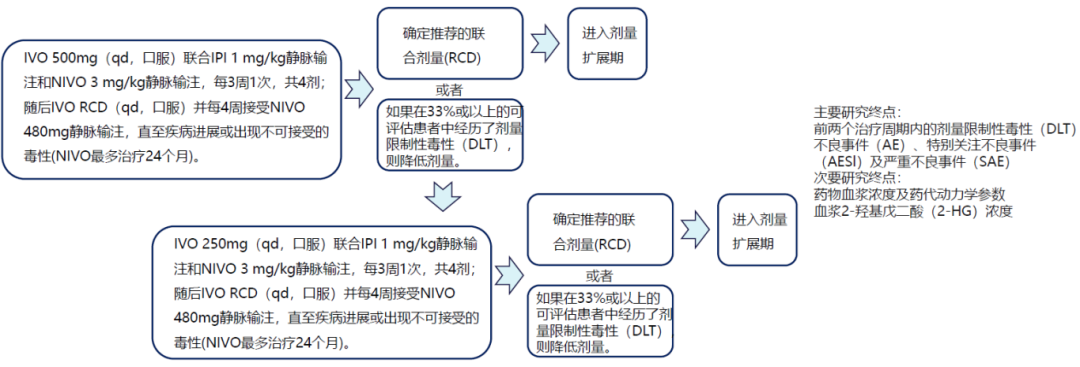
2024年美国临床肿瘤学会(ASCO)年会中公布了一项评估艾伏尼布联合纳武利尤单抗和伊匹木单抗治疗晚期经治IDH1突变胆管癌(CCA)患者疗效和安全性的Ⅰ/Ⅱ期研究的设计[5],分为安全性导入期和剂量扩展期两个部分,具体方案如图2和图3所示。临床前研究已经发现,IDH1抑制剂可通过增加肿瘤免疫细胞浸润来改善肿瘤免疫微环境进而促进肿瘤免疫[6],为其与免疫治疗联合奠定了机制基础;在动物实验中也观察到了艾伏尼布联合CTLA-4抑制剂治疗IDH1突变CCA小鼠模型时具有协同作用,多数小鼠达到了完全缓解。同时,PD-1抑制剂联合CTLA-4抑制剂的“双免”方案也已在晚期CCA患者中显示了较高的抗肿瘤活性。由此,这项Ⅰ/Ⅱ期研究应运而生,期待艾伏尼布加“双免”的“强强组合”能够在IDH1突变晚期CCA患者中验证“1+1+1>3”的协同效应,为临床带来新的突破。

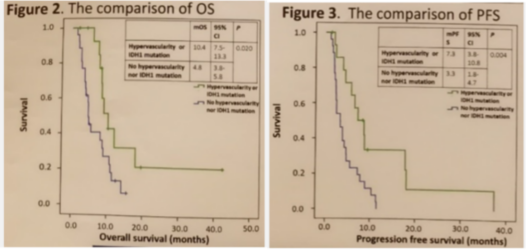
2024年欧洲肿瘤内科学会亚洲年会(ESMO Asia)上,一项回顾性研究分析了仑伐替尼±紫杉类药物二线及以上治疗IDH1突变CCA患者的疗效[7]。中位随访22.9个月,结果显示,与IDH-1野生型(13例)或未知突变状态的乏血供组(26例)患者相比,富血供和(或)IDH-1突变组(15例,其中7例IDH-1突变)患者中位总生存期(OS)(10.4个月vs 4.8个月,P=0.015)和中位无进展生存期(PFS)(7.3个月vs 3.3个月,P=0.004)均显著更长,客观缓解率(ORR)显著更高(46.7% vs 15.4%,P=0.029)。可以看到,仑伐替尼±紫杉类药物在富血供和(或)IDH-1突变患者中获益尤为突出,提示了该方案的优势人群生物标志物,也预示了IDH-1抑制剂与仑伐替尼±紫杉类药物联合治疗IDH-1突变患者协同增效的可期潜力。
真实世界研究可对支持新药上市的关键性临床试验数据进行进一步验证和补充,为临床实践提供更丰富的信息。2024年欧洲肿瘤内科学会(ESMO)年会中,基于真实世界病例的Ⅲb期ProvIDHe研究公布了首次中期分析得到的患者基线特征和分子检测数据[8]。该研究纳入接受过至少一线全身治疗的局部晚期或转移性IDH1突变CCA成年患者,接受艾伏尼布(口服,500mg,一日一次)治疗。主要终点为安全性。
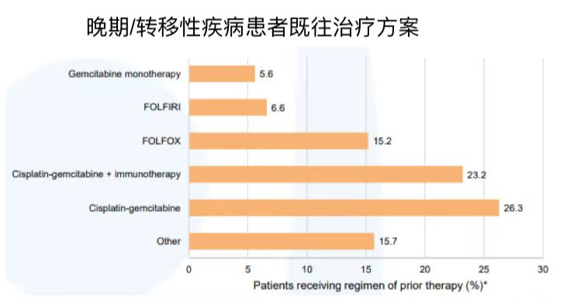
截至2024年2月9日,研究已纳入了来自10个国家的158例患者。基线特征见表5。大多数(84.2%)患者在筛选时年龄<75岁,89.2%为Ⅳ期,72.8%存在肝转移。分子检测方面,95%的患者携带mIDH1 R132突变,其中R132C最常见(64.6%);常见共突变包括PIK3CA(10.8%)、FGFR2(5.7%)、BRAF V600E(3.2%)和MET(3.2%)。既往治疗方案主要为吉西他滨+顺铂(26.3%)单纯化疗或联合免疫治疗(23.2%)(图5)。研究仍在招募患者中,未来分析将聚焦于患者治疗结果。期待后续数据的披露,为临床应用提供更多参考和指导。

FGFR突变:汇总验证获益,描绘BTC新篇
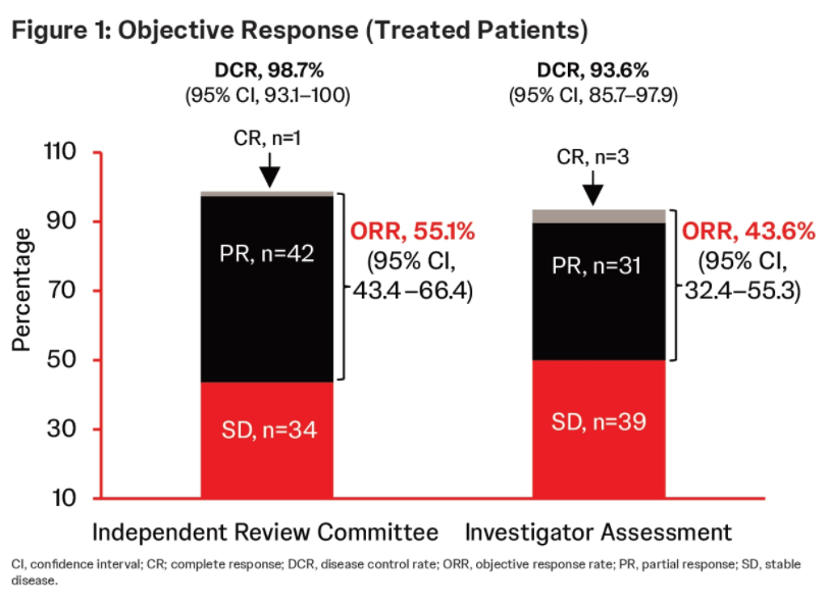
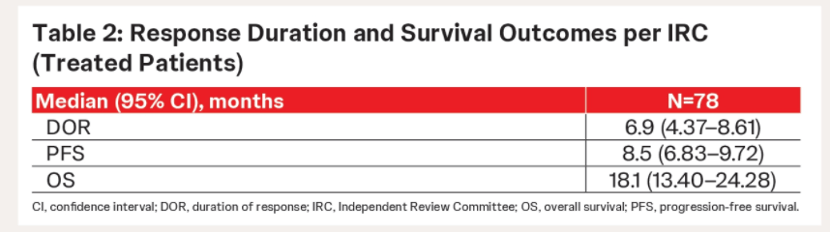
FGFR也是BTC一个重要的治疗靶点,且FGFR抑制剂这一赛道中成员丰富,已有佩米替尼、福巴替尼、厄达替尼和德拉替尼等多款药物。2024 ASCO中,一项基于RAGNAR和LUC2001两项关键性临床试验的汇总分析进一步验证了厄达替尼二线及以上治疗FGFR变异晚期CCA患者的疗效和安全性[9]。共有78例患者纳入分析,中位随访15个月,ORR为55.1%,疾病控制率(DCR)为98.7%,中位PFS和OS分别为8.5个月和18.1个月(图6、7)。厄达替尼的疗效和安全性与既往研究总体一致。
HER2阳性:双抗再添新证,ADC步履不停
抗HER2治疗在越来越多的瘤种中“大显身手”。基于Ⅱb期HERIZON-BTC-01研究,HER2双抗泽尼达妥单抗已被NCCN指南推荐用于HER2阳性(IHC3+)晚期BTC患者二线治疗。2024 ESMO Asia中,该研究公布了亚洲亚组长期随访结果[10]。亚洲队列共50例经治的HER2阳性BTC患者,接受泽尼达妥单抗治疗的ORR为42%,中位PFS为5.5个月,中位OS为13.4个月,安全性与全球人群总体一致,为亚洲临床提供了更多数据支持。
抗体药物偶联物(ADC)是全球肿瘤学的划时代进步。靶向HER2的新一代ADC德曲妥珠单抗在BTC领域的探索亦如火如荼。2024 ESMO Asia中,DESTINY-PanTumor02研究公布了第二部分设计方案[11],将探索德曲妥珠单抗在更广泛HER2表达实体瘤患者中的有效性和安全性。除第一部分所覆盖的瘤种(包括BTC)外,第二部分新增了非小细胞肺癌;同时,HER2表达水平也从IHC 3+或2+扩大至妇科肿瘤中的IHC 1+,丰富了瘤种,也拓展了HER2表达水平范围。期待DESTINY-PanTumor02研究第二部分数据早日传来更多佳音。
Claudin18.2阳性:ADC潜力再显,难治肿瘤重燃希望
晚期胰腺导管腺癌(PDAC)和BTC的预后较差,患者在标准治疗失败后,后续治疗选择有限。Claudin18.2是一种紧密连接蛋白,在多种肿瘤组织中高表达,被认为是潜在的治疗靶点。IBI343是一种ADC,可以特异性地靶向肿瘤细胞并释放药物,提高疗效并降低毒性。
一项Ⅰ期研究报告了IBI343在PDAC和胆管癌BTC患者中的安全性及疗效结果[12]。35名对标准治疗无效或无法耐受的晚期PDAC或BTC患者接受了IBI343治疗,剂量为6mg/kg或8mg/kg每3周一次的静脉注射。截至2024年1月15日,25例患者可进行疗效评估。疗效分析显示,7例患者(5例PDAC和2例BTC)实现部分缓解(PR),ORR为28.0%,DCR为80.0%。对于6mg/kg治疗组中CLDN18.2表达水平≥60%的13例患者,5例患者实现PR,ORR为38.5%,DCR为84.6%。该研究首次评估了IBI343在PDAC和BTC患者中的安全性及有效性,为Claudin18.2阳性患者提供了新的治疗选择。
其余靶点:泛瘤“异病同治”,期待更多突破
NTRK融合、BRAF V600E突变、RET融合、NRG1融合、PTEN表达缺失、POLE/POLD突变、BRCA突变/BAP突变/ATM突变等靶点在2024年尚无更多进展,期待未来在联合治疗、耐药机制探索等方面有新的突破。
专家点评
BTC是肝胆肿瘤乃至整个消化系统肿瘤领域治疗最棘手的瘤种之一。对于占比最大的晚期患者而言,系统治疗是他们延长生存的主要希望。在精准肿瘤学时代的演进中,随着IDH1抑制剂艾伏尼布的突破性成功,靶向治疗的光芒终于照进了BTC领域。“聚沙成塔,集腋成裘”在BTC靶向治疗这里“具象化”了,如今可干预的基因变异阳性率叠加起来已占据了BTC患者近“半壁江山”。因此,前移关口、检测先行是亟需临床医生和患者共同强化的理念。新药“生生不息”,临床试验层出不穷,指南日新月异,基因检测就意味着生存获益的契机。从国内外指南的更新里也可以看到,被推荐检测的靶点日益丰富,可用的靶向药物越来越多。
纵观2024年的进展,作为BTC靶向治疗的“先行者”,艾伏尼布的步伐依然走在领域的前列,已经展开了靶免联合探索和真实世界研究,并从回顾性分析中捕捉更多联合方案的可能性。而这些正是临床实践迫切所需。我们殷切期待新一年里艾伏尼布收获更多积极数据,也期待其未来继续拓展联合模式,比如与介入治疗等局部治疗联合,不断挖掘价值、释放潜力,造福更多患者。FGFR、HER2等靶点的进展同样令人鼓舞,FGFR引领了BTC靶向药的迭代升级,HER2和Claudin18.2则生动演绎了BTC靶向药的多元创新。KRAS G12C也已加入到BTC靶向治疗的阵列。值得强调的是,借鉴于其他瘤种的经验,耐药问题的探索可以尽早提上日程,包括原发和继发耐药,旨在让更多患者更大程度获益。
新的一年,我们期待在更多的新药“篮式”试验结果中看到BTC的“身影”,期待更多的靶向药物出现在NCCN、CSCO指南里,期待更多联合治疗的探索取得成功。相信BTC领域明天会更好!
小结
免疫和靶向治疗开启了晚期BTC治疗的“破冰之旅”,IDH1抑制剂艾伏尼布引领BTC领域迈入了精准诊治时代。IDH1、FGFR、HER2和Claudin18.2等这些2024年进展相对更为丰富的靶点当前探索步伐正契合和代表了精准治疗的前行方向,包括多元化联合治疗、优势人群细分、真实世界研究、耐药机制及克服策略探寻、药物创新研发和迭代升级等。虽然BTC的精准之路走得相对艰难,但从国内外指南/共识的速度和热度可以感受到,当前已经进阶到一个新的时期。总的来说,当下可喜,未来可期!2025年,让我们继续携手,启航新征程、扬帆再出发!
(本文由赵明教授审校)
[1] Banales JM, et al. Nat Rev Gastroenterol Hepatol. 2020 Sep;17(9):557-588.
[2] Ciardiello D, et al. Int J Mol Sci. 2022 Jan 13;23(2):820.
[3] 中国抗癌协会胆道肿瘤专业委员会. 中国实用外科杂志, 2024, 44(9):970-983.
[4] Zhu AX, et al. JAMA Oncol. 2021 Nov 1;7(11):1669-1677.
[5] Robin Kate Kelley, et al. 2024 ASCO, Poster Bd 168b.
[6] Mellinghoff IK, et al. Nat Med. 2023; 29(3): 615-622.
[7] Wen-Chi Wu, et al. 2024 ESMO Asia, Poster 142.
[8] Lorenza Rimassa, et al. 2024 ESMO, Abstract 60P.
[9] 2024 ASCO, Abstract 4121.
[10] Jin Won Kim, et al. 2024 ESMO Asia, 134O.
[11] 2024 ESMO Asia , Abstract 400TiP.
[12] Xianjun Yu, et al. Safety and efficacy of IBI343 (anti-claudin18.2 antibody-drug conjugate) in patients with advanced pancreatic ductal adenocarcinoma or biliary tract cancer: Preliminary results from a phase 1 study. J Clin Oncol 42, 2024 (suppl 16; abstr 3037).
本资料的内容仅作为科学信息参考,并仅用于医疗卫生专业人士间的学术交流之目的,请勿转发或用于任何其他用途。
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


