根据2025年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上公布的Ⅲ期BREAKWATER研究的数据,在携带BRAF V600E突变的转移性结直肠癌(mCRC)患者中,与单用mFOLFOX6相比,康奈非尼(Encorafenib)+西妥昔单抗联合mFOLFOX6(氟尿嘧啶、甲酰四氢叶酸和奥沙利铂)使客观缓解率(ORR)呈现统计学和临床双重意义的改善,ORR分别为60.9%和40.0%。而且,各亚组的ORR获益一致,中位总生存期(OS)尚未达到,但展现出潜在的长期生存获益(摘要号:16)。1月25日ASCO GI公布数据的当天,该研究的全文同步登顶Nature Medicine。


ORR
研究结果显示,康奈非尼+西妥昔单抗+mFOLFOX6组(EC+mFOLFOX6组;n = 110)的客观缓解率(ORR)为60.9%,而mFOLFOX6组(SOC组;n = 110)为40.0%(比值比,2.443;单侧P = 0.0008)。
在EC+mFOLFOX6中,最佳缓解包括完全缓解(CR;2.7%)、部分缓解(PR;58.2%)、疾病稳定(SD;28.2%)、疾病进展(PD;2.7%)、非CR/非PD(2.7%)和不可评价(NE;5.5%)。在SOC组中,相应的发生率分别为1.8%、38.2%、30.9%、3.6%、8.2%和17.3%。

“BREAKWATER研究的数据支持康奈非尼+西妥昔单抗+mFOLFOX6作为BRAF V600E突变mCRC患者的一线治疗新标准,而且这些数据奠定了FDA加速批准的基础。”主要研究者Scott Kopetz教授在介绍数据时说。
2024年12月,FDA已加速批准康奈非尼联合西妥昔单抗和mFOLFOX6用于治疗携带BRAF V600E突变的mCRC患者——包括一线治疗。

BREAKWATER研究设计
BRAF V600E突变发生在8%~12%的mCRC,携带这类突变的患者预后差,对标准化疗耐药,对单用BRAF抑制剂的反应也差。mCRC的BRAF V600E抑制激活了替代的EGFR通路,从而引起BRAF抑制剂单药耐药,先前已有研究证实了同时抑制BRAF和EGFR的治疗价值。基于BEACON研究的结果,康奈非尼(BRAF抑制剂)+西妥昔单抗(EGFR抑制剂)已获批用于既往接受过治疗的BRAF V600E突变型mCRC。
BREAKWATER是一项开放标签的多中心研究,入组了根据当地或中心实验室检测BRAF V600突变的mCRC患者,年龄至少16岁(有的国家是至少18岁),既往未接受过针对转移性疾病的系统治疗,ECOG PS评分为0或1。如果患者既往接受过BRAF或EGFR抑制剂治疗、有症状性脑转移、或携带RAS突变,则将其排除。微卫星高度不稳定(MSI-H)/错配修复缺陷(dMMR)的患者也被排除,但如果是已有的医疗条件使其无法接受免疫检查点抑制剂治疗,则允许入组。
该研究入组了637例患者,以1∶1∶1的比例随机分配接受康奈非尼+西妥昔单抗(EC;n = 158),EC+mFOLFOX6(n = 236),或标准治疗mFOLFOX6(n = 243)。EC组的数据将在以后报告。
按地区(美国/加拿大 vs 欧洲 vs 世界其他地区)和ECOG PS(0 vs 1)对患者进行分层。
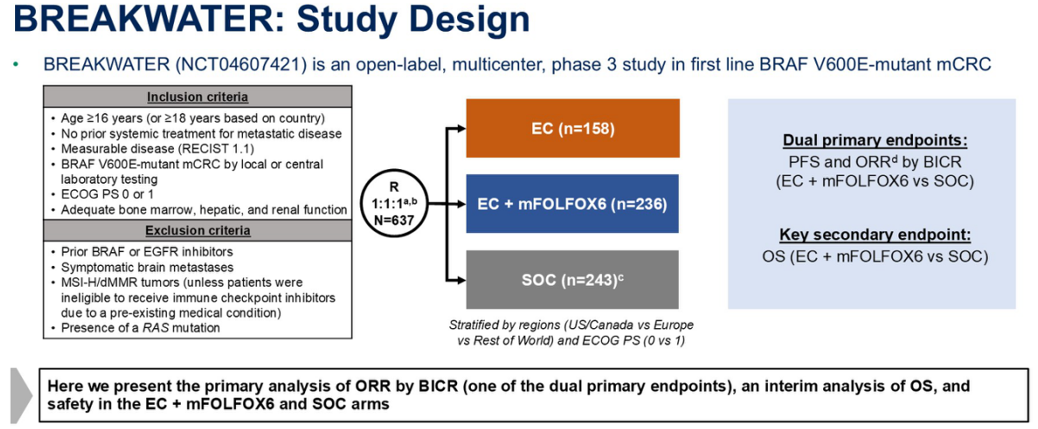
研究设双主要终点:由BICR评估的EC+mFOLFOX6 vs SOC的无进展生存期(PFS)和ORR。值得注意的是,主要终点ORR的评估是在各组入组的前110例患者中进行。总生存期(OS)是关键的次要终点。仅当ORR差异具有统计学显著性时,才检验OS。
此处报告的是EC+ mFOLFOX6和SOC组的双主要终点之一ORR,以及OS、缓解持续时间(DOR)、至缓解时间(TTR)和安全性的首次中期分析。第二个双主要终点PFS是事件驱动的,尚未达到分析所需的事件数量,将在以后报告。
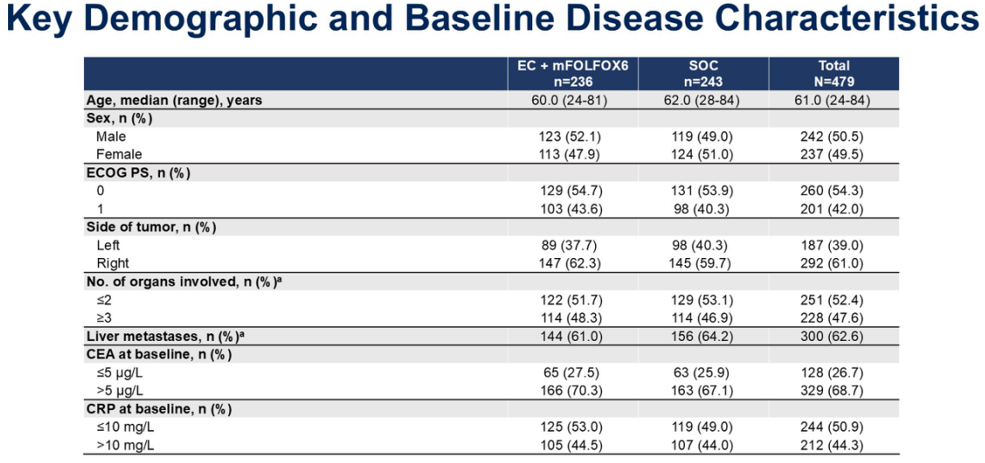
 入组EC+mFOLFOX6组和SOC组的所有患者中(n = 479),中位年龄为61.0岁(范围,24~84岁)。超过半数为男性(50.5%)、ECOG体能状态评分为0(54.3%)、右侧肿瘤(61.0%)、累及2个或更少器官(52.4%)、肝转移(62.6%)、癌胚抗原水平超过5 µg/L(68.7%)、C反应蛋白水平不超过10 mg/L(50.9%)。
入组EC+mFOLFOX6组和SOC组的所有患者中(n = 479),中位年龄为61.0岁(范围,24~84岁)。超过半数为男性(50.5%)、ECOG体能状态评分为0(54.3%)、右侧肿瘤(61.0%)、累及2个或更少器官(52.4%)、肝转移(62.6%)、癌胚抗原水平超过5 µg/L(68.7%)、C反应蛋白水平不超过10 mg/L(50.9%)。
EC+mFOLFOX6组的中位治疗持续时间为28.1周(范围,1.3 ~107.4周),SOC组为20.4周(范围,1.1~98.3周)。两组的所有患者均被随机分配,但分别有2. 1%和5. 8%的患者未接受治疗。
截至2023年12月22日,EC+mFOLFOX6组中58.1%的患者仍在接受治疗。停药原因包括不良事件(AE;4.7%)、死亡(3.4%)、PD(20.8%)、患者退出(5.5%)、整体健康状况恶化(3.4%)和其他(4.2%)。在mFOLFOX6 组中,33.7%的患者在数据截止日期时仍在接受治疗。停药原因包括AE(9.1%)、死亡(4.1%)、PD(31.7%)、患者退出(11.5%)、总体健康状况恶化(1.6%)和其他(8.2%)。
其他疗效和安全性数据
EC+mFOLFOX6组和SOC组的中位TTR为7.1周(范围,5.7~53.7周),化疗组为7.3周(范围,5.4~48.0周)。估计的中位DOR分别为13.9个月(范围,8.5个月~ NE)和11.1个月(范围,6.7~12.7个月)。在EC+mFOLFOX6组中,6个月和12个月的DOR率分别为68.7%和22.4%。在SOC组中,分别为34.1%和11.4%。
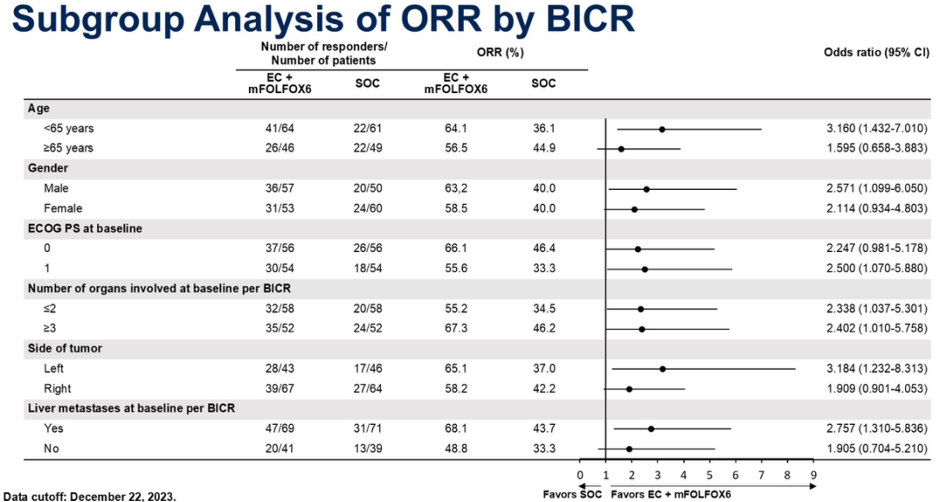
亚组分析显示,EC+FOLFOX6所有亚组ORR均一致性获益。
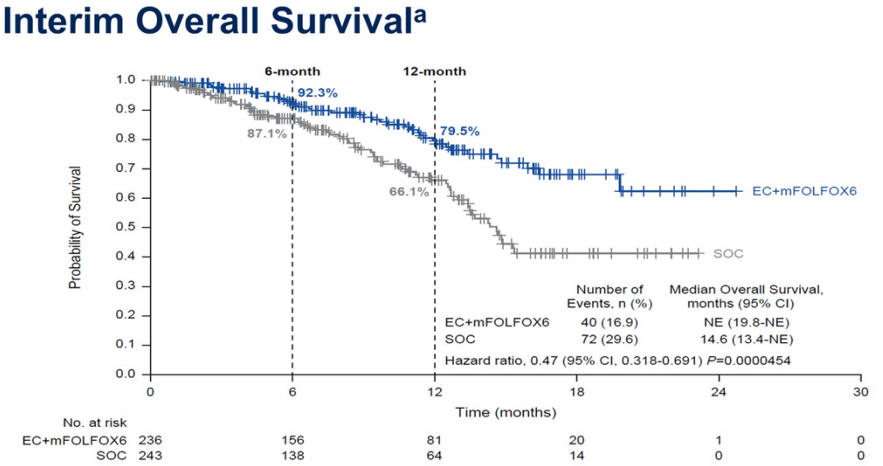
OS的中位随访时间在EC+mFOLFOX组为10.3个月,SOC组为9.8个月。中位OS分别为NE vs 14.6个月(HR,0.47;P = 0.0000454)。此次OS分析为中期分析,数据尚不成熟,OS差异未达到统计学显著性(预设的单侧P值为0.000000083)。
关于安全性,3/4级治疗期间不良事件(TEAE)发生率在EC+mFOLFOX组和SOC组分别为74.0%和61.0%。5级TEAE发生率分别为4.3%和4.4%。严重的TEAE发生率分别为37.7%和34.6%。
两组3/4级治疗相关不良事件(TRAE)的发生率分别为69.7%和53.9%。5级TRAE发生率分别为0%和0.4%,严重TRAE发生率分别为18.2%和19.3%。 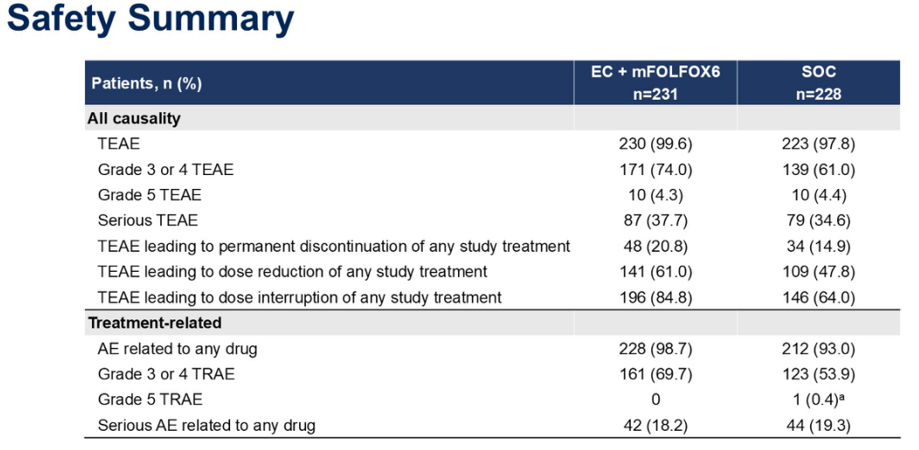
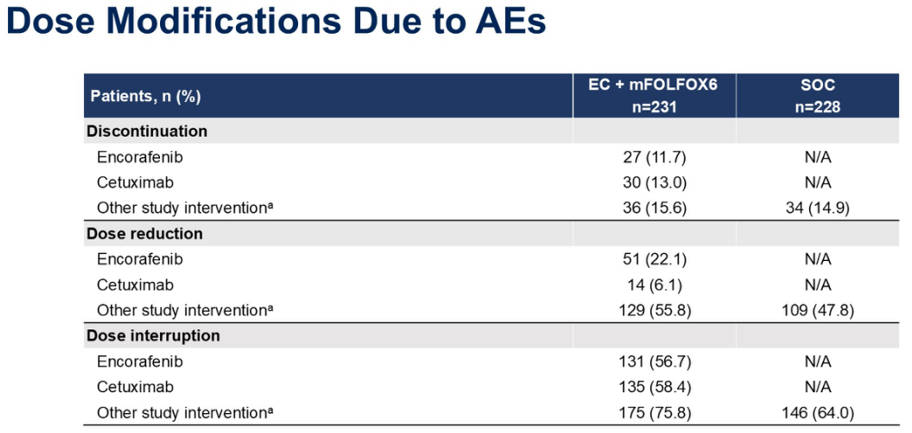
在EC+mFOLFOX6组和SOC组中,分别有20. 8%、61. 0%和84. 8%的患者发生导致永久性停止任何治疗、任何治疗剂量降低和任何治疗剂量中断的TEAE。SOC组的这些发生率分别为14.9%、47.8%和64.0%。
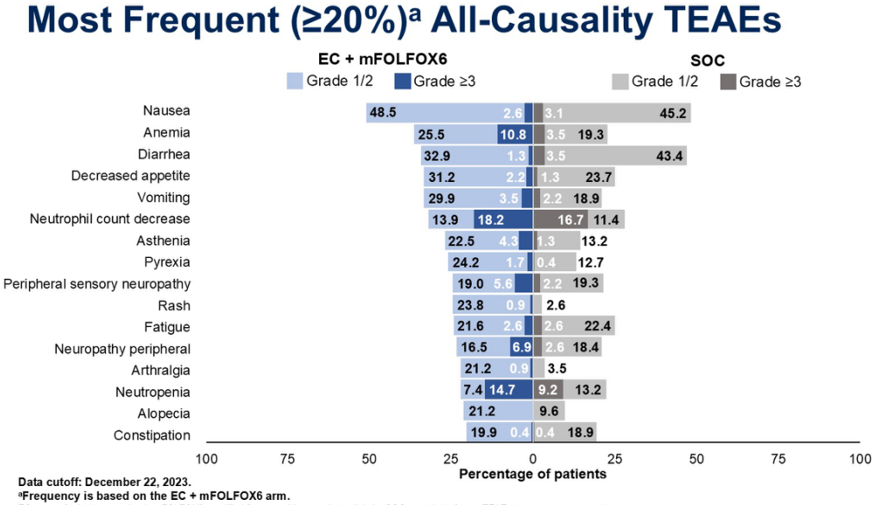
两组最常见TEAE如下。
总之,BREAKWATER研究表明,在BRAF V600E突变mCRC患者的一线治疗中,EC+mFOLFOX6较mFOLFOX6治疗的ORR显著提高,反应迅速且持久;OS数据尚不成熟,但有改善的趋势。EC+mFOLFOX的毒性可控,与SOC相比,因AE导致的化疗减量或终止未明显增加,无新的安全性信号出现。研究结果支持EC+mFOLFOX6作为BRAF V600E突变mCRC的一线治疗新标准。
[1] Kopetz S, Yoshino T, Van Cutsem E, et al. BREAKWATER: Analysis of first-line encorafenib + cetuximab + chemotherapy in BRAF V600E-mutant metastatic colorectal cancer. J Clin Oncol. 2025;43(supp 4):16. doi:10.1200/JCO.2025.43.4_suppl.16
[2] FDA grants accelerated approval to encorafenib with cetuximab and mFOLFOX6 for metastatic colorectal cancer with a BRAF V600E mutation. FDA. December 20, 2024. Accessed January 25, 2024. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-encorafenib-cetuximab-and-mfolfox6-metastatic-colorectal-cancer-braf
排版编辑:Linda











 苏公网安备32059002004080号
苏公网安备32059002004080号


