欧洲白血病网络(ELN)遗传学风险分层已广泛应用于临床实践和试验。现有分层方法完全基于接受强化化疗患者的数据,不适用于老年和/或不适合强化化疗的患者。使用ELN 2017或2022风险分层对接受低强度化疗的老年患者进行预后验证,结果并不理想,因此,迫切需要一种新的风险分层方法,用于对接受去甲基化药物(HMA)单药治疗、维奈克拉(VEN)、阿扎胞苷(AZA)和IDH1抑制剂艾伏尼布(IVO)联合治疗的急性髓系白血病(AML)患者进行更为准确的预后分层1。今年8月份欧洲白血病网络(ELN)推出了“低强度治疗的成人急性髓系白血病遗传学风险分层:2024 ELN 建议”发表于Blood期刊1,中国医学科学院血液病医院王建祥教授参与了共识的制定编写,本期特别邀请到王教授就共识内容进行解读。
专家简介
中国医学科学院血液病医院(中国医学科学院血液学研究所)临床首席专家
国家血液系统疾病临床医学研究中心主任
中国医学科学院北京协和医学院首批长聘教授
国家百千万人才工程国家级人选
中华医学会血液学分会第十届主任委员
中国医师协会内科医师分会副会长、血液科医师分会副会长等职务
天津授衔专家、海河医学学者、首届天津名医、获天津市“十佳”医务工作者、“中国好医生”月度人物
从事血液病临床与基础工作多年,对各种血液病的诊治具有丰富的临床经验,现主要从事白血病及血液肿瘤的临床与基础研究。
原文中文译文
去甲基化药物单药治疗
关于基因组因素对去甲基化药物(HMA)单药治疗患者预后的影响。一项Ⅲ期临床试验评估了患者接受阿扎胞苷(AZA)或标准治疗的疗效,AZA治疗的高风险组患者死亡风险降低了31-46%。然而,基因突变分析仅在三分之一的患者中可用,且结果尚无定论。
最近发表的一项随机临床试验对604例AML患者进行了分析,评估了Guadecitabine对比AZA或地西他滨(DEC)或低剂量阿糖胞苷(LDAC)的疗效。结果显示, ELN 2017 或2022风险分类在预测临床结局方面效果不佳。通过重塑分析和多变量分析,根据三个基因的基因组状态,确定了三个不同的预后风险组:伴DDX41突变为低风险组(胚系占61%病例),伴FLT3-ITD或TP53 突变为高风险组,不表达DDX41突变、FLT3-ITD和TP53突变为中风险组。
去甲基化药物联合维奈克拉
基因组因素对HMA/VEN治疗的缓解及生存结局影响的研究数量在增加。与HMA单药治疗的研究相似,一项(Ⅰb期和Ⅲ期试验中接受AZA/VEN治疗的279例患者)汇集分析显示,无论2017版还是2022版ELN风险分类法均未能明确患者的预后分层。基于生物信息学方法进行的再分析描述了基于四种基因的三个新风险组:伴TP53WT,KRAS/NRASWT,FLT3-ITDneg的较高治疗获益组(52%的患者);伴随FLT3-ITDneg和/或KRASmut 和/或NRASmut的中等治疗获益组(25.4%)以及仅伴随TP53mut的低治疗获益组(22.6%)。三个风险组的中位总生存期分别为26.5个月、12.1个月和5.5个月。有报道显示TP53mut或FLT3-ITDpos对AZA/VEN治疗的预后影响为不良,其在改善生存率方面并不优于AZA单药。重要的是,最近一项入组了159例患者(HMA/VEN治疗)的单中心研究完成了对这四个基因预后作用的外部验证。
在这些新定义的高获益组和中获益组中,最常见的国际共识分类(ICC)疾病是伴MDS相关基因突变的AML (对应于WHO第5版分类中骨髓增生异常相关AML),其次是AML伴NPM1突变,以及AML-NOS。在伴NPM1或IDH2突变的AML患者中,探索性分析发现信号基因共突变(FLT3-ITDpos, KRASmut, NRASmut)对预后具有负面影响,这与它们作为维奈克拉耐药介质的生物学作用相一致。例如,无信号基因突变的NPM1mut, AML的中位OS为39个月,而同时伴有FLT3-ITDpos、KRASmut和/或NRASmut AML的中位OS仅9.9个月。当伴或不伴激活的激酶致病性变异时,相似的趋势在IDH2mut (中位OS, 36.9个月vs 12.2个月)、RUNX1mut(32.5个月vs 9.3个月)以及合并MR基因突变的AML (22.9个月vs 12.9个月)中均可发现。
DDX41突变在接受HMA治疗的患者中确定为是一个预后极其有利的风险组,类似地,最近的两项研究报道了伴DDX41mutAML患者接受AZA/VEN治疗的高缓解率及良好的预后。伴DDX41mut AML在HMA单药治疗后2年OS率60.1%(中位OS为27.8个月),而在含HMA+VEN方案治疗后2年OS率为91.1%(中位OS未达到)。
阿扎胞苷联合艾伏尼布
一项随机Ⅲ期研究确定了AZA/IVO是IDH1mutAML患者的新治疗标准(New treatment standard),与AZA/PBO相比,AZA/IVO的OS更长(24.0个月vs. 7.9个月)。随着更长期的随访,AZA/IVO的中位OS延长至29.3个月。这与接受AZA/VEN治疗的IDH1mut患者(10.2个月)相比更长,但应谨慎解释这种跨试验数据比较。通常与IDH1共突变的基因包括DNMT3A、SRSF2和RUNX1。Ad hoc亚组分析表明,AZA/IVO治疗在IDH1mut AML患者中获得了良好的结果,即使与上述基因或受体酪氨酸激酶突变同时发生。所以基于现有可用数据,在接受AZA/IVO治疗的前提下把所有IDH1mut AML患者归类为预后良好是合适的。”1
王建祥教授:自1996年起,在研究AML发病机制中陆续发现了许多基因突变,如FLT3-ITD、NPM1、IDH1等,从而认识到更多的遗传学异常的AML种类。2016年WHO 造血和淋巴系统肿瘤分型修订版发表。在AML分型中,逐渐凸显出以疾病生物学性质,包括遗传学异常为驱动的分型模式,AML伴NPM1突变、AML伴CEBPA突变正式列入AML的类型。既往的欧洲白血病网络(ELN)遗传风险分层是基于接受强化疗的年轻患者数据制定的。最新数据促使ELN提出了针对接受低强度治疗患者的遗传风险分层建议。FLT3-ITDpos, NRASmut, KRASmut,TP53是认识较为广泛的中等或不良预后因素,但是IDH1突变对预后的影响既往一直存在争议,一方面是IDH1突变与白血病的关联在2009年才被发现,到现在不足15年,相关研究数据较少;另一方面,多种因素对分析IDH1突变与AML预后的关系造成混淆,如患者年龄,共突变,特定的IDH1突变亚型体,研究设计,尤其是IDH1和IDH2突变共分析对预后的判断造成困扰2-8。Qingyu Xu等人的一项Meta分析9纳入了33项来自欧洲, 澳大利亚, 亚洲和美洲临床研究,分析的患者数目为12,747例病例。入组的不同研究中AML患者IDH1突变频率为2.02%~ 9.30%,结果显示,当IDH1&2组合分析时,突变不影响总生存期和无事件生存期,当IDH1突变拆分出来单独分析时,总生存期和无事件生存期显著更差,所以近来高级别证据倾向于将IDH1mut归类为对AML预后有不良影响的突变(前IDH1突变抑制剂时代),在IDH1抑制剂时代,得益于大幅度增加的生存期,将IDH1归类继续归类为不良预后因素已然不再合适,所以本次共识制定时,特别强调IDH1突变为预后后良好,但前提是“仅适用于艾伏尼布联合阿扎胞苷治疗的情况下”。当前急性髓系白血病的靶向药物种类有限,此次针对IDH1突变的微小调整反映了ELN指南共识制定与时俱进,凸显了精准诊断/治疗是AML治疗的趋势所在。
原文中文译文
遗传风险分类
表1概述了接受低强度HMA治疗的ELN遗传学风险分层框架(2024版ELN 低强度治疗) 。2024版ELN低强度遗传学风险分层适用于接受HMA单药治疗、 HMA/VEN或AZA/IVO(用于IDH1mut AML)的患者。对于低风险患者,中位OS长于24个月为低风险患者;范围在5-8个月之间为高风险患者,其余患者则被归为中风险。表2列出了所选基因组亚组报告的生存期。
表1:适用于接受低强度治疗的ELN危险分类(ELN 2024 Less-Intensive)
注意:不适用于既往接受过HMA治疗的患者
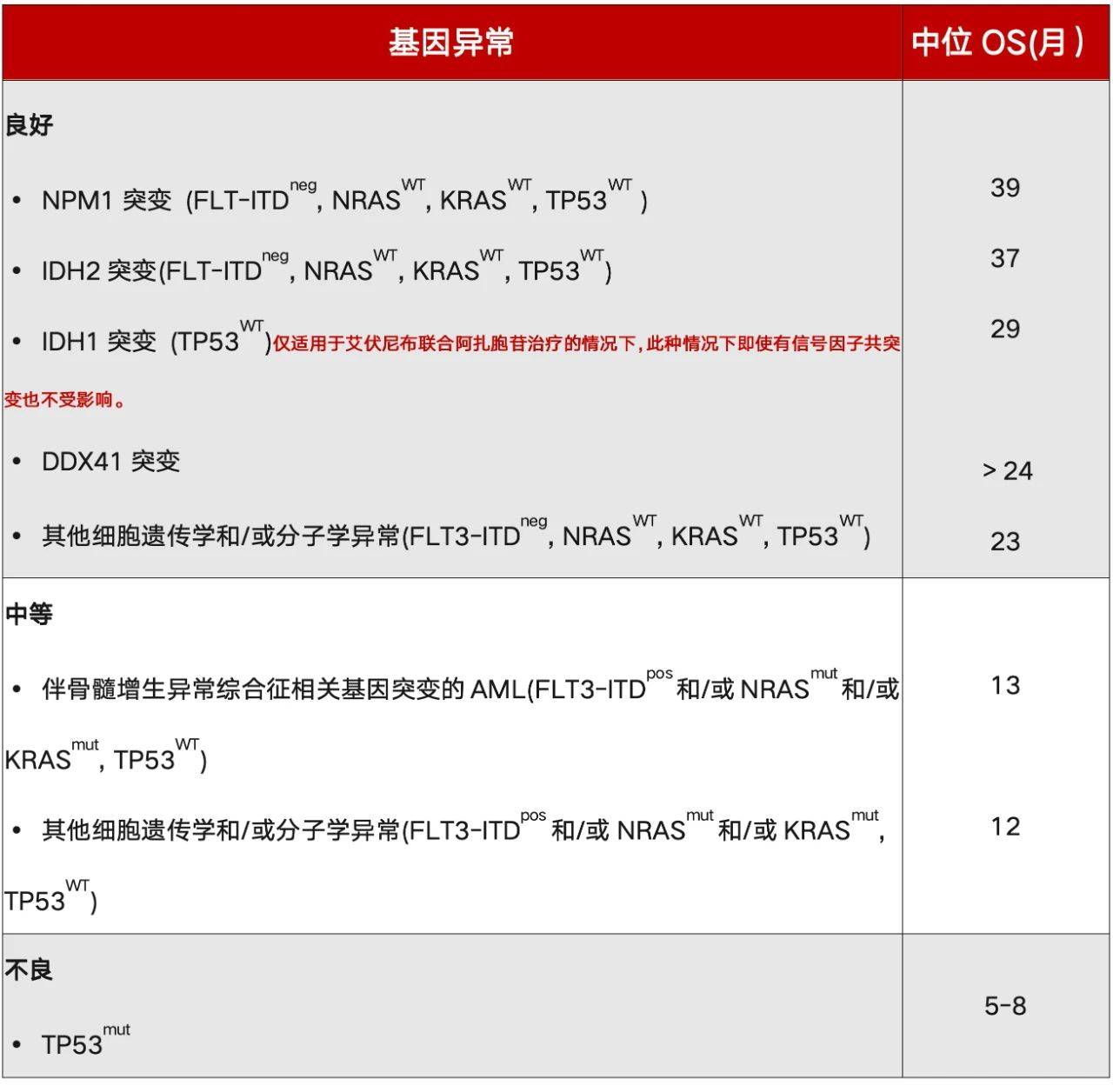
尽管NPM1mut或IDH2mut AML患者似乎对VEN治疗敏感,但有利的临床结果似乎仅限于缺失激活信号基因共突变的病例。DDX41mut(2/3胚系起源)在HMA单药或基于VEN的联合治疗后,越来越多地与AML的有利结局相关。最后,所有IDH1mut 患者在AZA/IVO治疗后都有良好的预后。
TP53mut普遍与不良临床风险相关,HMA单药或联合VEN治疗预后均较差。在大多数(80-90%)TP53mut病例中存在复杂的核型。虽然使用AZA/VEN治疗不伴TP53mut的细胞遗传学不良风险AML的中位OS为23.4个月,但需要在低强度治疗环境下进行进一步的验证性研究。
根据国际分类标准(ICC)定义的具有MR突变的AML已经确立了其对于继发性AML的特异性。近期的一项研究表明,AML和伴MR突变的(AML)对HMA/VEN特别敏感;与其他报道一致,剪接因子变异或ASXL1突变与HMA/VEN治疗预后改善有关。然而, 即使在这一类患者中,信号基因共突变也与不良预后相关。
对2024年ELN低强度AML分类的这次迭代是基于目前可用的低强度治疗患者的基因数据,这些数据仍然有限。对于具有特定基因重排(如易位,倒置)的AML亚组,由于其在老年患者中罕见,导致缺乏可用数据,因此不可能表征其对预后的影响。目前的分类对于既往患有骨髓增生性肿瘤或既往接受过HMA治疗的患者的相关性也有限,包括既往患有骨髓增生异常综合征后的AML,因为此类患者通常被排除在维奈克拉治疗AML的临床试验之外。在含LDAC/VEN治疗方案和基因组相关结果方面,我们没有在目前的ELN分类中纳入具体建议,因为这些分析尚未发表。
2022版ELN的建议还强调了可测量残留疾病(MRD)评估在综合风险评估中的作用,这已成为强化化疗患者管理中不可或缺的一部分。在接受含HMA方案治疗的患者中,MRD数据刚刚兴起,这表明MRD监测在预测预后方面也起着重要的补充作用。
认识到其局限性,本次ELN遗传学风险分层为接受低强度治疗患者的共识性分层提供了依据。在未来的临床试验以及大型真实世界数据集中验证2024版ELN低强度风险分类建议将非常重要。随着老年/unfit患者治疗前景的不断发展(如,FLT3和menin抑制剂治疗的引入),预计这种分类将持续迭代细化。”1
王建祥教授:本次ELN共识在制定时具有明确的的预后分组标准,中位生存期长于24个月为低风险;5-8个月之间为高风险,其余患者则被归为中风险。这有助于解决不同治疗方案中“IDH1预后争议”这一问题。MD安德森癌症中心的一项回顾性研究10纳入了2012年1月至2021年10月期间563名接受治疗的初治AML成人患者,其中IDH1突变患者119例,中位随访36.9个月,研究发现强化疗或者低强度化疗治疗初治 fit & unfit IDH1mut AML 的生存期为12.6个月;VIALE-A是一项随机、双盲、安慰剂对照的多中心3期临床研究11,共入组431例未经治疗的unfit AML患者,入组IDH1突变患者34例,随机接受VEN联合AZA(n=23)或AZA单药(n=11)治疗,中位随访43.2个月,VEN+AZA治疗初治unfit IDH1mut AML 的生存期为10.2个月。我国的一项数据显示化疗±VEN治疗中国初治>60岁 IDH1mutAML 的生存期为9个月12. 所以前IDH1抑制剂时代,可以视IDH1突变是AML预后的不良因素。2022年AGILE研究结果发表于NEJM期刊,2023年在ASCO13上做了数据更新,入组患者随机分配接受艾伏尼布联合AZA(n=73)或AZA单药(n=75) 治疗,中位随访28.6个月,艾伏尼布联合AZA治疗初治unfit IDH1mut AML 的生存期为29.3个月. 并且在RTK信号通路,DNMT3A,RUNX1,SRSF2共突变存在的情况下,依然观察到显著的生存获益14, 所以本次ELN共识制定时,严格强调IDH1突变被划分为预后良好仅适用于艾伏尼布联合阿扎胞苷治疗的情况下,此种情况下即使有信号因子共突变也不受影响。
急性髓系白血病的风险分层历经多年的发展,从细胞遗传学,到联合分子遗传学,急性髓系白血病的分层更加精准,并得到临床应用,本次ELN遗传学风险分层共识的制定是对AML既往分层的有力补充,对指导临床实践具有重要意义。
本内容仅供临床医生交流使用,不用做药品推广
本文转自:CCMTV
1.Blood. 2024 Aug 12: blood.2024025409
2. Haematologica. 2010;95(10):1668—1674
3. Leukemia. 2016;30(4):980-984
4. Leukemia. 2017;31(2):272-281
5. PLoS ONE. 2014;9(6):e100206
6. Blood Adv. 2023 Oct 10;7(19):5941-5953
7. Blood. 2021;137(20):2827-2837
8. Blood Adv. 2022;6(5):1394-1405
9. Clin Cancer Res (2017) 23 (15): 4511–4522
10. Am J Hematol. 2022 Nov;97(11):1443-1452.
11. Am J Hematol. 2024 Apr;99(4):615-624.
12. 苏晓慧. 吉林:吉林大学,2022
13. 2023 ASCO Annual Meeting, Abstract 7012
14. 2022 ASCO Annual Meeting, Poster P250
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


