胆管癌(CCA)发病率在全球范围内呈上升趋势[1],治疗仍极具挑战。手术是CCA唯一的根治性治疗方法,但即使是接受了根治术及辅助化疗的CCA患者,术后复发风险依然很高。多数患者确诊时已为晚期,失去了手术根治机会,既往主要依赖于化疗,但疗效有限。当前CCA总体5年生存率不足10%[2-4],迫切需要新的疗法改善预后。高通量基因测序技术的出现极大提高了学术界对癌症分子生物学基础的认识,为肿瘤相关突变基因的发掘及其新型靶向治疗的开发开辟了新的治疗路径。CCA领域也乘着精准医学的“东风”稳步前进。
为此,本期特邀中山大学肿瘤防治中心王风华教授解读两篇近期发表的胆道恶性肿瘤分子病理机制及精准治疗相关综述[5-6],并结合国内外权威指南对分子检测及靶向治疗的最新推荐,系统梳理领域现状与未来,与广大读者共享进展、共鉴方向。
专家简介
肿瘤内科主任医师,博士导师,博士
中国抗癌协会肿瘤靶向治疗专委会副主委
中国抗癌协会肿瘤支持专业委员会副主委
中国抗癌协会肿瘤临床化疗专业委员会委员
中国临床肿瘤协会胃癌专业委员会常委兼秘书;
中国临床肿瘤协会胰腺癌专业委员会委员
广东省抗癌协会肿瘤靶向治疗专委会副主委
广东省抗癌协会胰腺癌专业委员会副主委
“为何而来?”
多达40%的CCA患者携带潜在可干预的基因变异
据估计,多达40%的CCA患者携带潜在可干预的基因变异,靶向治疗是改善预后极具潜力的疗法。Gilbert TM等[5]发表的这篇综述中,作者首先从基因变异、表观遗传学异常、信号通路异常、肿瘤微环境四大方面展开阐释了CCA的分子发病机制。其中基因变异是目前进展最为丰富的领域之一。
采用二代测序(NGS)进行深度分子分型极大促进了学术界对CCA关键基因突变基础的理解。CCA位于与中度肿瘤突变负荷(TMB)相关的癌症突变谱的中间位置,只有小部分患者(2%~3%)会出现TMB-H。所有类型CCA最常见的基因突变包括TP53(42.7%)、ARID1A(21.7%)、KRAS(15.7%)、IDH1(8.7%)、CDKN2A(7.8%)、BAP1(6.7%)、SMAD4(6.5%)和PIK3CA(6.0%)。重要的是,研究表明肝内胆管癌(iCCA)和肝外胆管癌(eCCA)的分子特征存在差异,即使是同一种基因突变,在两者中的阳性率也不同(如图1所示),其中IDH1/2在iCCA中的突变率高达10%~30%,而eCCA中约为3%~7%。此外,近期研究还发现,即使同为eCCA,近肝门型和远端型的分子特征存在微小差异。
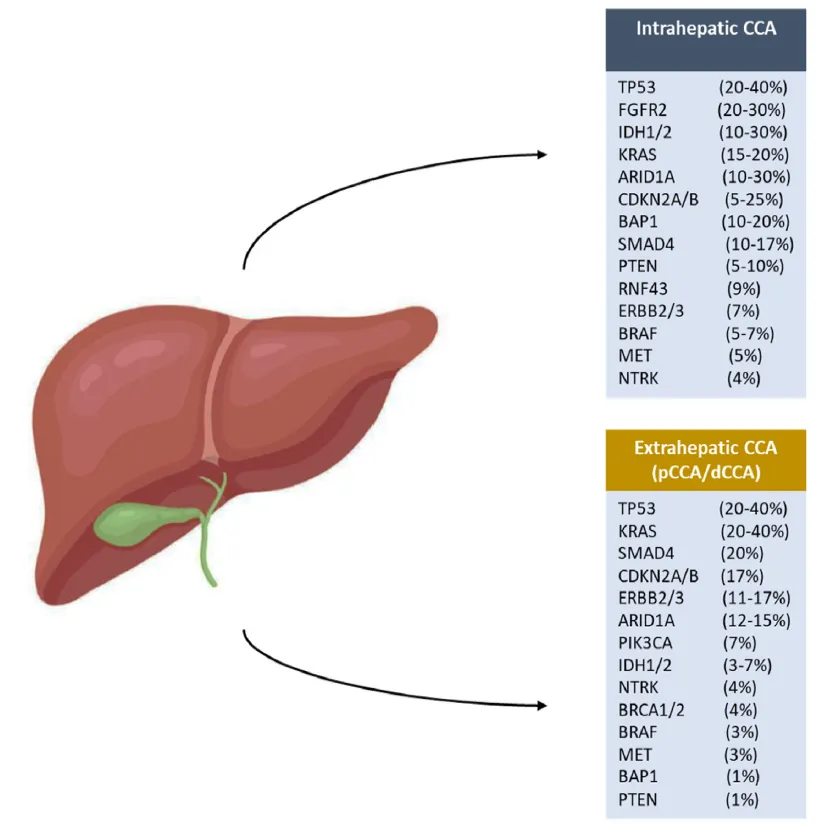
图1 肝内及肝外胆管癌中常见基因突变的频率
(来源:Eur J Surg Oncol,2024 Apr 17:108352.)
对于CCA的靶向治疗,作者谈到了IDH1/2、FGFR、EGFR/HER2、BRAF/MEK、DDR通路、MMR/TMB、NTRK等靶点的可及药物。目前全球范围内已有3种靶向药物被获批用于CCA治疗,包括艾伏尼布(针对IDH1突变)、Infigratinib和佩米替尼(针对FGFR2融合突变)。IDH1/2是重要的代谢酶,催化异柠檬酸转化为α-酮戊二酸(α-KG)(见图2)。IDH1/2突变在iCCA中相对多见,90%左右为IDH1突变。突变的IDH1和IDH2后续会将α-KG转化为D-2-羟戊二酸(D-2HG),而D-2HG是一种通过改变DNA甲基化和激活VEGF等多种机制促进肿瘤增殖和转移的致癌代谢物。这一过程可通过使用IDH抑制剂(如艾伏尼布)来阻断。
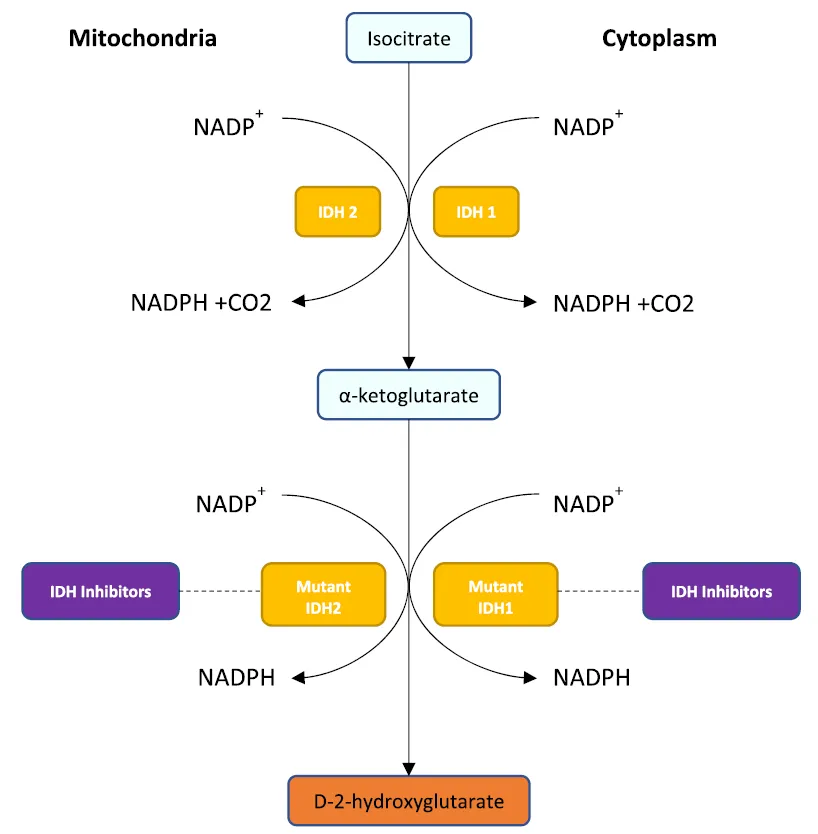
图2 IDH1和IDH2介导的异柠檬酸转化为α-酮戊二酸的示意图,以及由突变的IDH1和IDH2酶引起的致癌代谢物2-羟基戊二酸(2-HG)的病理积累。 IDH1位于细胞质中,而IDH2位于线粒体中。
(来源:Eur J Surg Oncol,2024 Apr 17:108352.)
艾伏尼布是一款靶向IDH1的小分子抑制剂,也是首个针对IDH1酶的口服靶向药物。为进一步掌握艾伏尼布抑制肿瘤的作用机制,有研究对艾伏尼布一期临床研究中30例患者的治疗前后活检标本进行RNA分析[7]。结果显示,艾伏尼布上调最显著的前5个基因与肝脏分化和代谢相关,如HNF-4α的表达。在无进展生存期(PFS)较好的患者中,肝细胞特异性基因的表达显著增加,并伴有胆道谱系基因下调。这一结果或提示艾伏尼布可通过诱导分化来发挥抗癌作用。
基于Ⅲ期多中心随机对照ClarIDHy研究的阳性结果,艾伏尼布被FDA及EMA批准用于治疗IDH1突变的晚期CCA经治患者。该研究共纳入了187例IDH1突变的化疗失败的晚期CCA患者,与安慰剂组相比,艾伏尼布组无进展生存期(PFS)显著改善[2.7个月 vs 1.4个月,风险比(HR)=0.37,P<0.0001];尽管安慰剂组多达70%的患者交叉接受了艾伏尼布治疗,但艾伏尼布组的总生存期(OS)在数值上仍优于安慰剂组(10.3个月vs 7.5个月,HR=0.79,P=0.09),且校正交叉治疗因素后,这一优势具有显著的统计学差异(安慰剂组OS为5.1个月,HR=0.49,P<0.001),确证了艾伏尼布改善生存的价值。
“走到了哪里?”
分子检测和靶向治疗地位不断升级
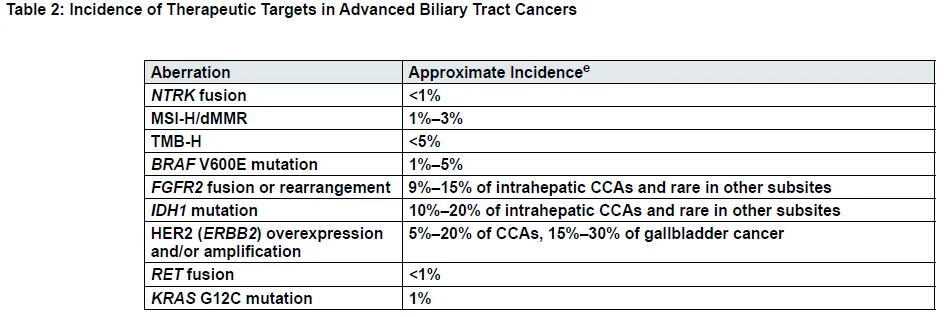
“精准治疗,检测先行”已成为精准肿瘤学时代的“金科玉律”。王教授指出,随着CCA靶向和免疫治疗研究证据的积累,美国国立综合癌症网络(NCCN)、中国临床肿瘤学会(CSCO)等国内外权威指南对于其分子检测的种类推荐日渐丰富、推荐力度日渐增强。在最新的CSCO指南[8]中,除Ⅰ级推荐的免疫组化检测标志物以外,Ⅱ级推荐还建议检测c-MET、EGFR、HER2、MLH1、MSH2、MSH6、PMS2,对于iCCA推荐进行 FISH(FGFR2)、测序(IDH1/2)和二代测序;Ⅲ级推荐包括FISH(cMET、HER2、NTRK1-3)、测序(BRCA1/2、BRAF)和MSI/dMMR。2024年4月19日“新鲜出炉”的2024年第2版NCCN胆道癌临床实践指南[9]中,“分子检测原则”部分,推荐对无法手术切除或转移性胆管癌患者进行全面的分子检测(见表1和表2),以确定其是否适合系统治疗,包括表1列出靶点在内的全面检测可能最大程度地提高发现可靶向治疗基因变异的机会。
表1 推荐对无法手术切除或转移性胆道癌进行分子检测[8]
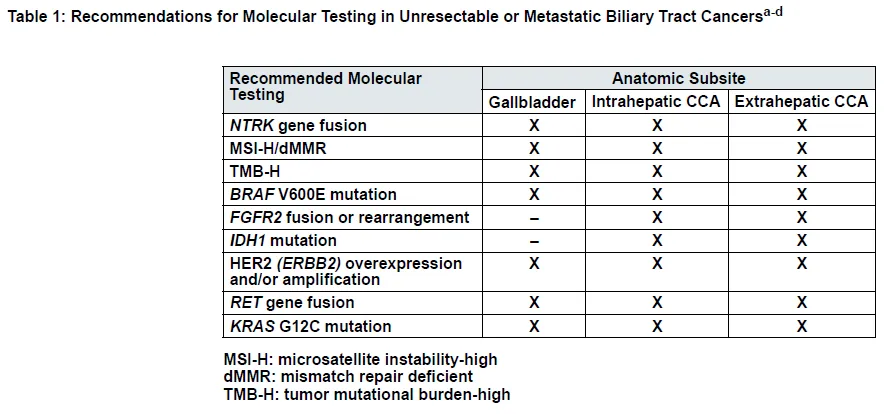
表2 晚期胆道癌治疗靶点阳性率[8]
靶向治疗部分,2023 CSCO指南(图3)中,两种TRK抑制剂已获得一线治疗Ⅱ级推荐用于NTRK融合阳性患者;艾伏尼布已成为IDH1突变患者二线治疗1A类证据、Ⅰ级推荐的方案,Ⅱ级推荐包括BRAF抑制剂+MEK抑制剂、FGFR抑制剂、RET抑制剂、抗HER2单抗等,Ⅲ级推荐提到了NRG1 抑制剂。2024年第2版NCCN指南(图4)中,艾伏尼布同样是1类证据推荐二线治疗;此外,RET抑制剂进入一线治疗,二线治疗新增了KRAS G12C抑制剂。
图3 2023年CSCO指南晚期胆道恶性肿瘤的二线治疗
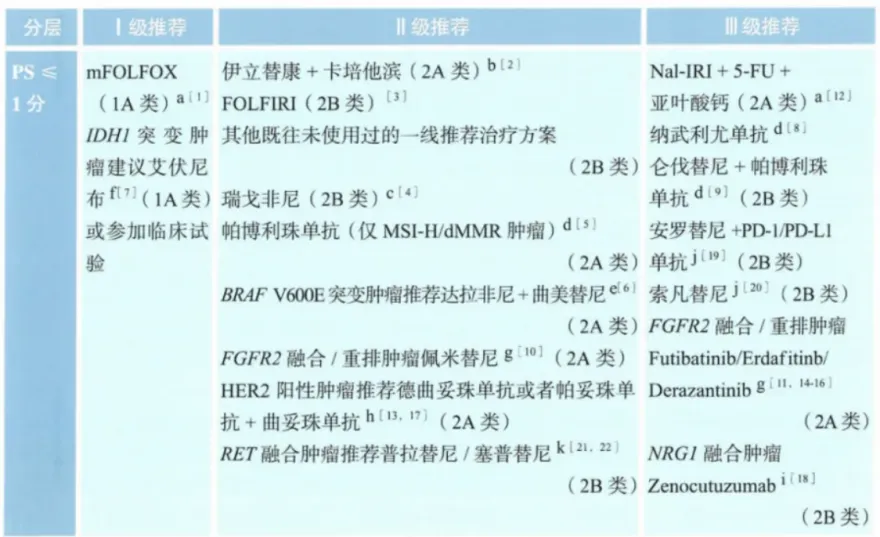

图4 2024年第2版NCCN指南晚期胆道癌靶向治疗原则[8]

“向何处去?”
拓展组合,开发新药,构建模型,扩大人群
耐药是所有靶向治疗药物难以避免的问题。令人鼓舞的是,随着相关研究的进展,一些靶向治疗“先行者”的耐药机制正被逐渐解析,比如艾伏尼布,其耐药可能与IDH2获得性突变所致的等位基因转换有关。由此,双IDH抑制剂组合疗法或可克服艾伏尼布耐药。选择性IDH2抑制剂enasidenib正在研究中,有望为组合疗法提供支持。
Wilbur HC等[6]的综述讨论了过去十年中CCA的系统治疗进展、免疫治疗的机制及前期研究、现状和新兴的免疫疗法选择。关于CCA的新型疗法,作者谈到,一些临床前研究结果已经提示了进一步改善CCA系统治疗效果的潜在新型策略。例如,在IDH1突变的CCA小鼠模型中,抑制IDH1被证明能促进CD8+T细胞募集和IFN-γ表达,并导致肿瘤细胞中TET2依赖的IFN-γ应答基因的诱导。当CD8+T细胞被耗竭或TET2/IFN-γ受体1被消除时,观察到了IDH1抑制治疗抵抗。而CTLA4阻断能够克服这种免疫抑制,为CCA靶免联合治疗提供了方向,提示IDH1抑制剂与CTLA4抑制剂组合是一种有效的策略,且免疫功能和IFN-γ-TET2轴对于治疗应答都是必要的。此外,在一项艾伏尼布围手术期治疗IDH1突变型低级别胶质瘤Ⅰ期研究中,研究者发现IDH1抑制剂可以通过增加肿瘤免疫细胞浸润来改变肿瘤免疫微环境,突变IDH的代谢产物2-HG会随着IDH1抑制剂的应用而降低,而2-HG的降低与CD3+T细胞以及CD8+T细胞浸润肿瘤的适度增加有关,这一发现同样为IDH1抑制剂与免疫治疗的联合提供了依据[10]。
类似的,在FGFR2融合的CCA患者来源模型中,EGFR信号的反馈激活通过限制细胞死亡诱导限制了FGFR抑制。体内实验中,抑制野生型EGFR导致MEK/ERK和mTOR信号通路受到抑制,增加了细胞凋亡,从而导致肿瘤退缩,这为采用FGFR2抑制剂与EGFR抑制剂联合治疗FGFR2融合阳性CCA提供了可能。这些联合疗法的应用有望突破当前靶向治疗单药的疗效“壁垒”。
此外,其他一些靶点已有靶向药物获批用于其他瘤种(见表3),但要将这种理论上的获益转化为CCA治疗中仍然存在挑战,一定程度上是由于CCA的相对罕见性,有限的患者数量增加了临床试验招募受试者的难度。“篮式试验”中,CCA患者往往只占治疗队列的小部分。专门针对CCA患者的靶向疗法临床试验方能提供更可靠的该药物在该人群中真实疗效的信息。由此,ClarIDHy研究为代表的CCA靶向治疗高级别RCT更显弥足珍贵。
表3 CCA中的OncoKB 1级可干预基因变异及相应已获批靶向药物是否开展涉及CCA的临床试验

另一方面,Ⅲ期“伞式”RCT试验SAFIR/ABC-10研究将评估8种不同靶向药物在晚期CCA患者中的价值,值得期待。人源肿瘤异种移植(PDX)等模型的开发有助于精准鉴定治疗靶点、高效选择有效药物、预测耐药风险,是CCA治疗突破的重要努力方向。迄今为止,CCA一线治疗尚无靶向药物获批。FIGHT 302和PROOF 301试验正试图将佩米替尼和Infigratinib前移至一线治疗,与标准化疗“一较高下”。未来,靶向治疗用于可切除CCA的辅助或新辅助治疗也是值得探索的方向。
王教授表示,随着学术界对CCA生物学机制认识的不断提高,不久的将来很可能会出现更多靶向疗法,目前多项试验正在招募CCA患者。正如Gilbert TM等[5]在综述中所建议的一样,鼓励CCA患者行全面分子检测以明确他们是否适合接受现有靶向治疗或参与正在和将要开展的临床试验。


王教授指出,全球CCA预后现状亟待改善,靶向、免疫治疗是疗效突破的主要希望,部分药物已经崭露头角。全面分子检测已成精准时代大势所趋,CCA领域亦是如此。ClarIDHy研究引领了CCA靶向治疗高级别临床试验的探索步伐,多种已知的可干预靶点药物仍需丰富在CCA领域的直接证据。未来,我们仍需要在新药开发、构建精准模型、拓展联合模式、前移用药时机等方向继续深入研究,探索CCA靶向治疗的新发展。
[1]Khan SA,et al. Liver Int,2019,39(S1):19–31.
[2]Groot Koerkamp B, et al. J Am Coll Surg,2015,221(6):1041–1049.
[3] Banales JM, et al. Nat Rev Gastroenterol Hepatol,2020,17(9):557–588.
[4] Alabraba E, et al. Eur J Surg Oncol,2019,45(9):1660–1667.
[5]Gilbert TM, et al. Eur J Surg Oncol,2024 Apr 17:108352.
[6]Wilbur HC, Azad NS. Ther Adv Med Oncol,2024 Mar 5;16:17588359241235799.
[7] Future Oncol. 2021 Jun:17(16):2057-2074.
[8] CSCO胆道恶性肿瘤诊疗指南2024.
[9] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®):Biliary Tract Cancers,Version 2.2024.
[10] Nat Med.2023; 29(3):615-622.
文档编号:M-TIBSO-CN-202405-00017
本文转自:论坛报
排版编辑:肿瘤资讯-邓文普












 苏公网安备32059002004080号
苏公网安备32059002004080号


