急性髓系白血病(AML)是一种由于外周血、骨髓或其他组织中髓系原始细胞克隆性增生所致的髓系肿瘤,具有高度异质性。尽管新药的问世和应用显著改善了AML患者的预后,但部分患者仍面临复发及因耐药性引发的疾病进展等重大挑战。
既往研究表明,传统诱导化疗在复发/难治性AML患者中的毒性较大且缓解持续时间较短,患者的总体预后仍不理想。Uproleselan(GMI-1271)作为一种E-选择素拮抗剂,通过干扰AML细胞的存活机制,展现了克服化疗耐药性并可能增强化疗反应的潜力。
在2024年美国血液学会(ASH)年会上(摘要号:Oral 733),研究者公布了一项针对Uproleselan联合化疗治疗AML的Ⅲ期随机双盲研究的最新数据。研究重点探讨了该联合治疗方案在复发/难治性AML(R/R AML)患者中的疗效,为这一新型治疗策略提供了关键证据。
本文将基于最新研究结果,对Uproleselan联合化疗的疗效及其在AML治疗中的应用前景进行深入分析。

应对耐药挑战,AML前路在何方?
化疗是新诊断AML患者的常用治疗手段之一,部分患者可通过化疗获得较好的缓解,甚至实现治愈。然而,对于未能从一线化疗中获得缓解的AML患者,预后通常较差,其长期生存率不足10%,且治疗选择十分有限[1]。
研究表明,AML患者对一线化疗的耐药性涉及多种机制,包括解毒酶和药物外排泵的表达、拓扑异构酶的突变、促生存基因表达增加以及代谢适应等。此外,AML患者在确诊时,核因子-κB(NF-κB)信号通路的活性增强也与化疗耐药性密切相关。这些耐药机制使得该类患者的治疗复杂性进一步增加。
值得注意的是,恶性肿瘤细胞在围血管部位表现出更强的生存优势,但这种优势的具体相互作用机制尚未完全明确。识别并靶向这些保护性微环境因子,对于开发根除残存耐药性白血病或癌症干细胞的新策略,以及改善治疗效果,具有重要意义。
在患者骨髓(BM)中,内皮细胞能够形成一种血管微环境,对造血干细胞(HSC)的静止状态、自我更新、活化以及归巢发挥直接的支持和调控作用。既往研究表明,内皮(E)选择素是该微环境中的关键因子之一。选择素家族共有三种成员,主要参与白细胞滚动及组织归巢的调控。其中,E-(内皮)选择素和P-(血小板和内皮)选择素在活化或炎症状态下的内皮细胞中表达,通常与整合素配体协同作用。
研究发现,内皮细胞特异性E-选择素(CD62E)在调节HSC静止状态与增殖切换方面具有独特作用。当E-选择素在骨髓内皮微环境中表达时,HSC与其接触可直接触发HSC活化和增殖,并诱导分化。相反,缺乏E-选择素或通过治疗性阻断其功能,则可促进HSC的静止状态,增强其自我更新潜能,并提高其对化疗的耐受性。
在此背景下,Dana-Farber癌症中心Daniel J DeAngelo教授团队开展了一项I/II期研究,探索了uproleselan联合化疗作为R/R AML患者诱导治疗以及老年AML患者一线治疗的疗效。
疗效分析
对于R/R AML患者,接受推荐II期剂量(RP2D)的54例患者中,完全缓解/血细胞计数未完全恢复(CR/CRi)率为41%。在原发性难治性疾病和复发性疾病患者中,CR/CRi率分别为29%和46%。具体来看,既往接受过1次诱导治疗的复发性AML患者CR/CRi率为52%,而接受≥2次诱导治疗的患者CR/CRi率为36%。
在复发患者中,初始CR持续时间<12个月的患者CR/CRi率为28%,而初始CR持续时间≥12个月的患者CR/CRi率高达83%。总体而言,51%的R/R AML患者曾接受高剂量阿糖胞苷治疗,其CR/CRi率为47%,与总体队列结果一致。诱导治疗结束时,R/R AML患者的微小残留病(MRD)阴性率达到69%。在获得CR/CRi的22例患者中,50%的患者进一步接受了移植治疗。
中位随访时间为9.7个月,接受uproleselan RP2D治疗的患者中位总生存期(OS)为8.8个月,1年生存率为37.0%,中位无事件生存期(PFS)为1.5个月,中位缓解持续时间(DoR)为9.5个月。
新诊断AML患者的研究结果
在新诊断AML患者中,CR/CRi率为72%,61%的患者通过1个周期诱导治疗达到了CR/CRi。在可评估患者中,MRD阴性率为56%。针对继发性AML患者,CR/CRi率为69%。
在接受uproleselan联合“7+3”方案治疗的25例新诊断AML患者中,中位OS为12.6个月,12个月生存率为52.0%,中位PFS为9.2个月,中位DoR为10.5个月。
安全性分析
研究显示,在66例R/R AML患者中,不同剂量水平的uproleselan治疗组不良事件(TEAE)发生率相似,未观察到因AE导致的停药。所有R/R AML患者均发生了4级骨髓抑制,但大多数TEAE和非血液学TEAE与uproleselan无关。治疗开始后30天内1例(2%)患者死亡,研究60天的死亡率为9%(n=6)。在新诊断AML患者中,观察到的毒性主要与潜在的白血病特征和化疗相关。与R/R AML患者相似,4级骨髓抑制较为常见,30天和60天全因死亡率分别为8%和12%。
总体而言,这项研究结果证实了,对于R/R AML及新诊断老年AML患者,在化疗中添加uproleselan耐受性好,缓解率高,诱导死亡率低。
III期研究结果为新型治疗方案再添力证
在2024年ASH大会上,Daniel J DeAngelo教授报告了化疗中添加uproleselan治疗R/R AML的Ⅲ期研究数据,进一步探索了该新型方案的效果。

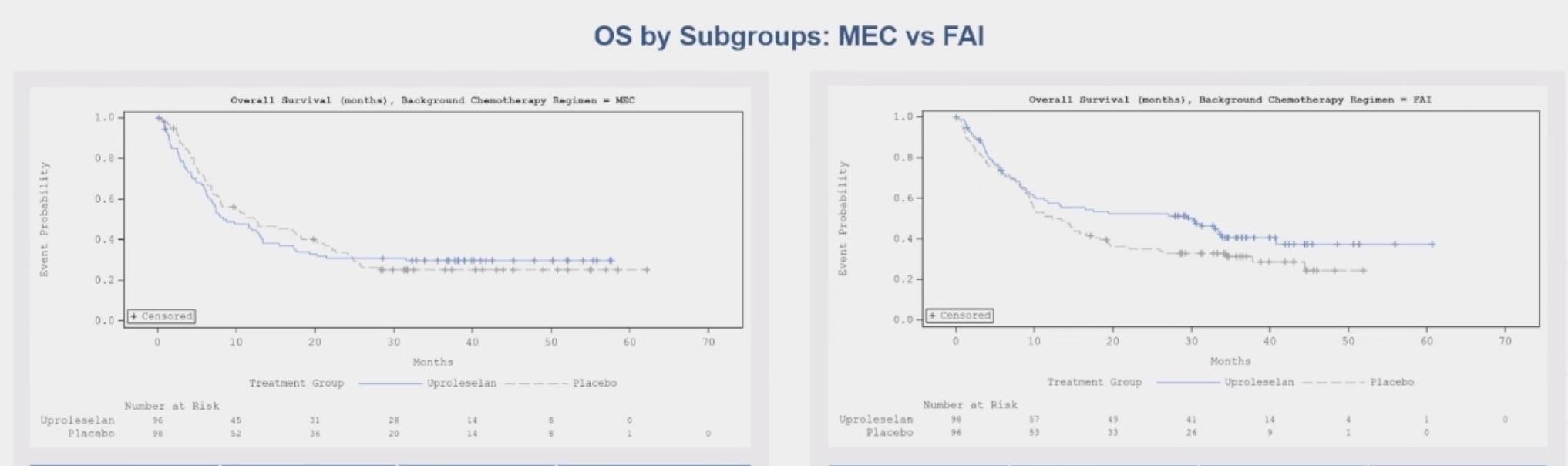
该研究共纳入患者中位年龄为58岁,既往接受治疗的中位次数为1次。结果显示,uproleselan组的中位总生存期(mOS)为13.0个月,而对照组(PBO)为12.3个月(p=0.39),两组间差异无统计学意义。然而,48个月时,uproleselan组的生存率(34.1%)高于对照组(25.5%)。诱导治疗期间,严重(≥3级)口腔黏膜炎的发生率在两组中一致(均为7.2%)。在完全缓解(CR)率和CR/血细胞计数未完全恢复CR率(CR/CRh)方面,uproleselan组均更具优势(CR:36.1% vs 33.5%,p=0.62;CR/CRh:46.4% vs 41.2%,p=0.24)。在达到CR的患者中,uproleselan组的微小残留病(MRD)阴性率更高(67.1% vs 61.5%)。
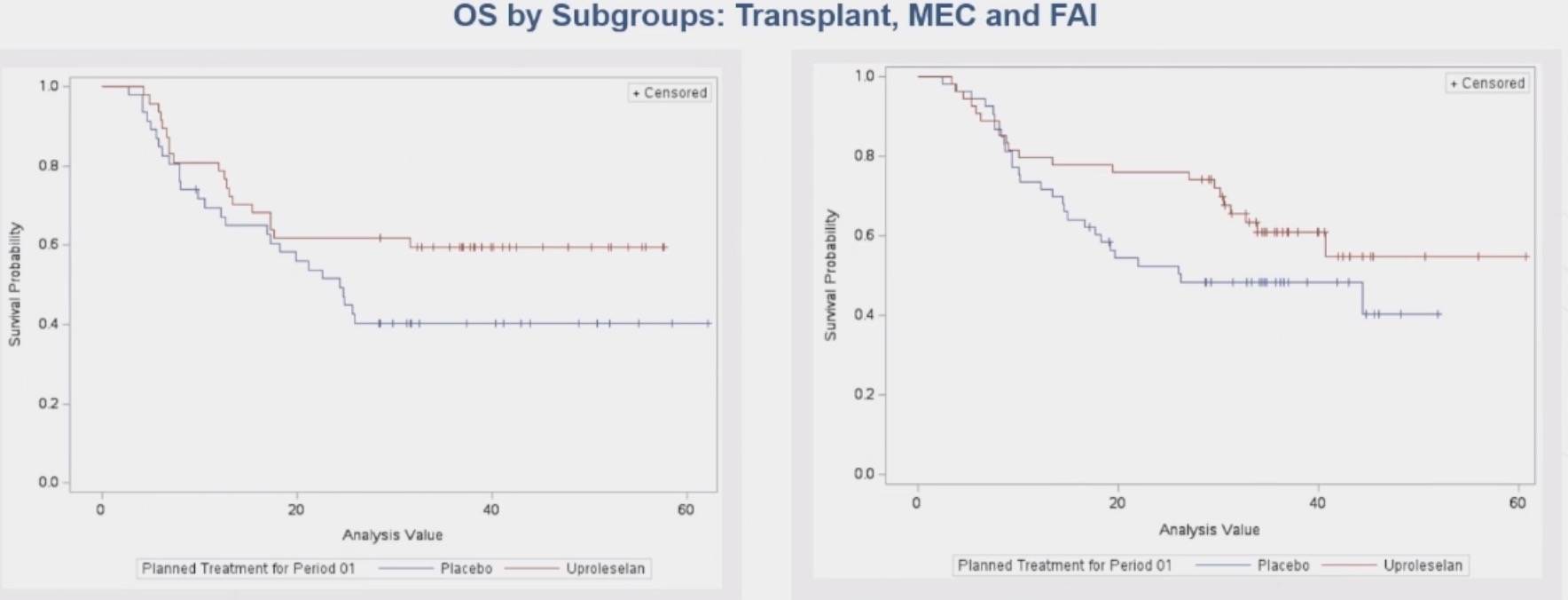
在异基因干细胞移植(allo-SCT)方面,两组接受移植的患者比例相当(uproleselan组为52.1%,对照组为51.0%)。在接受移植的患者中,uproleselan组的mOS尚未达到,而对照组为24.8个月(HR=0.59)。
亚组分析
进一步分析显示,患者年龄对R/R AML治疗结果无显著影响。尽管化疗方案对R/R AML疗效有所影响,但差异不显著。在接受移植的患者中,无论采用何种化疗方案,uproleselan组的OS均未达到。在接受移植的患者中,60个月时,uproleselan组的生存率为57.5%,对照组为27.7%。
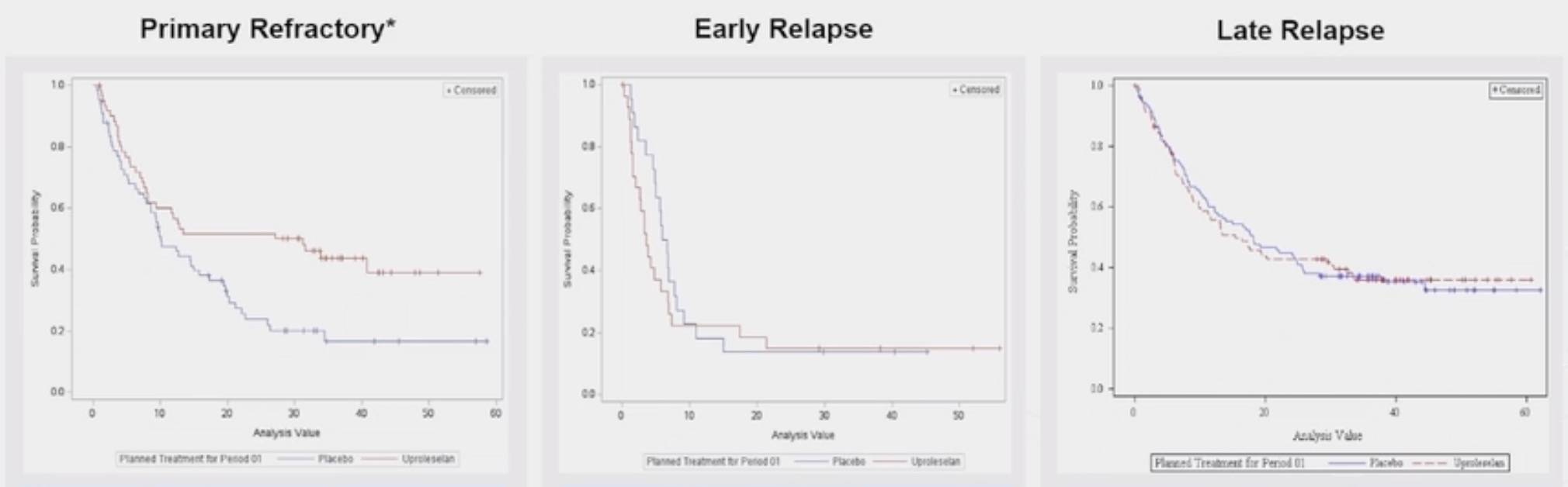
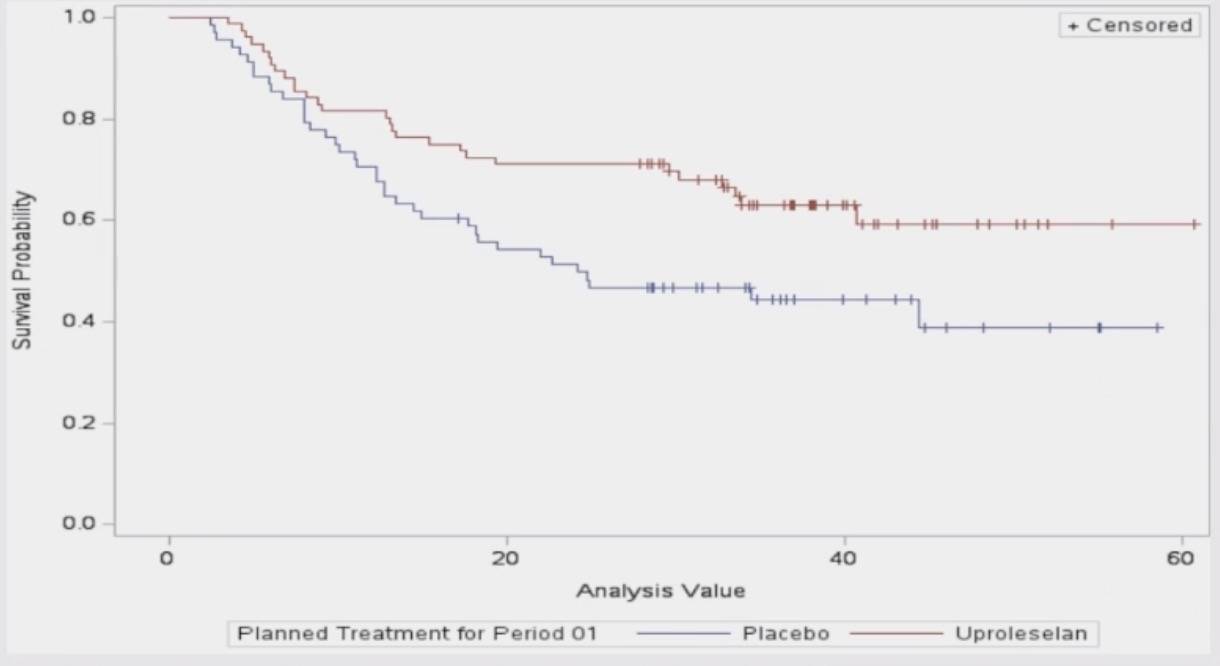
在原发性难治性AML亚组中,uproleselan组的mOS为31.2个月,而对照组为10.1个月,展现了显著的生存获益。然而,在早期和晚期复发的AML患者中,两组间的治疗差异不显著。
疗效与耐受性
在原发性难治性AML患者中,uproleselan组的CR率略高(32.3% vs 27.3%)。此外,PBO组的中位缓解持续时间(DoR)为12.7个月,而uproleselan组尚未达到。无论化疗方案如何,两组中达到MRD阴性的患者mOS均超过2年。
对于原发性难治性患者,uproleselan组的MRD阴性率为35.5%,而对照组为24.2%。两组在治疗意向人群(ITT)和原发性难治性人群中的TEAEs、严重不良事件(SAEs)、3级及以上TEAEs发生率相似。值得注意的是,与单独化疗相比,加入uproleselan并未显著增加毒性。
总结
尽管化疗联合uproleselan对比PBO的III期试验未达到主要OS终点,但在多个预设AML亚组中观察到含uproleselan的治疗具有显著临床获益。在原发性难治性AML患者中,uproleselan组的中位OS为31个月,对照组为10个月(HR=0.58),展现出显著的生存优势。同时,uproleselan组的中位DoR尚未达到。另外,患者年龄对两组治疗效果无显著影响。在接受移植的患者中,PBO组的中位生存期超过2年,而uproleselan组尚未达到中位生存期(HR=0.59),进一步表明uproleselan可能延长移植患者的生存期。
此外,治疗相关的不良反应与所用化疗药物的已知毒性一致,未观察到因加入uproleselan导致的额外毒性负担。这些结果为探索uproleselan在特定患者群体中的治疗潜力提供了重要依据,同时提示需要进一步研究以优化其临床应用策略。
[1]Culver-Cochran, A.E., Hassan, A., Hueneman, K. et al. Chemotherapy resistance in acute myeloid leukemia is mediated by A20 suppression of spontaneous necroptosis. Nat Commun 15, 9189 (2024). https://doi.org/10.1038/s41467-024-53629-z
[2]Barbier, V., Erbani, J., Fiveash, C. et al. Endothelial E-selectin inhibition improves acute myeloid leukaemia therapy by disrupting vascular niche-mediated chemoresistance. Nat Commun 11, 2042 (2020)
[3]DeAngelo DJ, Jonas BA, Liesveld JL, Bixby DL, Advani AS, Marlton P, Magnani JL, Thackray HM, Feldman EJ, O'Dwyer ME, Becker PS. Phase 1/2 study of uproleselan added to chemotherapy in patients with relapsed or refractory acute myeloid leukemia. Blood. 2022 Feb 24;139(8):1135-1146. doi: 10.1182/blood.2021010721. PMID: 34543383; PMCID: PMC11017789.
[4]Efficacy and Safety of Uproleselan Combined with Chemotherapy Vs. Chemotherapy Alone in Relapsed/Refractory Acute Myeloid Leukemia: Findings from an International Phase 3 Trial,abstract 733
排版编辑:Cherry











 苏公网安备32059002004080号
苏公网安备32059002004080号


