胆管癌是一种起源于胆管上皮细胞的恶性肿瘤,生物学特性复杂,具有高度异质性和侵袭性,为临床诊疗带来严峻考验。既往,胆管癌的治疗手段匮乏,且疗效难以令人满意,患者生存期有限,总体预后欠佳[1]。因此,寻找更有效的治疗策略,特别是针对特定分子标志物的靶向治疗和免疫治疗,成了当前研究的重点。在2024年美国肿瘤学会(ASCO)年会中,公布了多项胆管癌前沿研究进展,内容覆盖新治疗靶点的开发、新兴治疗模式的探索,为胆管癌的临床治疗点亮了引路明灯。
在此背景下,本期特邀西安交通大学第一附属医院锁爱莉教授对近期发表的胆管癌精准治疗相关文献进行深入解读,以剖析胆管癌领域的靶向诊疗的最新进展。本报整理成稿并经锁爱莉教授审校,以飨读者。
专家简介
主任医师,教授,博士生导师
西安交大一附院肿瘤内科副主任
美国Emory大学访问学者
中国抗癌协会食管肿瘤整合康复专委会常委
中国抗癌协会肿瘤胃病学专委会常委
中国抗癌协会整合肿瘤肾脏病专委会委员
陕西省抗癌协会化疗专委会青委主任委员
陕西省抗癌协会老年肿瘤外科专委会副主任委员
陕西省抗癌协会安宁疗护专委会副主任委员
主持国科金面上项目2项,一作/通讯作者SCI论文20余篇,IF>10的10余篇,授权国家发明专利3项
靶向IDH1,胆管癌个性化治疗
A phase 1/2, safety lead-in and dose expansion, open-label, multicenter trial investigating the safety, tolerability, and preliminary activity of ivosidenib in combination with nivolumab and ipilimumab in previously treated subjects with IDH1-mutated nonresectable or metastatic cholangiocarcinoma. Kelley, R. K., et al. Journal of Clinical Oncology, 42(16_suppl), e16016-e16016[2]
异柠檬酸脱氢酶(IDH)1突变是胆管癌中的一个重要分子标志物,约15%的肝内胆管癌(ICC)患者存在此突变,可导致肿瘤细胞产生2-羟基戊二酸(2-HG),抑制T细胞功能并抑制肿瘤免疫反应,从而促进肿瘤生长和转移[2]。随着分子生物学研究的深入,科学家们发现IDH1基因的激活突变在胆管癌中发挥着重要作用[2],为胆管癌的治疗提供了新的思路。
Kelley[2]等人开展了一项1/2期临床试验,评估艾伏尼布联合纳武利尤单抗和伊匹木单抗在IDH1突变型不可切除或转移性胆管癌患者中的安全性和疗效。该研究分为安全导入期和扩展期,有2个不同的扩展队列:队列1,ICI未经治组;队列2,ICI经治组。主要目的是评估艾伏尼布联合纳武利尤单抗和伊匹木单抗的安全性和耐受性,并确定推荐的联合剂量(RCD)。该阶段将纳入6至12名患者。前6患者将接受艾伏尼布 500mg口服,QD,联合伊匹木单抗1mg/kg和纳武利尤单抗 3mg/kg,IV,Q3W,共4次,后序贯纳武利尤单抗 480mg IV,Q4W,直到进展或不可接受的毒性(最多24个月的纳武利尤单抗)。剂量限制毒性(DLT)将在治疗的前2个周期中进行评估。另外6名患者可能被纳入可选剂量组评估,艾伏尼布250mg,QD。在确定RCD后,将启动两个扩展队列,以评估三联用药在既往有和无ICI的患者中的临床活性。
这项研究为mIDH1突变型胆管癌的治疗提供了新的思路。艾伏尼布联合纳武利尤单抗和伊匹木单抗可能成为一种新的治疗策略,为患者带来更好的生存获益。
聚焦Claudin18.2
发现新靶点治疗
Xianjun Yu, et al. Safety and efficacy of IBI343 (anti-claudin18.2 antibody-drug conjugate) in patients with advanced pancreatic ductal adenocarcinoma or biliary tract cancer: Preliminary results from a phase 1 study. Journal of Clinical Oncology 2024 42:16_suppl, 3037-3037[3]
Claudin18.2是一种紧密连接蛋白,在多种肿瘤组织中高表达,被认为是潜在的治疗靶点。IBI343 是一种抗体药物偶联物 (ADC),可以特异性地靶向肿瘤细胞并释放药物,提高疗效并降低毒性。
一项 I 期研究[3]报告了 IBI343 在晚期胰腺导管腺癌 (PDAC) 和胆管癌 (BTC) 患者中的安全性及疗效结果。35 名对标准治疗无效或无法耐受的晚期 PDAC 或 BTC 患者接受了 IBI343 治疗,剂量为 6 mg/kg 或 8 mg/kg 每 3 周一次的静脉注射。
研究结果显示,IBI343 在 PDAC 和 BTC 患者中表现出良好的安全性,耐受性良好,未观察到新的安全性信号。IBI343 6 mg/kg 和 8 mg/kg 剂量组均未观察到剂量限制性毒性。28 名患者 (80.0%) 出现了治疗相关不良事件 (TRAEs),其中 9 名患者 (25.7%) 出现了≥3级TRAE。最常见的 TRAE 包括贫血 (42.9%)、中性粒细胞计数减少 (28.6%)、恶心 (25.7%)、呕吐 (25.7%) 和白细胞计数减少 (22.9%)。4 名患者 (11.4%) 出现了严重 TRAE,7 名患者 (20.0%) 出现了导致治疗中断的 TRAE,1 名患者 (2.9%) 出现了导致停药的 TRAE。没有患者因 TRAE 死亡。
在 Claudin18.2 阳性患者中,IBI343 显示出令人鼓舞的有效性。截至 2024 年 1 月 15 日,25 名患者可评估疗效,其中 7 名患者出现部分缓解 (PR)。客观缓解率 (ORR) 为 28.0%,疾病控制率 (DCR) 为 80.0%。Claudin18.2 表达量越高,IBI343 的有效性可能越好。
该研究首次评估了 IBI343 在 PDAC 和 BTC 患者中的安全性及有效性,为 Claudin18.2 阳性患者提供了新的治疗选择。研究结果表明,Claudin18.2 表达量可能影响 IBI343 的疗效,这一发现也为个体化治疗提供了依据。
探索分型,精准治疗
Xu, S. et al. Differential IDH1 and IDH2 mutation-related landscape in intrahepatic cholangiocarcinoma. Journal of Clinical Oncology 2024 42:16_suppl, e16224 - e16224[4]
IDH 相关的靶向治疗是肝内胆管癌(ICC)治疗中的重要靶点。IDH1 和 IDH2 突变通常被认为对肿瘤微环境有相似的影响。然而,这两种突变是否对肿瘤细胞和肿瘤微环境有完全相同的影响仍存在疑问。
一项研究[4]对收集的 ICC 患者肿瘤样本进行全外显子测序和蛋白质组测序,分析 IDH1 和 IDH2 突变的发生频率、突变类型以及与肿瘤微环境和预后的关系。研究结果显示,IDH1突变占12.2%,IDH2突变占5.5%,均为错义突变。IDH突变型肿瘤中KRAS和TP53突变的比例较低,表明IDH突变可能与其他基因突变存在互斥关系。IDH2突变型肿瘤中的突变基因明显富集于激酶通路,提示IDH2突变可能通过激活激酶信号通路影响肿瘤的发生发展。IDH突变型肿瘤的信号通路主要富集于细胞代谢活动的激活和抑制性免疫细胞的增加,表明IDH突变可能通过影响细胞代谢和免疫微环境来促进肿瘤生长。此外,IDH1突变型肿瘤在DNA修复方面具有独特的富集,而IDH2突变型肿瘤在生物分子的分泌方面具有独特的富集。抑制性免疫细胞可能在IDH2突变型肿瘤中更为突出,而免疫检查点PVR和HLA-DQB1的表达在IDH1突变型肿瘤中更为突出。IDH突变与代谢相关和炎症免疫反应簇更为相关,其中一些属于DNA复制簇。
该研究首次系统性地比较了IDH1和IDH2突变在ICC中的差异特点,揭示了IDH1和IDH2突变对肿瘤细胞和肿瘤微环境的不同影响,为指导ICC治疗提供了重要的参考数据库。
精准免疫,解密分子密码
Soumya Shekhar, et al. Deep immune profiling of intrahepatic cholangiocarcinoma with CODEX multiplexed imaging. Journal of Clinical Oncology 2024 42:16_suppl, 4117-4117[5]
肝内胆管癌(ICC)是一种具有异质性的恶性肿瘤,其分子特征和免疫微环境与患者的预后和治疗反应密切相关。目前,ICC主要根据是否存在潜在的分子改变进行亚型分类,其中IDH1突变和FGFR2融合/重排最为常见。然而,关于这些分子改变与肿瘤免疫微环境(TME)之间的关系,尚缺乏深入的了解。
为了探究ICC分子特征与TME之间的关系,一项研究[5]对24个ICC肿瘤样本进行了单细胞水平的免疫表型分析。这些样本包括FGFR2融合/重排阳性(FGFR2+)、IDH1突变阳性(IDH1+)和FGFR2/IDH1野生型iCCA。研究人员使用CO-Detection by indEXing (CODEX)技术对TME中的免疫细胞进行高参数分析,并利用邻域分析和空间网络构建技术,揭示了不同分子亚型ICC的免疫细胞组成和空间分布特征。
研究发现,FGFR2+iCCA表现出免疫沙漠表型,其特征是CD8+T细胞、CD117+肥大细胞和CD68+/CD163+巨噬细胞数量显著减少,但CD11b+/CD15+粒细胞数量增加。相比之下,IDH1+ iCCA中CD11b+/CD15+粒细胞数量减少。空间分析显示,FGFR2+ iCCA中CD4+ T细胞与肿瘤细胞距离更远,而CD11b+/CD15+粒细胞与肿瘤细胞距离更近。此外,FGFR2+ iCCA中CD4+ T细胞和CD11b+/CD15+粒细胞之间的邻近程度更近,表明存在更强的淋巴-髓样邻域关系。
这项研究表明,FGFR2+和IDH1+ iCCA具有不同的免疫表型,这为分子改变可能指导免疫治疗的选择提供了初步证据。免疫细胞数量以及免疫细胞之间的空间关系都可能影响ICC的预后和对治疗的反应。因此,根据特定的分子亚型定制免疫治疗方法可能会改善不同分子定义的ICC亚型的预后。
靶向疗法新进展
HER2通路再突破
Timothy L. Cannon, et al. Pertuzumab Plus Trastuzumab in Patients With Biliary Tract Cancer With ERBB2/3 Alterations: Results From the Targeted Agent and Profiling Utilization Registry Study. Journal of Clinical Oncology 2024[6]
Targeted Agent and Profiling Utilization Registry Study是一项II期篮子试验[6],评估市售靶向药物对具有相应靶标改变的晚期癌症患者的抗肿瘤活性。研究报告了胆管癌(BTC)患者队列的治疗结果,这些患者具有ERBB2/3基因扩增、过表达或突变,并接受了帕妥珠单抗联合曲妥珠单抗的治疗。
研究纳入符合条件的患者:患有晚期 BTC、可测量疾病(RECIST v1.1)、ECOG评分0-2分、足够的器官功能、具有 ERBB2/3 改变的肿瘤以及缺乏标准治疗方案。主要研究终点为疾病控制率(DCR),以RECIST v1.1为标准,客观反应率(ORR)或至少16+ 周疾病稳定(SD16W+)。次要终点包括 ORR、无进展生存期、总生存期、反应持续时间、疾病稳定持续时间和安全性
2017年2月至2022年1月期间,共入组29例患者,均为ERBB2/3改变的晚期BTC。一名患者的疗效无法评估。研究观察到1例完全缓解(CR)、8例部分缓解(PR)和2例SD(16+),DCR和ORR分别为40%(90% CI,27-100)和32%(95% CI,16-52)。拒绝15% DC率的原假设(P = 0.0015)。
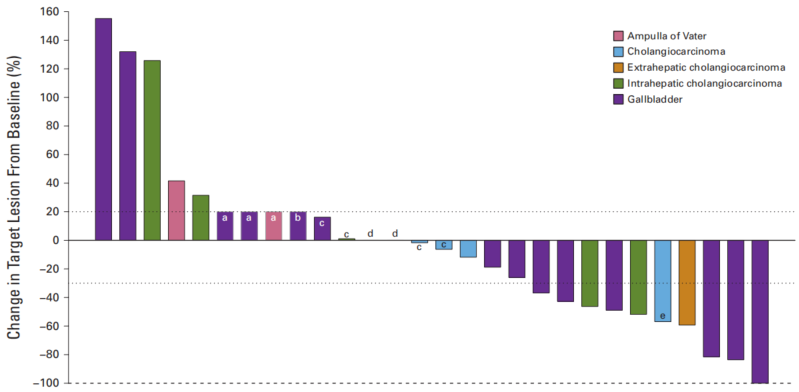

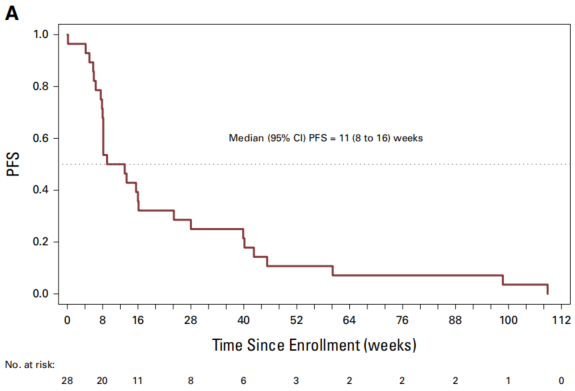
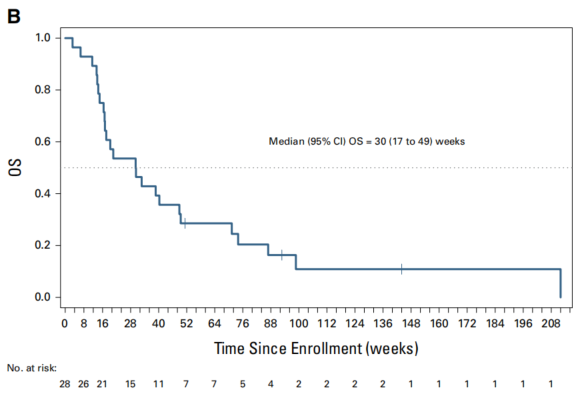
在所有可评估患者中,中位无进展生存期(PFS)为11周(95% CI,8周至16周),中位总生存期(OS)为30周(95% CI,17周至49周)。
与治疗相关的3级不良事件 (TRAE) 或SAE包括:贫血、腹泻、输液相关反应和疲劳。
研究结果显示,帕妥珠单抗联合曲妥珠单抗,在伴有ERBB2/3扩增、过表达或突变的BTC患者中具有抗肿瘤活性。
专家点评
BTC是一组异质性肿瘤的统称,包括胆囊癌、胆管癌和壶腹癌。尽管胆管癌相对罕见,但2006年至2016年间,全球胆管癌的发病率和死亡率显著上升。早期诊断的胆管癌5年生存率为17%,而晚期患者的5年生存率仅为2%[6]。锁爱莉教授表示,晚期胆管癌患者的预后仍较差,一线化疗方案生存获益有限,且缺乏有效的二线治疗方案。近年来,胆管癌的治疗取得了显著进展。全面基因组测序和靶向治疗的兴起为胆管癌患者带来了新的希望,为一线化疗后患者的治疗提供了新的选择。
近期,ASCO 2024中公布了多项研究结果,聚焦于胆管癌的精准治疗,为未来胆管癌患者更多的临床治疗奠定了一定的基础。例如,IDH1基因突变是胆管癌中常见的突变靶点,IDH1抑制剂艾伏尼布已证实可显著延长IDH1突变晚期胆管癌患者的无进展生存期,并带来生存获益[2]。Claudin18.2被认为是潜在的治疗靶点,亦有研究[3]报道了IBI343(一种针对CLDN18.2的抗体药物偶联物)治疗晚期胰腺导管腺癌或胆管癌的I期临床试验的初步结果,显示其具有良好的安全性和疗效。
另外,随着基因测序和分子生物学的发展,人们对胆管癌的了解也不断深入。例如,有研究[4]通过比较IDH1和IDH2突变在ICC中的不同特点,发现了IDH1和IDH2突变具有不同的基因突变谱和信号通路改变。亦有研究[5]发现FGFR2+和IDH1+ iCCA具有不同的免疫表型,提示分子特征可能影响免疫治疗的疗效。
除了IDH1突变,ERBB2/3基因改变也是胆管癌中常见的分子特征之一。在胆管癌的治疗中,靶向治疗和免疫治疗已经取得了显著进展。特别是,针对ERBB2/3通路的治疗策略显示了巨大的潜力。锁爱莉教授提到,Targeted Agent and Profiling Utilization Registry Study篮子研究[6],帕妥珠单抗联合曲妥珠单抗在携带ERBB2改变的胆管癌患者中显示出抗肿瘤活性。这些结果表明,针对ERBB2/3基因改变的靶向治疗可为胆管癌患者带来显著的生存获益,为临床治疗提供了新的选择。
然而,胆管癌的治疗仍需进一步探索。IDH1和IDH2突变具有不同的基因组和信号通路特征,提示针对不同IDH突变的胆管癌患者可能需要采用不同的治疗策略。此外,免疫治疗在胆管癌中的应用也取得了初步进展,但仍需进一步研究以确定其最佳的治疗方案和患者选择标准。
由此可见,深入探索胆管癌分子机制、开发新兴治疗策略,是未来研究的一个方向。期待能有更多研究进一步探索与验证,以提高胆管癌患者的生存率和生活质量。
[1]邓海敏,段华新. 胆管癌靶向治疗的研究现状[J]. 临床肝胆病杂志,2020,36(12):2856-2859. DOI:10.3969/j.issn.1001-5256.2020.12.046.
[2]Kelley, R. K., Cleary, J. M., Sahai, V., Baretti, M., Bridgewater, J. A., Hua, Z., Gliser, C., Bian, Y., & Abou-Alfa, G. K. (2024). A phase 1/2, safety lead-in and dose expansion, open-label, multicenter trial investigating the safety, tolerability, and preliminary activity of ivosidenib in combination with nivolumab and ipilimumab in previously treated subjects with IDH1-mutated nonresectable or metastatic cholangiocarcinoma. Journal of Clinical Oncology, 42(16_suppl), e16016-e16016. IF=32.924
[3]Xianjun Yu, Jian Zhang, Andrea Tazbirkova, Jianwei Yang, Jinbo Yue, Yuping Sun, Yueyin Pan, Meili Sun, Yanru Qin, Lin Shen, Rongfeng Song, Jian Ruan, Aiping Zhou, Yiping Mou, Zimin Liu, Zhenyang Liu, Yongchang Zhang, Michelle Morris, Morteza Aghmesheh, Hui Zhou,Journal of Clinical Oncology 2024 42:16_suppl, 3037-3037.IF=34.785
[4]Xu, S., Qu, W., Shen, Y., & Ruan, J. (2024). Differential IDH1 and IDH2 mutation-related landscape in intrahepatic cholangiocarcinoma. Journal of Clinical Oncology 2024 42:16_suppl, e16224-e16224
[5]Soumya Shekhar, Vaibhav Sahai, Kathryn Howe, Qingfeng Zhu, Aya Kondo, Helen L. Fedor, Valerie Gunchick, Naziheh Assarzadegan, Nilofer Saba Azad, Mark Yarchoan, Marina Baretti. Deep immune profiling of intrahepatic cholangiocarcinoma with CODEX multiplexed imaging. Journal of Clinical Oncology 2024 42:16_suppl, 4117-4117
[6]Cannon, T. L., Rothe, M., Mangat, P. K., Garrett-Mayer, E., Chiu, V. K., Hwang, J., … & Schilsky, R. L. (2024). Pertuzumab Plus Trastuzumab in Patients With Biliary Tract Cancer With ERBB2/3 Alterations: Results From the Targeted Agent and Profiling Utilization Registry Study. Journal of Clinical Oncology, 42(15), 1247-1255.
本资料的内容仅作为科学信息参考,并仅用于医疗卫生专业人士间的学术交流之目的,请勿转发或用于任何其他用途。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关政府部门批准使用的指南或规定。
审批号:M-ONIVD-CN-202408-00007
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


