上皮性卵巢癌(epithelial ovarian cancer,EOC),其中以高级别浆液性癌(HGSC)为主,是致死率最高的妇科恶性肿瘤。在我国,2022年新增卵巢癌病例数达6.11万人,死亡病例达3.26万人,位居妇科恶性肿瘤第二位[1]。其发病隐匿,75%以上患者就诊时属于晚期。肿瘤细胞减灭术联合含铂化疗及靶向维持,包括抗血管生成药物如贝伐珠单抗或聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抑制剂,是目前晚期卵巢癌标准一线治疗方案[2]。尽管初始治疗有效,仍有82.5%晚期卵巢癌治疗后复发[3]。目前仅有2类靶向药物贝伐珠单抗及PARP抑制剂证实可显著延缓患者复发,但对总生存获益仍缺乏证据。高复发、易耐药、尤其是靶向治疗后耐药突出的特点,使得卵巢癌整体预后仍不理想,5年生存率仅为30%~50%,亟待寻找新的治疗方法。近年来,免疫治疗在多个实体瘤中取得突破性进展,尤其是免疫检查点抑制剂(immune checkpoint blockades,ICBs)在多个实体瘤获批适应证。EOC被认为是免疫源性肿瘤,基于卵巢癌免疫微环境为靶点的基础研究获得诸多突破,但卵巢癌存在天然免疫逃逸机制,使得免疫治疗在卵巢癌的临床试验数据均显示效果不佳。本文将ICBs在卵巢癌中应用的最新进展及存在的困难进行概述,提出后续卵巢癌免疫治疗临床研究设计中需要关注的问题,为突破治疗瓶颈提供新思路。
陈雨莲,臧荣余.卵巢癌免疫检查点抑制剂应用的现状与挑战[J].中国实用妇科与产科杂志,2024,40(11):1078-1082.
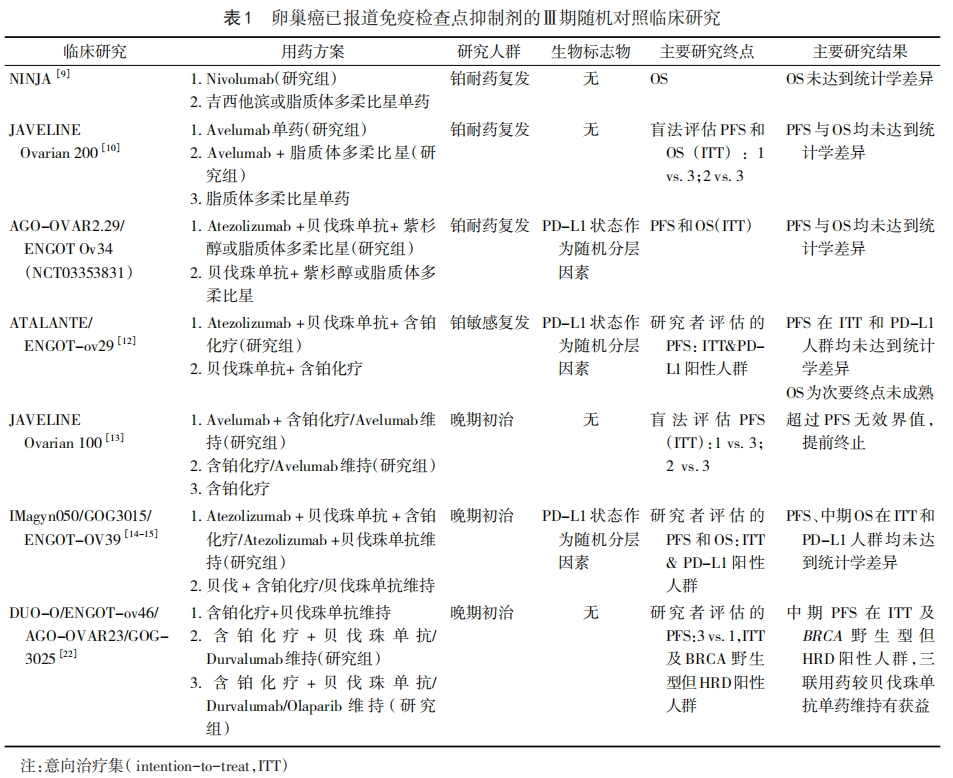
ICBs在卵巢癌中的研究现状
免疫治疗在卵巢癌临床指南中的证据等级
总体而言,目前为止尚无免疫治疗有效方案推荐用于HGSC治疗。根据指南[2],仅个别ICBs因泛癌肿适应证被建议在特定分子特征下应用于复发性卵巢癌治疗,包括帕博利珠单抗被推荐用于高频度微卫星不稳定(microsatellite instability-high,MSI-H)或错配修复缺陷(deficient mismatch repair,dMMR)状态或肿瘤突变负荷(tumor mutational burden, TMB)≥10突变/百万碱基的卵巢癌及多塔利单抗治疗MSI-H或dMMR的HGSC。
ICBs单药治疗
ICBs主要包括程序性死亡受体1及其配体(programmed death-1/programmed death-ligand 1, PD-1/PD-L1)抗体及细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein4,CTLA-4)抗体。ICBs通过结合CTLA-4、PD-1或PD-L1,阻止肿瘤与T细胞之间的免疫检查点相互作用,从而恢复T细胞的细胞毒性。伊匹木单抗是美国食品药品监督管理局(FDA)批准的第一个免疫检查点抑制剂,在黑色素瘤的治疗中显示出良好的效果,但在卵巢癌中单药治疗的临床试验有限,一项Ⅱ期临床试验(NCT01611558)采用伊匹木单抗单药治疗40例铂敏感复发性卵巢癌患者,仅2例患者完成试验用药,其余患者均因毒副反应或疾病进展未完成用药。PD-1/PD-L1单抗单药临床试验主要用于复发性卵巢癌的治疗。2012年新英格兰医学杂志发表的一项Ⅰ期泛肿瘤临床研究(NCT00729664)[4]是PD-L1抑制剂应用于卵巢癌患者的第一项临床研究,纳入17例卵巢癌患者,1例(6%)患者部分缓解,3例(18%)患者疾病稳定。KEYNOTE-028ⅠB期研究(NCT02054806)[5]则对PD-L1表达≥1%的多个实体瘤进一步探索,在26例晚期及复发性卵巢癌中,帕博利珠单抗单药的客观缓解率(ORR)为11.5%。在KEYNOTE-100的Ⅱ期临床研究(NCT02674061)[6]中,纳入376例复发性卵巢癌患者,虽然全人群的ORR仅为8%,但PD-L1联合阳性分数(combined positive score,CPS)评分越高,帕博利珠单抗有效率可呈增加趋势,当CPS≥10(占研究人群22%),ORR可达17.1%。KEYNOTE-158的Ⅱ期研究(NCT02628067)[7]对MSI-H或dMMR的多个实体瘤采用帕博利珠单抗单药治疗,24例卵巢癌的ORR可达33.3%。随后开展的多项Ⅱ~Ⅲ期临床研究,单药治疗复发性卵巢癌ORR在4%~15%不等[8-10],疗效并不理想。
ICBs联合化疗
ICBs联合化疗 由于ICBs单药治疗在多项临床试验中的不佳效果,近年来的研究方向更多的是采用联合治疗手段治疗晚期或复发性卵巢癌。基础研究提示化疗药物可下调肿瘤微环境中的调节性T细胞(Tregs)、骨髓来源抑制性细胞(myeloid-derived suppressor cells, MDSC)等免疫抑制细胞的功能,增加肿瘤抗原呈递,诱导肿瘤细胞免疫性死亡[11],理论上ICBs联合化疗可使疗效增益,但目前为止的临床研究并未能证实其有效性。JAVELIN Ovarian 200 Ⅲ期临床研究[10]共纳入566例铂耐药复发性卵巢癌患者,与脂质体盐酸多柔比星单药相比,阿维鲁单抗联合脂质体盐酸多柔比星组无论是无进展生存期(progression-free survival,PFS)还是总生存期(overall survival,OS)均无显著差异(PFS 3.7个月 vs. 3.5个月;OS 15.7个月 vs. 13.1个月)。但在PD-L1表达阳性,包括肿瘤细胞(tumor cell,TC)≥1%或免疫细胞(immune cell,IC)≥5%,且CD8+T细胞≥1%患者(占研究人群的35%),无论是PFS还是OS,免疫联合化疗较单纯化疗均有显著获益(PFS 5.6个月 vs. 2.0个月;OS 20.4个月 vs. 12.8个月)。同样,在铂敏感复发性卵巢癌及晚期卵巢癌一线治疗人群中,多项Ⅲ期临床研究(ATALANTE/ENGOT-ov29研究[12]、JAVELIN Ovarian 100研究[13]及IMagyn050/GOG3015/ENGOT-OV39研究[14-15]),均未能证实ICBs联合化疗优于化疗,无论是否联合贝伐珠单抗。但在IMagyn050研究[14]中,对于PD-L1 IC表达≥5%的患者,免疫联合化疗及贝伐珠单抗组较化疗联合贝伐珠单抗组降低复发死亡风险36%(95%CI 4%~57%),对于PD-L1 TC表达≥1%的患者,免疫联合治疗组较对照组降低复发死亡风险55%(95%CI 19%~90%)。
ICBs联合靶向
PARP抑制剂可通过激活干扰素通路、增强肿瘤内免疫细胞浸润、上调细胞毒性T细胞[16],上调PD-L1表达[17]等机制发挥免疫协同作用;而抗血管生成药物可逆转血管内皮生长因子(vascular endothelial growth factor,VEGF)介导的肿瘤免疫抑制微环境(VEGF可干扰抗原呈递、T细胞进入肿瘤区域)[18];为联合免疫治疗提供理论基础。多项Ⅱ期单臂研究显示ICBs联合PARP抑制剂或抗血管生成药物治疗复发性卵巢癌ORR可达18%~92.2%[19-21],存在较大差异性,但在Ⅲ期临床研究中,结果均未得到可靠证实[12,14-15]。在DUO-O/ ENGOT-ov46/AGO-OVAR 23/GOG-3025研究[22]中,无BRCA突变的晚期卵巢癌患者,在化疗联合贝伐珠单抗的标准治疗基础上加用度伐利尤单抗及奥拉帕利(三药维持),与单独使用化疗联合贝伐珠单抗相比,降低复发死亡风险37%(95%CI 24%~48%),但对于仅加用度伐利尤单抗的两药维持并未观察到获益,因此该研究可能证实的仍然是PARP抑制剂在BRCA野生型人群中一线维持治疗的PFS获益,而非免疫治疗。免疫治疗以BRCA或同源重组修复缺陷(homologous recombination deficiency,HRD)状态作为生物标志物尚缺乏可靠的科学依据。
不同免疫检查点抑制剂联合治疗
ICBs单药治疗有效率有限,部分研究探索了ICBs间联合用药的方案,主要包括PD-1联合CTLA-4抗体的治疗。NGR GY003Ⅱ期临床研究(NCT02498600)[23]显示,100例复发性卵巢癌被分配接受纳武单抗联合伊匹木单抗治疗(n=50)和纳武单抗单药治疗(n=49),两组相比ORR及PFS均有显著改善(ORR:12.2% vs. 31.4%,中位PFS:2个月 vs. 3.9个月),OS没有统计学差异(中位OS:21.8个月 vs. 28.1个月);3级以上不良反应分别为27例(55.1%)和34例(66.7%)。但PD-L1的表达与各组疗效无相关性。总体而言,ICBs联合应用比单药治疗ORR提高,但对大部分患者还是无治疗响应,并且OS和PFS的提高有限,应寻找更好的策略。见表1。
卵巢癌肿瘤免疫微环境特点
及对免疫治疗的影响
HGSC组织中PD-L1低水平表达
HGSC肿瘤微环境PD-L1的表达存在异质性;PD-L1表达情况与免疫治疗是否有效的相关性在卵巢癌中仍存在争议;不同抗体、不同评价标准、不同检测阈值下,PD-L1表达阳性定义不同。JAVELIN Solid Tumor研究[24]对125例复发性卵巢癌患者肿瘤细胞上PD-L1表达进行检测,TC PD-L1≥1%患者占比为60.8%,而≥5%患者占比为25.6%,但未证实肿瘤细胞PD-L1表达水平与ICBs反应之间有相关性。KEYNOTE-100研究[6]中CPS≥1占比为52.4%,≥10占比为21.8%,CPS与免疫治疗ORR存在相关性。HGSC PD-L1表达水平明显低于免疫治疗应答较好的实体瘤,如黑色素瘤(92%)、肾细胞癌(67%)和非小细胞肺癌(50%)。因此,HGSC如何统一PD-L1的表达的检测,探究其与免疫治疗的相关性仍需探索。
肿瘤突变负荷低
基因组不稳定性是肿瘤的一个标志,通常与肿瘤突变负荷(TMB)密切相关。高TMB是响应ICBs的关键生物标志物之一,因为它增加了新抗原的数量,从而提高了肿瘤免疫原性,与其他高突变负荷的实体瘤如黑色素瘤和非小细胞肺癌相比,上皮性卵巢癌TMB较低(中位TMB为3.6突变/百万碱基,仅2.1%患者存在TMB>20突变/百万碱基)[25],这可能是其对ICBs应答不佳的原因之一。
肿瘤浸润T淋巴细胞(tumor infiltrating lymph cells,TILs)
在包括黑色素瘤、非小细胞肺癌、肾癌、食管癌、头颈肿瘤等多个实体瘤的临床及转化研究中均显示免疫治疗应答患者存在更高比例的肿瘤浸润淋巴细胞[26-30],包括肿瘤区域及肿瘤边缘间质区域。肿瘤边缘间质的CD8+T淋巴细胞密度是预测转移性黑色素瘤免疫治疗应答的最有效指标[26]。虽然HGSC对于免疫治疗的应答属于“冷肿瘤”,但确是较早被证实存在T淋巴细胞浸润的实体瘤,肿瘤上皮内CD3+或CD8+ TILs 与患者生存期延长相关[31]。CD8+上皮内TILs是抗肿瘤免疫反应的重要组成部分,在肿瘤上皮内TILs识别抗原,表达T细胞受体激活的标志(NFAT2c)、增殖标志物(Ki-67),呈现细胞毒性(分泌颗粒酶B),分泌效应细胞因子如白细胞介素-2、γ干扰素和肿瘤坏死因子,而后耗竭(PD-1)。具有上皮内CD8+ TILs的患者长期生存表明存在一定机制使得这些T细胞在肿瘤内维持抗肿瘤功能,这是研究的方向之一。研究者根据淋巴细胞浸润情况将上皮性卵巢癌分为3种不同免疫表型[32]:(1)T细胞炎性浸润型肿瘤,具有显著的CD8+ T细胞浸润和炎症特征,除了上皮内TILs外,这些肿瘤还显示出高表达的T细胞趋化因子以及γ干扰素信号通路的活化。(2)免疫排斥型肿瘤,缺乏上皮内TILs,但在肿瘤周围有丰富的T细胞,这些肿瘤的特征是高表达的免疫抑制分子(如PD-L1)和髓样细胞趋化因子,这些分子可能会阻止T细胞进入肿瘤。(3)免疫沙漠型肿瘤,几乎完全缺乏T细胞浸润,缺乏适应性免疫反应,通常伴随低水平的T细胞趋化因子和γ干扰素信号通路。针对不同免疫表型采用的免疫治疗策略不同,抗PD1单抗可能仅适用于肿瘤微环境PD-L1表达、PD1+ TIL情形[33]。
肿瘤微环境中的免疫抑制细胞
上皮性卵巢癌的肿瘤微环境中存在多种免疫抑制细胞,包括调节性T细胞(Tregs)、骨髓来源抑制性细胞(MDSCs)和肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)。这些细胞通过分泌抑制性细胞因子和直接抑制效应T细胞的功能来促进肿瘤生长和免疫逃逸。特别是Tregs和MDSCs在上皮性卵巢癌中大量存在,并与差的预后相关。因此,靶向这些免疫抑制细胞或其分泌的因子可能是提高ICBs疗效的一个潜在策略。
卵巢癌免疫检查点抑制剂存在的挑战及
未来研究方向
总体而言,卵巢癌中ICBs治疗单药或现有联合治疗方案效果均不理想。由于肿瘤发生免疫逃逸特征,现有条件下,免疫治疗在卵巢癌中不可能是一个普适的治疗方法,目前的临床研究设计均未能准确识别获益患者,并对这部分人群进行纵向分析。未来的研究应集中在以下几个方面:(1)探索免疫治疗获益人群。(2)深入理解卵巢癌肿瘤免疫微环境。利用先进的技术手段,如空间转录组学和多组学分析,进一步揭示肿瘤微环境的复杂性和动态变化,解析免疫细胞-肿瘤细胞和免疫细胞-间质细胞之间的相互作用。包括ICBs在内的免疫治疗或可调节卵巢癌肿瘤免疫微环境。在一项Ⅱ期临床研究的转化研究中,研究者对比卵巢癌新辅助化疗联合免疫治疗前后的标本发现,ICBs治疗在化疗基础上可进一步诱导CD8+PD1+T细胞(具有抗原识别能力的细胞毒性T细胞)浸润肿瘤癌巢,且治疗后癌巢内CD8+PD1+T细胞密度的增加与患者总生存改善具有相关性[34]。另一方面,患者治疗前的基因或免疫状态可预测免疫治疗应答效果。研究发现,治疗前CD8B/FOXP3基因比例上调、内皮细胞相关基因表达下调,可准确预测24个月免疫治疗应答率。而CD8+T细胞与CD39+Treg细胞的比例上调与新辅助化疗联合免疫治疗患者的总生存相关,靶向CD39+Treg细胞或可克服ICBs的耐药。(3)开发新型免疫调节剂。针对HGSC肿瘤发生的免疫逃逸特征,找出内在的机制,开发针对性的免疫调节剂,以大幅提高HGSC免疫治疗疗效。(4)精准临床研究设计。临床试验设计和患者分层:设计合理的临床试验,注重患者的分层和个体差异,以提高新疗法的临床应用成功率。结合患者的基因组和免疫表型特征,制定个体化的治疗方案,提高治疗的精准性和有效性。
略











 苏公网安备32059002004080号
苏公网安备32059002004080号


