
近年来,抗体偶联药物(ADC)真正实现了精准给予靶病灶高效细胞毒药物,目前已在多个实体瘤领域取得突破性进展,并已进入临床应用。 德曲妥珠单抗是肺癌领域首个获批的ADC药物,为经治HER2突变晚期非小细胞肺癌(NSCLC)带来了全新选择。目前有多项有关HER2变异的临床研究正在开展中,期待研究结果为ADC药物造福肺癌患者提供更多数据和参考。
【肿瘤资讯-HER2大师课】特邀哈尔滨医科大学附属肿瘤医院于雁教授解读HER2突变肺癌领域的最新突破与未来方向。
内科教研室主任 博士生导师
中国临床肿瘤学会(csco)理事
黑龙江省抗癌协会常务理事
黑龙江省医学发展基金理事
黑龙江省医学会理事会理事
中国抗癌协会化疗专业委员会常委
中国临床肿瘤学会肿瘤支持与康复治疗委员会常委
中国医促进会肿瘤肿瘤舒缓治疗学分会常委
中国医药教育协会肺部肿瘤专业委员会常委
中国抗癌协会癌症康复与姑息治疗委员会常委
中国抗癌协会肺癌专业委员会委员
中国抗癌协会肿瘤异质性与个体化治疗专委会常委
黑龙江省医师协会肺癌专业委员会主任委员
黑龙江省医学会癌症姑息息治疗委员会主任委员
黑龙江省抗癌协会癌症康复与姑息治疗专业委员会主任委员
黑龙江省抗癌协会肿瘤药物临床研究专委会候任主任委员
中华转移性肿瘤杂志编委
中国肿瘤临床与康复杂志编委
德曲妥珠单抗破局HER2突变NSCLC,
成为肺癌领域首个获批的ADC
目前全球范围内获批准的ADC药物约有16种,其中HER2 ADC德曲妥珠单抗是目前唯一在全球及国内肺癌领域获批的ADC药物。在实体瘤领域,德曲妥珠单抗已获得了FDA批准的5项适应症,分别为HER2阳性乳腺癌、HER2低表达乳腺癌、HER2突变NSCLC、HER2 阳性局部晚期或转移性胃或食管胃结合部腺癌、HER2过表达实体瘤。研究结果为德曲妥珠单抗用于HER2晚期实体瘤治疗提供了研究证据。
DESTINY-Lung01/02多次复现,
德曲妥珠单抗疗效/安全性双优
DESTINY-Lung01是一项开放标签、多中心、双队列、II期临床试验,旨在评估6.4mg/kg德曲妥珠单抗用于HER2突变晚期NSCLC,及5.4 mg/kg和6.4mg/kg德曲妥珠单抗用于HER2过表达晚期NSCLC的有效性和安全性。
既往发表于NEJM上的结果显示,6.4mg/kg德曲妥珠单抗在91例HER2突变晚期NSCLC中显示出优异的抗肿瘤活性。确认的客观缓解率(ORR)为55%,中位缓解持续时间(DoR)为9.3个月,中位无进展生存期(PFS)为8.2个月,中位总生存期(OS)为17.8个月[1]。后续的更新数据显示[2],在HER2突变NSCLC总人群中,德曲妥珠单抗的ORR为54.9%,中位DoR为10.6个月,中位PFS为8.2个月,中位OS为18.6个月。基线有/无CNS转移患者和接受≤2/>2线治疗患者的疗效数据与总人群一致。
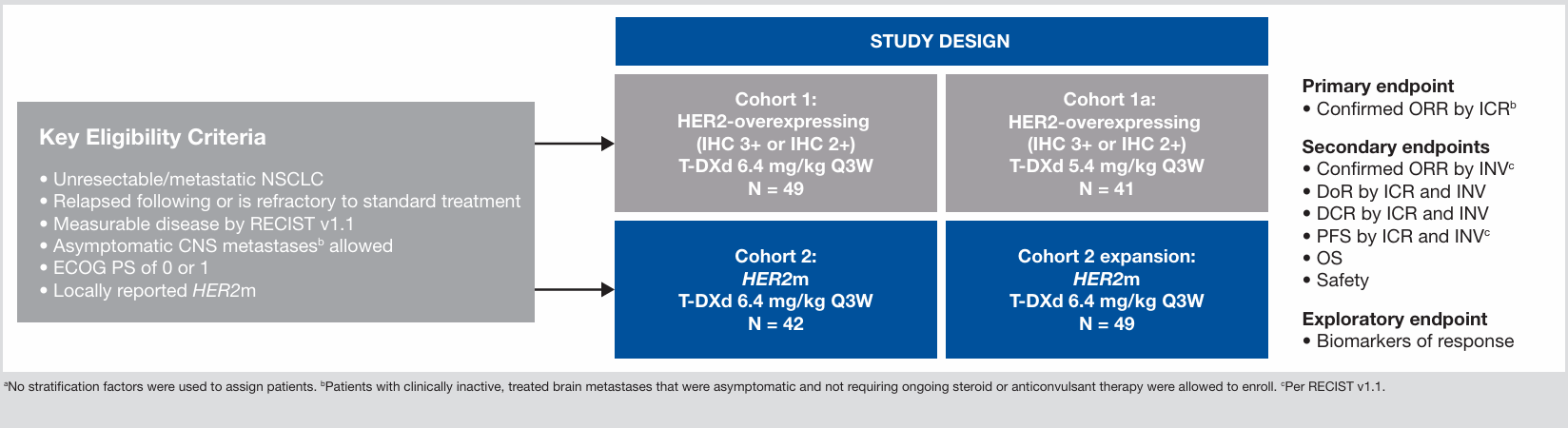
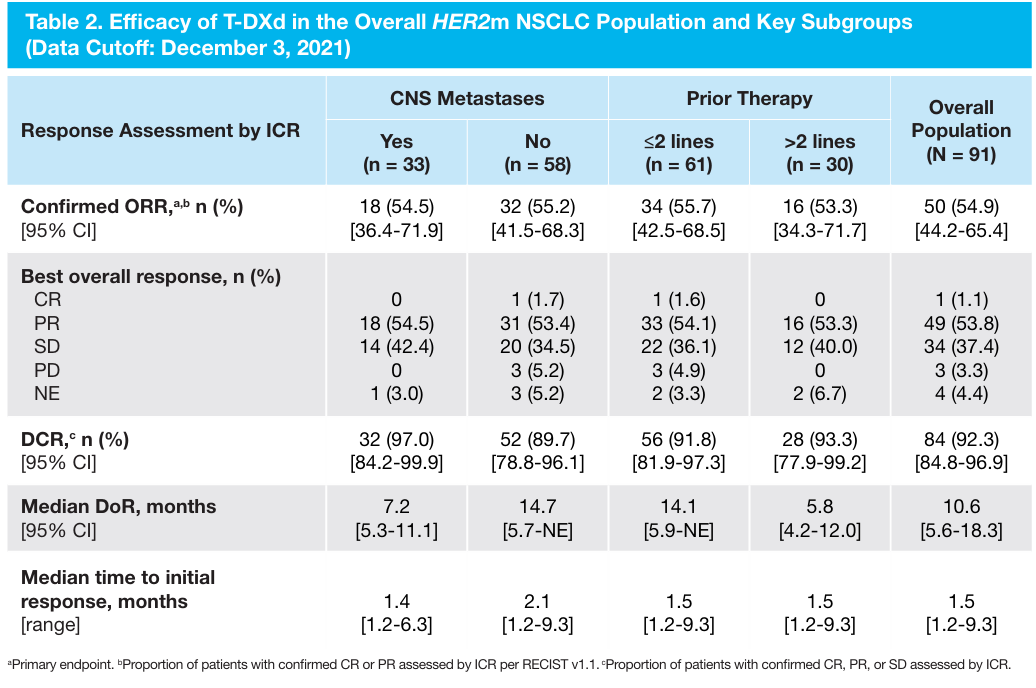 图1 DESTINY-Lung01研究设计和研究结果[2]
图1 DESTINY-Lung01研究设计和研究结果[2]
DESTINY-Lung02是一项多中心、全球化、剂量盲法、非对照II期临床研究,经治HER2突变晚期NSCLC按2:1比例随机分配接受5.4mg/kg和6.4mg/kg(Q3W)德曲妥珠单抗。基于中期分析结果[3],FDA加速批准了5.4mg/kg德曲妥珠单抗用于HER2突变晚期NSCLC后线治疗的适应症。
发表于JCO的更新结果显示[4],近40%的患者接受2线以上的治疗,5.4mg/kg、6.4mg/kg德曲妥珠单抗的ORR分别为49%、56%,DCR分别为93.1%、92%。结果证实,降低剂量的德曲妥珠单抗仍显示出深度、持久的应答和抗肿瘤活性。由BICR评估确认的ORR(主要终点)达到并超过了预设的统计学假设值。安全性结果显示,两剂量组安全性均整体可控,5.4mg/kg德曲妥珠单抗的安全性更优。药物相关ILD发生率减少一半,且大多数事件为1或2级。研究结果支持,已批准5.4mg/kg德曲妥珠单抗的有效性和安全性。
最终分析旨在评估更长随访时,5.4mg/kg、6.4mg/kg德曲妥珠单抗用于HER2突变晚期NSCLC的有效性、安全性及患者报告结局(PRO)[5]。基线特征显示,5.4mg/kg、6.4mg/kg组亚裔人群分别占比61.8%、60%,分别有73.5%、78%的患者既往接受过抗PD-1/PD-1单抗,基线伴中枢神经系统(CNS)转移患者分别占比34.3%、44%。结果显示,5.4mg/kg、6.4mg/kg德曲妥珠单抗的ORR分别为50%、56%,中位DoR分别为12.6个月、12.2个月,DCR分别为93.1%、92%;中位PFS分别为10.0个月、12.9个月,中位OS分别为19个月、17.3个月。安全性结果仍提示,低剂量组安全性更优。RPO结果提示,持续接受德曲妥珠单抗的患者可维持良好的总体健康相关生命质量(HRQoL),5.4mg/kg德曲妥珠单抗具有更优获益-风险比。
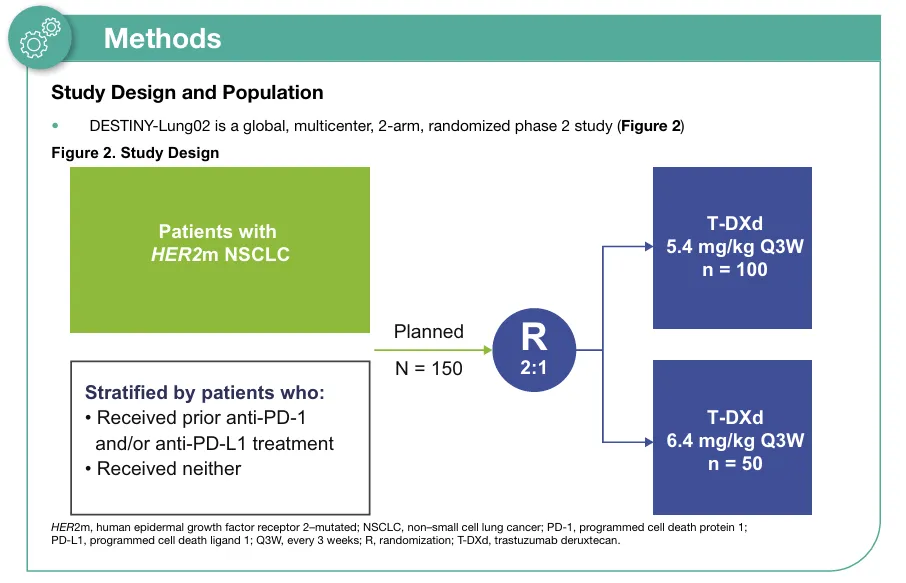
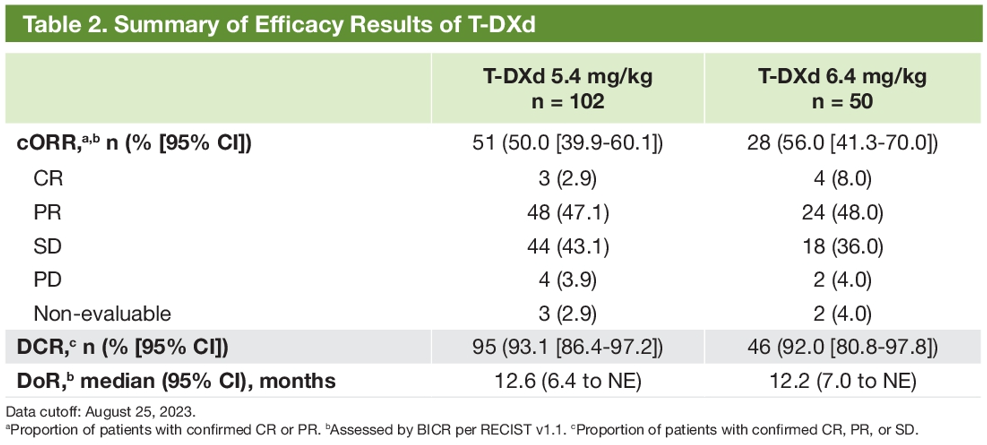 图2 DESTINY-Lung02研究设计及最终分析结果
图2 DESTINY-Lung02研究设计及最终分析结果
德曲妥珠单抗有望打破HER2突变晚期
NSCLC脑转移困境
已公布DESTINY-Lung01/02汇总分析显示[6],德曲妥珠单抗具有良好的颅内抗肿瘤活性,5.4mg/kg、6.4mg/kg德曲妥珠单抗确认的颅内ORR分别为50%、30%,颅内DCR分别为92.9%、73.3%,中位颅内DoR分别为9.5个月、4.4个月。在有可测量脑转移病灶的两组患者中,分别有86%、78%的患者观察到自基线起脑转移灶的减少作为最佳总缓解。
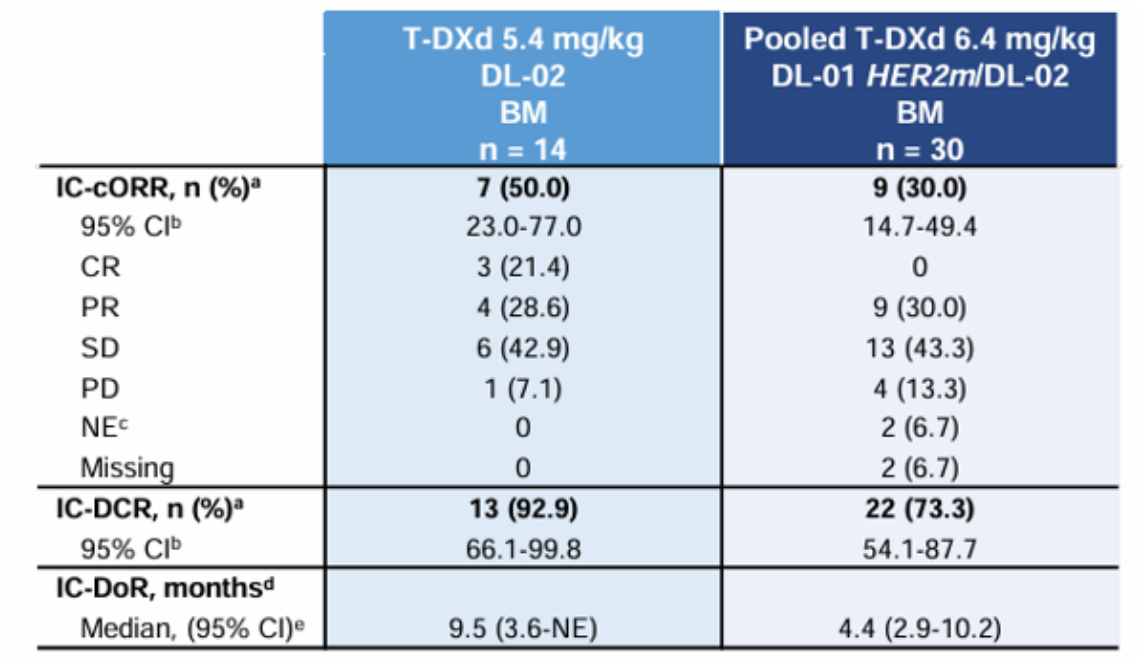 图3 DESTINY-Lung01/02汇总分析结果
图3 DESTINY-Lung01/02汇总分析结果
DESTINY-Lung05:
中国人群与全球人群疗效、安全性一致
DESTINY-Lung05是一项开放标签、单臂、II期临床研究[7],旨在评估5.4mg/kg德曲妥珠单抗用于至少一线治疗期间或治疗进展后HER2突变转移性NSCLC中国患者的疗效和安全性。初步结果显示,由ICR评估确认的ORR为58.3%,中位DoR仍未达到,DCR为91.7%,中位PFS仍未达到,12个月PFS率为55.1%。由研究者评估确认的ORR为58.3%,中位DoR为9个月,DCR为93.1%,中位PFS为10.8个月,12个月PFS率为39.7%。安全性结果与全球人群一致,ILD发生率低,大多数为低级别,未出现新的安全性信号。

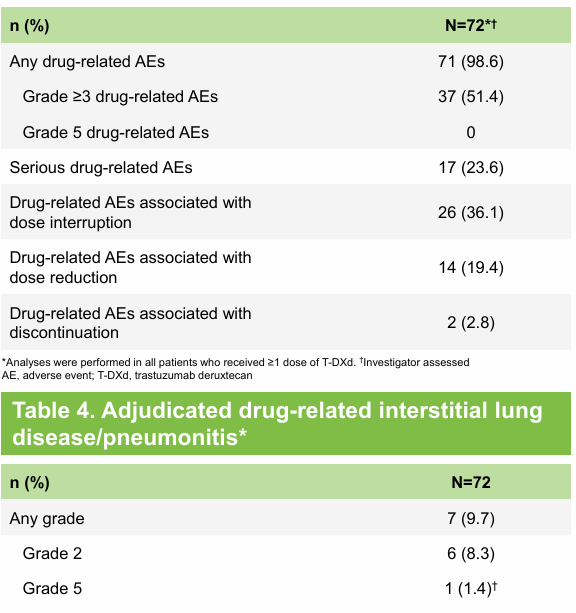 图4 DESTINY-Lung05疗效结果
图4 DESTINY-Lung05疗效结果
点亮希望,ADC药物在NSCLC领域
展现广阔前景
针对HER2变异,目前多个产品都在积极布局I期、II期和III期临床研究,旨在探索新型药物或联合疗法用于后线、一线治疗的疗效,涉及到HER2过表达实体瘤、HER2突变NSCLC、HER阳性实体瘤等领域。以目前未被满足的临床需求为出发点,由后线向一线治疗领域推进是未来的主要方向之一,正在开展的研究包括DESTINY-Lung04和U106研究。DESTINY-Lung04是一项III期研究,旨在评估德曲妥珠单抗对比帕博利珠单抗+含铂双药一线治疗HER2突变晚期NSCLC的疗效和安全性。DS8201-A-U106是一项两部分、开放标签、多中心Ib期临床研究,旨在评估德曲妥珠单抗+帕博利珠单抗用于不同HER2变异状态局部晚期或转移性NSCLC或乳腺癌的疗效和安全性。
联合疗法的潜在机制:德曲妥珠单抗用于HER2突变晚期NSCLC已获得FDA、NMPA的批准,未来会有新的探索。以ADC为基础的联合治疗策略有靶向/化疗、联合分子靶向药物、联合抗血管生成药物。主要的机制包括,①与化疗/靶向联合:可抑制细胞周期和DNA损伤修复,靶向治疗可能上调肿瘤细胞表面的抗原(ADC靶点)表达,二者与ADC联合可产生协同作用;②联合抗血管生成药物:可使肿瘤血管正常化,促进ADC药物在肿瘤中的递送和分布,两种疗法联合或可进一步增强抗肿瘤疗效;③ADC的细胞毒载荷可通过不同机制增加免疫治疗疗效,包括巨噬细胞重编程、T细胞记忆生成、树突状细胞和T细胞激活以及增加PD-L1表达,促进免疫监测等;④ADC与靶向疗法联合可同时抑制多种致癌信号通路,或双重阻断同一特定通路,从而增强抑制作用,增强抗肿瘤活性[8]。
安全性管理与优化:不同ADC药物的毒性特征不同,大部分ADC相关不良事件为1-3级,安全性可控。影响ADC毒性的因素主要包括“与靶点相关的、对非肿瘤组织的毒性”(on-target,off-tumour)和“与脱靶相关的、对非肿瘤组织的毒性”(off-target,off-tumour)两方面。充分认识ADC药物的毒副反应和产生机制(包括靶点毒性、Fc受体驱动的毒性、胞饮作用驱动的毒性、脱靶相关毒性),有希望进一步助力ADC药物更加高效低毒。
可能的耐药机制:ADC药物的潜在耐药机制正在探索之中,通常与抗体或有效载荷耐药相关。整体ADC复合物的耐药性可通过物理屏障(例如结合位点屏障)而产生;其他因素,比如药物的吸收、分布、代谢和排泄行为、DAR 值、剂量和给药方式也可能导致耐药。与有效载荷耐药相关的机制可能包括:有效载荷靶点的改变有可能阻止载荷有效发挥细胞毒作用;PLK1等抗凋亡蛋白的上调可阻断肿瘤细胞的凋亡途径;促进肿瘤生长等异常信号通路的激活如PI3K/AKT等。与抗体耐药相关的机制包括:在有效载荷释放之前,ADC被内涵体回收可降低ADC效率;因突变/表达减少导致抗原的丢失,而导致抗原与抗体结合的减少;ADC内化至微囊蛋白-1阳性突触影响溶酶体运输导致的内化紊乱,可能影响内吞效率等[9]。
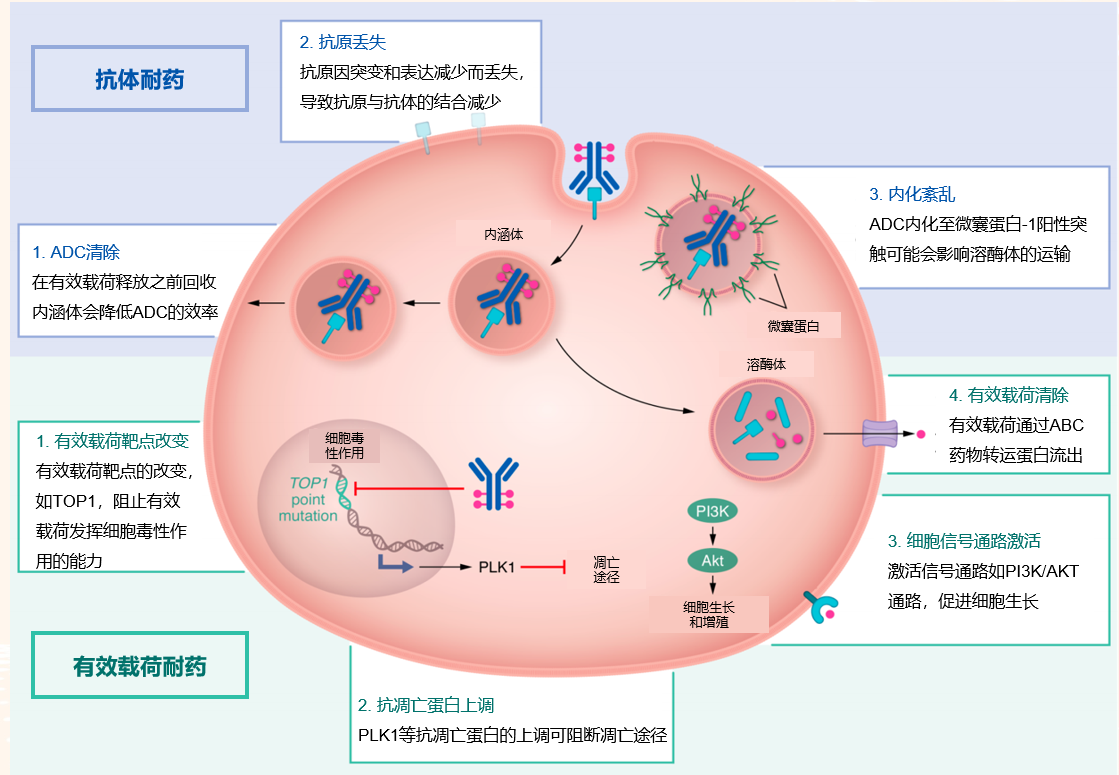 图5 耐药机制模式图
图5 耐药机制模式图
总结
ADC在肿瘤治疗中呈现出蓬勃发展的趋势,相信未来在不同实体瘤领域,ADC药物都将是优选的方案。德曲妥珠单抗作为首个批准用于HER2突变晚期NSCLC的精准疗法,取得了从零到一的突破。希望未来HER2 ADC在临床实践中大展身手,为包括脑转移在内的患者带来更好的疗效和获益。临床应用时,首先我们需要选择最合适的患者给予德曲妥珠单抗治疗;第二,我们需要更多的研究进一步验证其疗效和安全性;第三,临床需要密切观察患者疗效和毒副反应,保证患者得到最佳管理。
[1]Li BT, Smit EF, Goto Y, et al.DESTINY-Lung01 Trial Investigators. Trastuzumab Deruxtecan in HER2(ERBB2)-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2022 Jan 20;386(3):241-251. doi: 10.1056/NEJMoa2112431. Epub 2021 Sep 18.
[2]Bob T Li,et al. ESMO 2022. Abstract : 976P.
[3]Goto K, Sang-We K, Kubo T, et al: Trastuzumab deruxtecan (T-DXd) in patients (Pts) with HER2-mutant metastatic non-small cell lung cancer (NSCLC): Interim results from the phase 2 DESTINY-Lung02 trial. Ann Oncol 33:S1422, 2022 (abstr LBA55).
[4]Goto K, Goto Y, Kubo T, et al. Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non-Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial. J Clin Oncol. 2023 Nov 1;41(31):4852-4863. doi: 10.1200/JCO.23.01361. Epub 2023
[5]Trastuzumab deruxtecan (T-DXd) in patients with HER2-mutant metastatic non–small cell lung cancer (mNSCLC): Final analysis results of DESTINY-Lung02. Abstract 8543. 2024 ASCO.
[6]Li BT, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2(ERBB2)-mutant (HER2m) metastatic nonesmall cell lung cancer (NSCLC) with and without brain metastases (BMs):Pooled analyses from DESTINY-Lung01 and DESTINYLung02. 2023 ESMO 1321MO.
[7]Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2 mutant non-small cell lung cancer (NSCLC): primary analysis from the Phase 2 DESTINY-Lung05 (DL-05) trial. Abstract CT248/7,2024 AACR.
[8]Fuentes-Antrás J, et al. Trends Cancer. 2023 Apr;9(4):339-354.
[9]Chang HL, et al. J Clin Invest. 2023 Sep 15;133(18):e172156. 2. Dumontet C, et al. Nat Rev Drug Discov. 2023 Aug;22(8):641-661
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


