
德曲妥珠单抗是HER2 ADC领域的典范,已先后获得全球和中国NMPA的批准,成为全球范围内首个用于HER2突变晚期非小细胞肺癌(NSCLC)的精准疗法,实现了精准靶向HER2“破冰”的重大突破,且有望突破伴脑转移患者的治疗困境。
【肿瘤资讯-HER2大师课】特邀哈尔滨医科大学附属肿瘤医院于雁教授解读HER2 ADC德曲妥珠单抗在NSCLC治疗中的新突破。
中国临床肿瘤学会 (csco)理事
黑龙江省抗癌协会常务理事
黑龙江省医学发展基金理事
中国抗癌协会化疗专业委员会常委中国临床
中国抗癌协会肺癌专业委员会委员
中国临床肿瘤学会肿瘤支持与康复治疗委员会常委
中国医疗保健国际交流会肿瘤姑息治疗与人文关怀委员会常委
中国医药教育协会肺部肿瘤专业委员会常委
中国抗癌协会癌症康复与姑息治疗委员会委员
黑龙江省医师协会肺癌专业委员会主任委员
黑龙江省医学会癌症姑息息治疗委员会主任委员
黑龙江省抗癌协会癌症康复与姑息治疗专业委员会主任委员
黑龙江省医学会肺癌专业委员会副主任委员
黑龙江省保健国际交流促进会肺癌预防和规范化诊疗分会副主任委员
ADC药物:高效、低毒的抗癌导弹
ADC药物:魔法子弹
100多年前,德国科学家Paul Ehrlich首次提出魔法子弹“选择性地向目标细胞输送毒性药物,而避免伤害人体正常细胞”的设想。
ADC药物发展分为三个阶段:
第一个阶段从提出理念到多种技术实现逐一突破,比如单克隆抗体的人源化、载药的选择等,是ADC药物概念实现的阶段。在此期间首个ADC药物Mylotarg于2000年上市,主要用于血液系统恶性肿瘤的治疗。
第二个阶段解决了药物异质性和不稳定性等问题,是ADC药物结构不断优化的阶段。在这期间Mylotarg因安全性问题退市,并在调整剂量后重新获得上市。
第三阶段ADC药物真正开始进入临床应用,新技术和新的偶联形式不断涌现。在此期间,新一代HER2 ADC德曲妥珠单抗在中国获批上市用于乳腺癌。
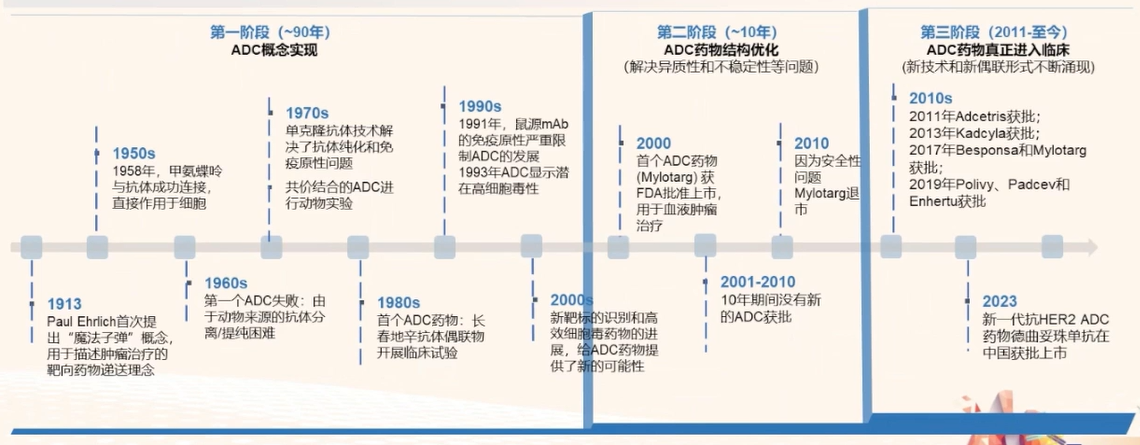 图1 ADC发展历史
图1 ADC发展历史
ADC药物:精准与强效的完美结合
抗体、连接子、载药是ADC药物的三大组分,ADC能精准识别并靶向表达特异性抗原的肿瘤细胞,在肿瘤细胞内被特异性裂解后释放细胞毒药物。与“杀敌一千,自损八百”的化疗相比,ADC药物即精准“导弹”在达到靶病灶后才发挥作用,可减少对正常组织和细胞的大规模杀伤。而靶向疗法缺乏强效细胞毒性,容易耐药;有些靶点突变丰度不高,靶向疗法疗效差。相比而言,ADC药物同时突破两种传统疗法的局限性,通过单抗靶向作用,高效杀伤肿瘤细胞的同时,拓宽了最低有效剂量和最大耐受剂量的治疗窗,是精准和强效的完美结合。
德曲妥珠单抗具有独特作用机制
德曲妥珠单抗由精准靶向HER2曲妥珠单抗、肿瘤选择性可裂解四肽连接子和高活性细胞毒载药偶联组成。特异性抗体为精准靶向HER2、保留生物学活性的曲妥珠单抗。药物抗体比(DAR)约为8,且药物稳定而均一。特异性抗体与特异性抗原结合后,ADC被内吞进入肿瘤细胞,连接子被溶酶体酶迅速裂解并释放载药。DAR≈8 能保证更多细胞毒载药进入肿瘤细胞,增强杀伤效力。连接子稳定性好,脱落率极低,进入肿瘤细胞易被溶酶体酶特异性裂解。载药为新型拓扑异构酶I抑制剂DXd,其抗肿瘤活性是普通化疗药的100-1000倍,且能避免与紫杉类或微管抑制剂类药物交叉耐药。游离DXd膜通透性高,具有高效旁观者效应,可透过细胞膜,杀伤邻近异质性肿瘤细胞,而且游离DXd半袁期短,约1.37h,没有特别的组织滞留,能保证系统用药安全性。
ADC药物机制
①核心作用机制:ADC药物通过结合抗原、内化进入细胞,主要通过溶酶体释放小分子细胞毒药物,扰乱癌细胞的DNA及微管蛋白功能,而发挥抗肿瘤效应。
②ADC通过旁观者效应,能杀死肿瘤周围的异质性肿瘤细胞和转移瘤细胞(无论是否携带靶抗原)。只有具有较好细胞膜通透性的载药才能产生旁观者效应。
③ADC药物介导肿瘤免疫效应:ADC的抗体成分与免疫效应细胞结合,引发抗肿瘤免疫,包括补体依赖的细胞毒性(CDC)、抗体依赖的细胞介导的细胞毒性作用(ADCC效应)、抗体依赖的细胞介导的吞噬作用(ADCP)。
④ADC药物抑制下游信号通路:ADC的抗体成分自身可靶向抗原,可以干扰目标受体的生物学功能,抑制下游信号传导以抑制肿瘤生长。
HER2变异在NSCLC中具有独特致癌机制
HER2受体是一种由1255个氨基酸组成、185kDa的单次跨膜糖蛋白,由HER2(也称ERBB2)基因编码。HER2基因是一种原癌基因,位于17号染色体的长臂(17q12-21.32),与HER1(EGFR)、HER3及HER4组成HER家族,编码跨膜酪氨酸激酶受体蛋白。HER2在HER家族中十分独特,无已知配体,需要与其它HER家族蛋白形成异源二聚体、或在过表达条件下自组装成配体非依赖型的同源聚体,激活下游多种信号通路,比如PI3K/AKT/mTOR、MAPK、JAK2/STAT3等通路。
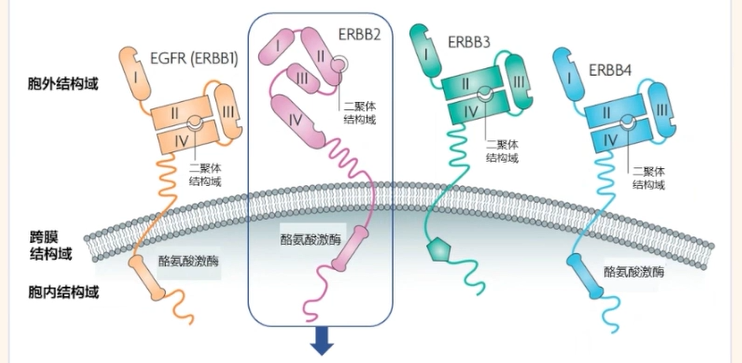 图2 作用机制示意图
图2 作用机制示意图
HER2过表达或异常激活与多种癌症发生高度相关。HER2参与形成的异源二聚体中,以EGFR/HER2和HER2/HER3复合物的生理功能最为重要、与肿瘤发生最为相关。一方面,HER2可能抵抗EGFR激活后的快速内吞作用和降解,增强下游磷酸化信号转导以促进细胞生长和增殖;另一方面,HER3可催化受损酪氨酸激酶结构域,与HER2形成异源二聚体,导致非结构化受体尾部磷酸化,并激活下游信号转导。
HER2突变晚期NSCLC的临床困境
发生率低,预后差,临床治疗棘手
HER2和EGFR同属于HER家族成员。在晚期NSCLC治疗中,EGFR突变晚期NSCLC的诊疗(包括耐药后的治疗)比较程序化,广为熟知;HER2突变NSCLC的临床治疗刚开始起步。HER2突变在晚期NSCLC中的发生率较低,约为2.3%;在亚洲人群和西方人群中的发生率无较大差别。不同于EGFR敏感突变在东西方人群中发生率差异较大。HER2突变NSCLC容易发生脑转移,诊断时和治疗过程中分别约有19%、28%的患者会发生脑转移。
化疗、免疫、HER2 TKI等
在HER2突变NSCLC患者中疗效有限
既往研究显示,化疗方案、免疫治疗在HER2突变NSCLC疗效差,有效率约不到10%。多项早期临床研究显示,大部分小分子HER2 TKI在HER2突变NSCLC中的有效率约为7%-12%,中位PFS约为3-5个月,仅吡咯替尼在一项II期研究中的有效率为30%,中位PFS为6.9个月。II期MyPathway研究显示,曲妥珠单抗+帕妥珠单抗在HER2突变NSCLC中的ORR为21%[1,2]。整体可见,既往各类疗法的HER2突变晚期NSCLC疗效不佳,亟需新型创新疗法。
HER2 ADC德曲妥珠单抗
率先在NSCLC领域取得突破
目前全球范围内获批准的ADC药物约有16种,其中HER2 ADC德曲妥珠单抗是目前唯一在全球及中国肺癌领域获批的ADC药物。多项研究结果不断研究证据,为德曲妥珠单抗用于临床提供了有力支持。
DESTINY-Lung01
DESTINY-Lung01研究是一项开放标签、多中心、双队列II期临床研究,旨在评估德曲妥珠单抗治疗HER2过表达(队列1)和HER2突变(队列2)转移性NSCLC的疗效和安全性。
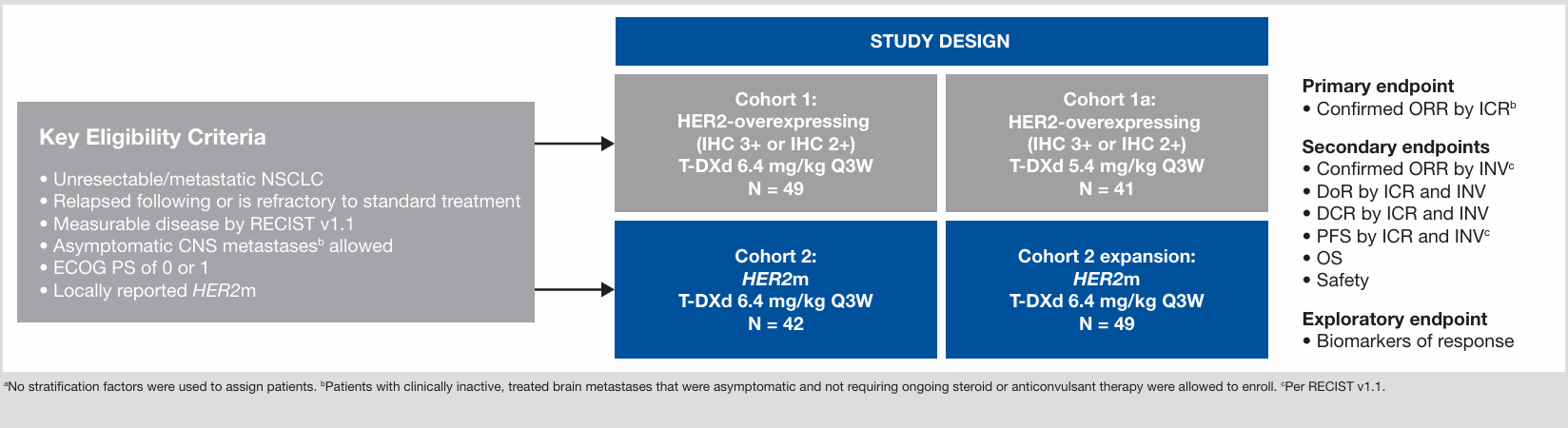 图3 DESTINY-Lung01研究设计
图3 DESTINY-Lung01研究设计
2022 ESMO大会上更新的DESTINY-Lung01数据显示,在HER2突变NSCLC总人群中,德曲妥珠单抗的ORR为54.9%,中位DoR为10.6个月,中位PFS为8.2个月,中位OS为18.6个月。基线有/无CNS转移患者和接受≤2/>2线治疗患者的疗效数据与总人群一致[3]。
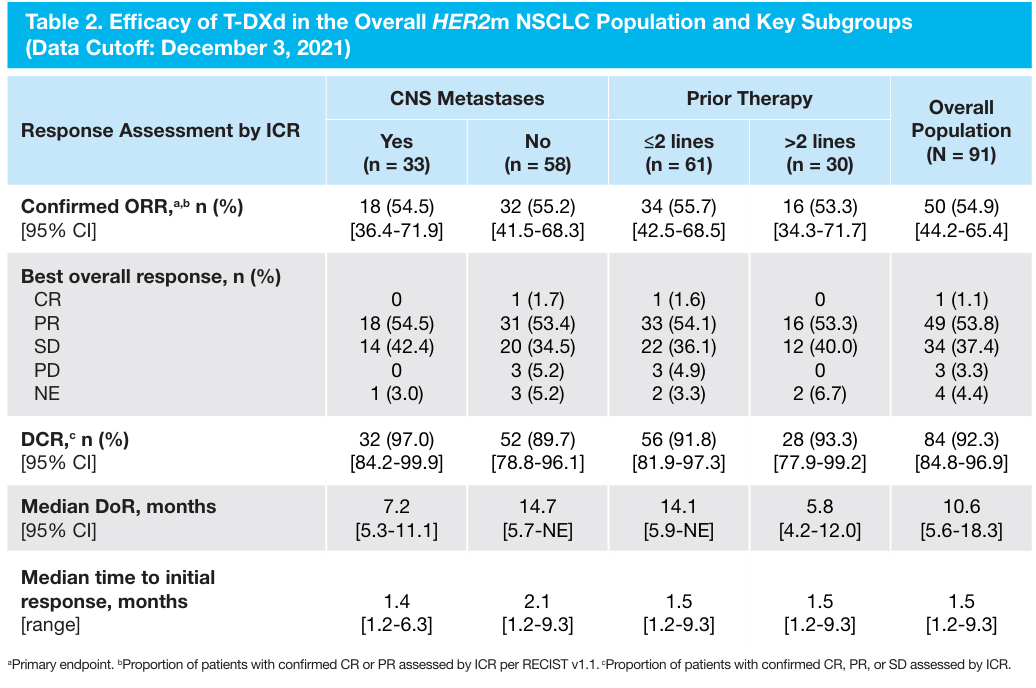 图4 总人群和关键亚组研究结果
图4 总人群和关键亚组研究结果
安全性分析显示,46% 的患者发生 ≥3 级的药物相关不良事件,最常见的事件是中性粒细胞减少症(19%),26% 的患者发生药物相关ILD[3]。最早开展的DESTINY-Lung01研究结果支持后续开展的优化剂量DESTINY-Lung02临床研究。
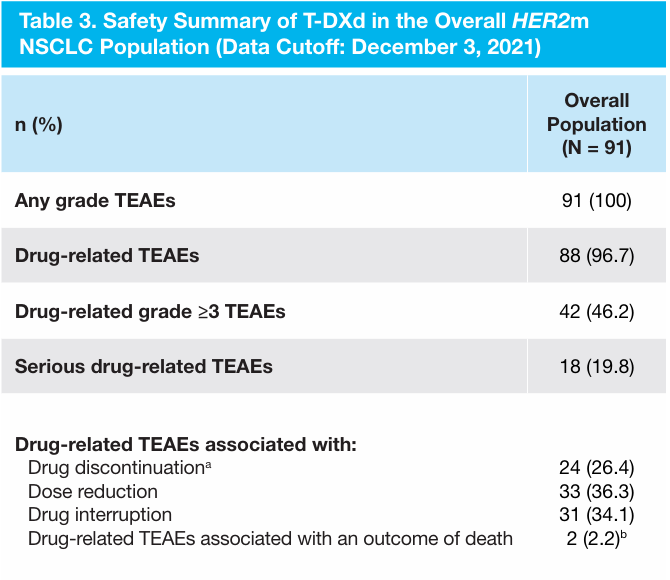 图5 安全性分析
图5 安全性分析
DESTINY-Lung02
DESTINY-Lung02研究是一项多中心、全球化、剂量盲法、非对照II期临床研究,经治HER2突变晚期NSCLC按2:1比例随机分配接受5.4mg/kg和6.4mg/kg(Q3W)德曲妥珠单抗。
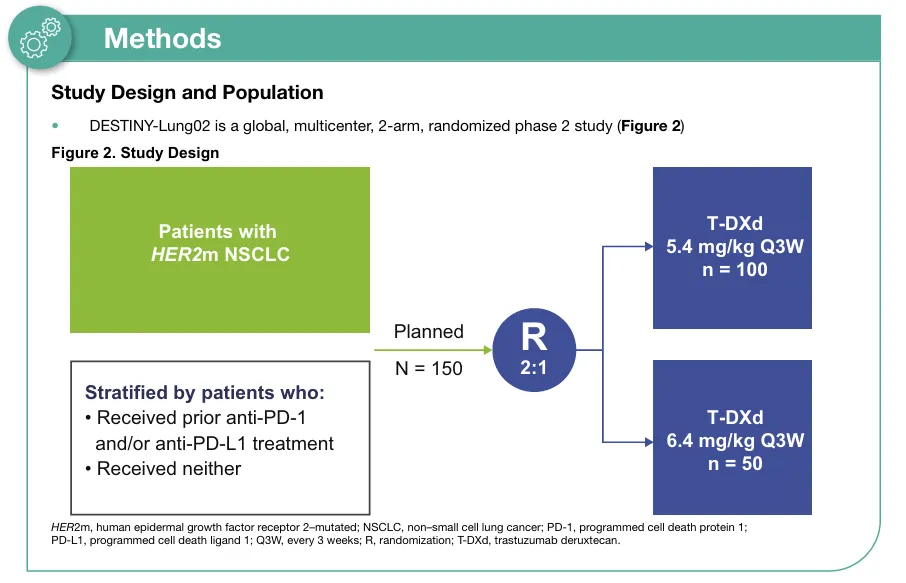 图6 DESTINY-Lung02研究设计
图6 DESTINY-Lung02研究设计
DESTINY-Lung02最终分析旨在评估经过更长时间随访后,5.4mg/kg和6.4mg/kg德曲妥珠单抗用于HER2突变晚期NSCLC的疗效、安全性及患者报告结局[4]。最终分析时,5.4mg/kg、6.4mg/kg组确认的ORR分别为50%、56%,两组的中位DoR分别为12.6个月、12.2个月,两组的DCR分别为93.1%、92%。两组的中位PFS分别为10.0个月、12.9个月,两组中位OS分别为19个月、17.3个月。从研究结果可见,5.4mg/kg德曲妥珠单抗与6.4mg/kg剂量疗效和获益相当,且安全性结果得到明显改善,尤其是间质性肺炎发生率明显减少。
德曲妥珠单抗有望突破脑转移治疗困境
DESTINY-Lung01/02汇总分析显示[5],5.4mg/kg和6.4mg/kg组患者确认的颅内ORR分别为50%和30%,颅内疾病控制率分别为92.9%和73.3%,中位颅内缓解持续时间分别达到9.5个月和4.4个月。
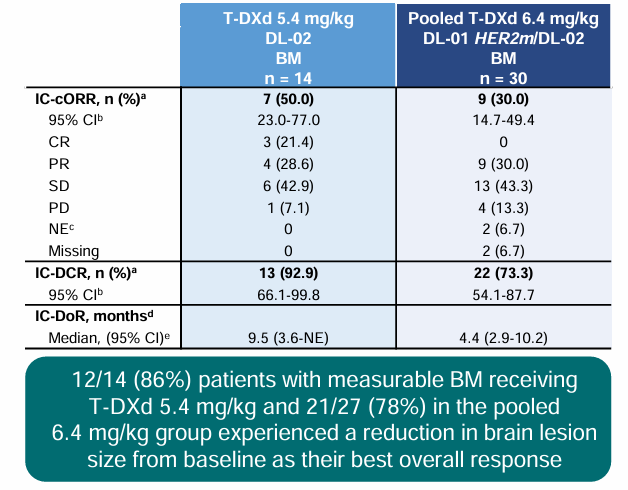 图7 汇总分析脑转移结果
图7 汇总分析脑转移结果
DESTINY-Lung05
DESTINY-Lung05是一项开放标签、单臂、II期临床研究[6],旨在评估5.4mg/kg德曲妥珠单抗用于至少一线治疗期间或治疗进展后HER2突变转移性NSCLC中国患者的疗效和安全性。已公布结果显示,由ICR评估确认的ORR为58.3%,中位DoR仍未达到,DCR为91.7%,中位PFS仍未达到,12个月PFS率为55.1%。由研究者评估确认的ORR为58.3%,中位DoR为9个月,DCR为93.1%,中位PFS为10.8个月,12个月PFS率为39.7%。安全性方面与全球人群一致。
 图8 DESTINY-Lung05疗效分析
图8 DESTINY-Lung05疗效分析
HER2 ADC药物研发和未来研究方向
基于已取得的结果,目前有针对一线和过表达领域的多项临床研究布局,包括DESTINY-Lung04、DESTINY-Lung03、U106等临床研究。目前有多家企业都在纷纷布局ER2 ADC药物研发及相关临床研究,期待未来更多临床研究结果的公布。未来的研究方向包括后线到一线治疗的推荐、ADC药物联合策略、ADC药物的耐药机制和安全性管理。
总结
ADC较传统化疗具有低毒、高效、精准等优势。HER2 ADC已在晚期NSCLC中已展现出令人鼓舞的优异疗效,且安全可控。德曲妥珠单抗于近日获得NMPA批准,成为全球和中国肺癌领域首个获批的ADC药物。ADC药物在NSCLC领域研究的序幕已经拉开,未来仍有更多方向值得探索。
[1]Tan AC, Tan DSW. J Clin Oncol. 2022 Feb 20;40(6):611-625;
[2]Offin M, et al. Cancer. 2019 Dec 15;125(24):4380-4387.
[3]LBA55-Trastuzumab deruxtecan (T-DXd) in patients (Pts) with HER2-mutant metastatic non-small cell lung cancer (NSCLC): Interim results from the phase 2 DESTINY-Lung02 trial. 2022 ESMO.
[4]Trastuzumab deruxtecan (T-DXd) in patients with HER2-mutant metastatic non–small cell lung cancer (mNSCLC): Final analysis results of DESTINY-Lung02. Abstract 8543. 2024 ASCO.
[5]Li BT, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2(ERBB2)-mutant (HER2m) metastatic nonesmall cell lung cancer (NSCLC) with and without brain metastases (BMs):Pooled analyses from DESTINY-Lung01 and DESTINYLung02. 2023 ESMO 1321MO.
[6] Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2 mutant non-small cell lung cancer (NSCLC): primary analysis from the Phase 2 DESTINY-Lung05 (DL-05) trial. Abstract CT248/7,2024 AACR.
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


