可测量残留病灶(MRD)与急性髓系白血病(AML)患者的复发风险和长期预后密切相关。除了其对预后有明显影响外,MRD也越来越多地被用于指导治疗决策,包括选择适合进行造血干细胞移植的患者、移植后维持治疗策略、非移植维持治疗或MRD指导的临床试验。虽然目前在准确评估MRD和了解其临床重要性方面取得了很大进展,但在如何优化MRD检测和指导个体患者的治疗决策方面仍存在许多问题。
近期,在MD安德森Nicholas J. Short教授等人发表于American Journal of Hematology的一篇综述中,讨论了评估AML MRD的常用方法以及MRD在常见临床情况下对预后的影响,还回顾了针对MRD的新兴研究策略,并讨论了该领域一些重要的未解问题和挑战。

AML中的MRD方法学
在AML中,MRD的检测主要依赖三种方法:多参数流式细胞术(MFC)、聚合酶链反应(PCR),和下一代测序(NGS)。
MFC:适用于缺乏MRD分子标记的患者,通过识别白血病相关免疫表型,实现0.1%~0.01%的检测灵敏度。MFC的优势在于广泛适用性、快速周转和成本效益,但存在标准化难度和对专业知识的高要求。
PCR:利用白血病特异性的基因异常,如染色体重排和突变,通过RT-qPCR检测融合转录本,具有高特异性和灵敏度。此方法对样本质量要求高,且对罕见融合和突变的标准化存在挑战。
NGS:理论上可检测任何体细胞突变,但受限于背景错误率。NGS可实现1~2%的灵敏度,并通过技术如UMI和双链测序提高灵敏度。然而,许多白血病相关突变在患者完全缓解(CR)状态下仍持续存在,给MRD的解释带来挑战。
这些方法各有优势和局限,选择合适的MRD检测方法需考虑疾病特点、治疗方案和可获得的技术和资源。
MRD在AML中的预后影响
在AML患者中,MRD的持续存在或再次出现一直被证明与不良预后相关。一项纳入11,151例患者的大型荟萃分析显示,MRD阴性患者的5年无病生存(DFS)率和总生存(OS)率分别为64%和68%,而MRD阳性患者则显著降低。MRD的影响在不同患者年龄、检测时间点、AML亚型、样本来源和MRD方法中均得到证实。
表1. 根据AML亚型,主要的MRD时间点及干预措施
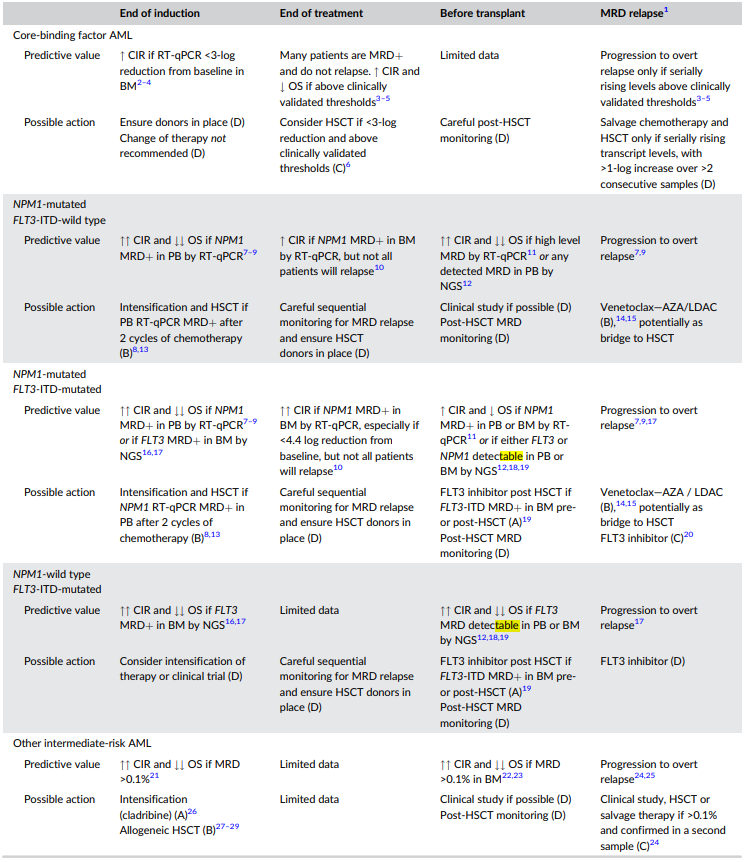
基于MFC的MRD
基于MFC的MRD在不同治疗背景下的AML中均具有重要的预后意义。在NCRI AML17研究中,年轻成人AML患者在第一周期诱导后实现CR但MRD持续存在,其5年OS率与仅达到部分缓解(PR)的患者相似。在标准风险NPM1野生型AML患者中,第二周期后持续MRD≥0.1%的患者,其89%的累积复发率(CIR)和5年OS率为33%(相比MRD阴性患者的63%)。MRD阴性患者通常具有更有利的基线细胞分子特征,反映出这些亚型的化疗敏感性。
多项研究证实,MRD在诱导治疗、巩固治疗期间及巩固治疗结束时的持续存在对预后有负面影响。移植前的MFC基础MRD也显示出预后价值,MRD阳性患者与活动性疾病患者的结果相似。荟萃分析显示,造血干细胞移植(HSCT)前基于MFC的MRD阳性与死亡风险比为1.98。MRD在复发/难治患者中同样具有预后意义,与更高的复发率和较差的无复发生存(RFS)独立相关。
在最初实现MRD阴性后,MRD转阳预示着不良预后。在一项分析中,MRD转阳与5年RFS率为6%和OS率为22%相关。对MRD转阳进行干预,如改变化疗方案或进行异基因造血干细胞移植(allo-HSCT),与预后改善相关(5年OS率为45%,无干预为17%;P=0.01)。这表明密切监测基于MFC的MRD具有重要的预后和治疗指导意义。
特定基因组亚群的分子MRD
NPM1突变AML
通过RT-qPCR检测NPM1 MRD对预测复发和死亡具有重要预后意义。例如,在德国AMLSG研究中,第二次诱导后BM中NPM1 MRD阳性患者的4年OS率为51%,而阴性者为90%。NCRI AML17试验中,两个疗程后PB中NPM1 MRD阳性患者的4年OS率为24%,阴性者为73%。对于移植患者,NPM1 MRD水平高的患者预后较差。
核心结合因子AML
RT-qPCR检测CBFB::MYH11或RUNX1::RUNX1T1转录本对预测复发有预后意义,但对生存预后的影响较小。治疗结束时,MRD阳性患者的复发风险较高,但并非所有MRD阳性患者都会复发。需要特别注意避免将患者标记为MRD失败,除非MRD水平高于临床验证的阈值或有连续上升的MRD水平。
FLT3突变AML
通过NGS检测FLT3-ITD MRD的预后影响显著。例如,在HOVON研究中,两周期化疗后BM中FLT3-ITD MRD阳性患者的4年OS率为31%,而阴性者为57%。在NCRI AML17研究中,预移植FLT3-ITD MRD阳性患者的3年OS率为26%,而阴性者为74%。这些数据表明FLT3-ITD MRD水平高的患者预后较差。
低强度治疗下的MRD影响
随着新的非强化治疗方案的出现,老年AML患者的治疗前景有所改善,同时对MRD的关注也随之增加。VIALE-A研究发现,接受阿扎胞苷和维奈克拉治疗的患者中,MRD阴性者的2年OS率为78%,而MRD阳性者为40%。另一项前瞻性研究显示,使用地西他滨和维奈克拉治疗的老年AML患者中,2个月内MRD阴性者的中位OS为25.1个月,而MRD阳性者为7.1个月。
在NPM1突变的AML患者中,以维奈克拉为基础的非强化方案治疗后,4周期结束时MRD阴性者的2年OS率为84%,而MRD阳性者为46%。在MRD阴性并停止治疗的患者中,复发率较低。这些发现强调了在非强化治疗方案中监测MRD的重要性。
未来需要更多前瞻性研究来评估MRD在现代非强化治疗方案中的作用。例如,澳大利亚白血病和淋巴瘤组(AALG)AMLM26 INTERCEPT研究是一项多臂临床试验,针对MRD阳性AML患者,旨在探索不同的靶向药物联合,以期提高治疗效果。
以MRD为指导的造血干细胞移植决策
中危AML中基于MFC的MRD
在中危AML患者中,MRD状态影响首次缓解后巩固治疗的选择,尤其是对于是否进行allo-HSCT的决策。NCRI AML17研究表明,持续MRD阳性的患者更可能从HSCT中获益。GIMEMA AML1310研究也发现,MRD阳性患者接受HSCT有相似的2年OS率,表明MRD指导的决策可能改善预后。
NPM1突变AML
ALFA0702研究和NCRI AML17/19研究支持使用MRD状态来选择适合HSCT的患者,特别是对于MRD阳性的患者。
核心结合因子AML
在中国AML05研究中,未能实现RUNX1::RUNX1T1转录本在BM中≥3-log减少的患者接受HSCT似乎有益。
FLT3突变AML和其他分子标志物
HSCT对FLT3-ITD无NPM1突变的高危患者很重要,但MRD在指导移植决策方面的作用尚未明确。
MRD对预处理强度的潜在影响
MRD状态可能影响HSCT前的预处理方案。一些研究表明,MRD阳性患者可能更需要骨髓消融性预处理(MAC)。
以MRD为指导的移植后维持治疗
在HSCT前后检测到FLT3 MRD的患者预后较差,可能需要使用FLT3抑制剂进行维持治疗。MORPHO研究表明,吉瑞替尼维持治疗可为MRD阳性患者带来RFS获益。其他AML亚型中MRD在指导移植后维持治疗的作用仍在研究中。
以MRD为指导的非移植治疗方法
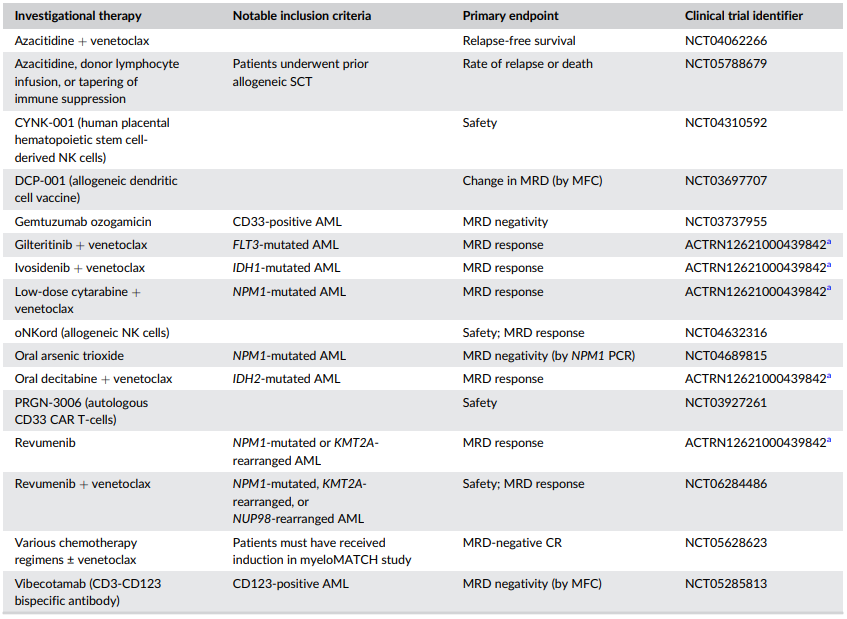
虽然HSCT是适合移植的MRD阳性AML患者的潜在明确和治愈性方法,但疗效仍不理想。且许多患者因年龄或合并症不适合HSCT。目前正在探索新药和新疗法以清除AML患者MRD,包括:
表2. MRD阳性AML中正在进行的临床试验
低甲基化剂(HMAs)
53例化疗或HSCT后的CR患者接受阿扎胞苷治疗MRD阳性复发;19例者(36%)转为MRD阴性,MRD反应与改善RFS(P<0.001)和改善OS的势相关。QUAZAR AML-001研究支持使用阿扎胞苷可为不适合HSCT的AML患者带来生存获益。
靶向治疗
随着针对分子定义的AML亚群的有效靶向疗法的发展,这些药物现在正在被探索用于MRD阳性患者,一些小型研究证实了这种方法的潜在益处。例如,FLT3抑制剂在FLT3突变的MRD阳性患者中显示出治疗潜力,60%的患者获得了分子学反应。针对NPM1突变AML的维奈克拉基础方案也显示出治疗前景。
免疫疗法
几种免疫疗法已被前瞻性评估用于MRD阳性AML的治疗。例如,CD3×CD123双特异性抗体vibecotamab在MRD阳性AML患者中显示出一定的疗效。FLT3单克隆抗体FLYSYN在持续或增加性MRD患者中也观察到分子学反应。
挑战和未来方向
AML中MRD与长期预后紧密相关,作为早期治疗终点有助于风险分层、预测长期结果及指导治疗决策。但最佳“MRD阴性”反应因疾病、方案和检测方法而异,跨机构算法开发亦具挑战性。ELN虽推动标准化,但建议难普及。新疗法或改变MRD预后意义,传统适应证未必适用新方案。
MRD在AML药物开发中日益关键,或能加速评估新疗法并促进药物批准。但在AML中作为替代终点未被广泛接受,FDA 要求相关前瞻性临床试验数据。不过,MRD已在ALL及多发性骨髓瘤临床试验中作为替代性研究终点。
对AML生物学的深入了解促进了MRD导向临床试验的发展,但监管批准的路径仍不确定。目前尚无基于MRD转换率的AML药物批准先例,需要前瞻性临床试验来显示MRD状态与生存结果的关联,使用可接受的、标准化的MRD终点。可能需要随机试验来比较MRD导向疗法与标准治疗在MRD阳性AML患者中的疗效。
Short NJ, Dillon R.Measurable residual disease monitoring in AML: Prospects for therapeutic decision-making and new drug development.Am J Hematol . 2024 Sep 25. doi: 10.1002/ajh.27482.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


