2024年世界肺癌大会(WCLC)大会已于日前在美国圣地亚哥圆满落幕。今年WCLC大会上,抗体偶联药物(ADC)仍然是晚期非小细胞肺癌(NSCLC)治疗领域的闪耀明星,多项研究结果为肺癌治疗注入新能量,开辟新路径。作为ADC药物的引领者,德曲妥珠单抗(DS-8201,T-DXd)在2024 WCLC大会上再次带来崭新突破,晚期HER2过表达NSCLC领域有望迎来新的治疗选择。
【肿瘤资讯】特邀上海交通大学医学院附属胸科医院虞永峰教授解读最新进展。
上海市胸科医院肿瘤科主任医师,医学博士,硕士研究生导师
中国抗癌协会肺癌专业委员会青委会副主任委员
上海市医学会肿瘤青委会副主任委员
中国医药教育协会肿瘤免疫治疗专业委员会秘书长
中国健康促进基金会肺癌专业委员会常委
CSCO青年委员会委员
中国控烟协会肺癌防治专委会委员
2008年入选上海交通大学医学院 “百人计划”
2009年瑞士苏黎世大学医院进修学习
2012年入选上海青年医师培养计划
2013年入选上海交大晨星青年人才计划(B类)
2016年获“上海市优秀青年医师”称号
以第一作者或通讯作者在柳叶刀呼吸等SCI期刊发表20余篇。获得中华医学科技奖二等奖、华夏医学科技奖二等奖、上海医学科技奖一等奖、中国抗癌科技奖一等奖。以第一负责人承担国家自然科学基金面上项目、青年项目和省部级课题多项,并参加多项国际多中心临床研究工作。
HER2变异在NSCLC中的致癌机制更为复杂
HER2属于人类表皮生长因子受体 (HER) 家族,该家族由EGFR(HER1)、HER2(ERBB2)、HER3(ERBB3)和HER4(ERBB4)四种酪氨酸激酶组成。HER2是一种重要的致癌驱动基因,在NSCLC领域HER2变异包含HER2突变、扩增和过表达三种变异类型。目前为止,尚无明确证据证明HER2突变与HER2扩增或HER2过表达之间的相关性[1],这一现象部分解释了经典 HER2靶向疗法在 NSCLC中的疗效略逊于乳腺癌(乳腺癌的致癌机制主要是基因扩增导致的HER2过表达)[2]。NSCLC中的HER2过表达的致癌机制不完全明确,从理论角度,肿瘤细胞膜上存在过多HER2受体(即HER2蛋白过表达)可能导致HER2胞内信号通路的异常激活,进而影响下游致癌信号通路。NSCLC中HER2过表达的发生率约为2%-30%[3,4],HER2过表达更常见于高分化腺癌,与治疗应答差和临床结局差相关。
HER2基因位于各类细胞内信号通路的上游,HER2变异导致的信号通路异常激活或失调会影响肿瘤细胞的生物学行为。另外,HER2 缺乏特定的内源性配体并能保持活性构象,可持续地被二聚化,是其他家族成员首选的异二聚化伴侣。因此,HER2变异还可能干扰 EGFR、HER3 和 HER4 相关信号通路的传导。总体而言,ERBB家族诱导的细胞内信号通路可能促进肿瘤进展,例如促进细胞增殖和存活。HER2变异也可能促进缺氧/血管生成、上皮-间质转化 (EMT) 和肿瘤免疫逃逸。
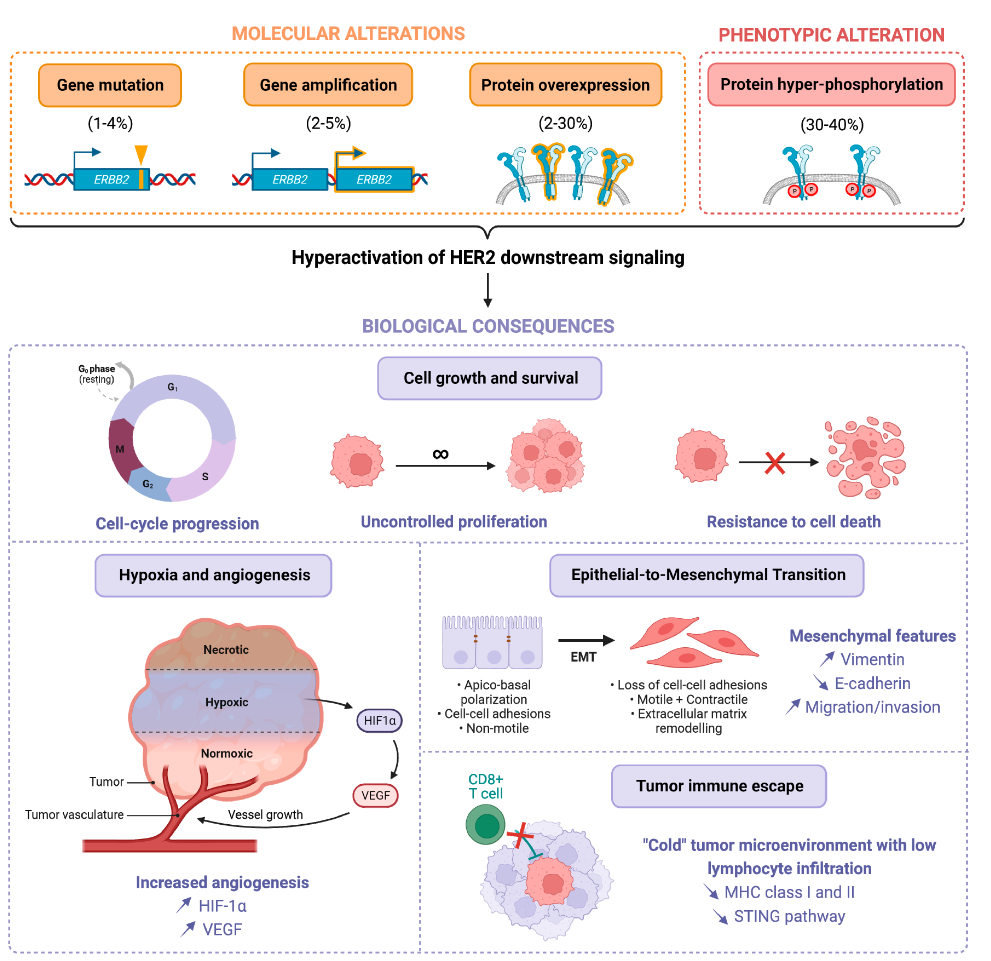 图1 HER2变异生物学机制模式图
图1 HER2变异生物学机制模式图
DESTINY-Lung03闪耀2024 WCLC,
德曲妥珠单抗在HER2过表达NSCLC领域
斩获新突破
既往研究结果初步展现德曲妥珠单抗优异疗效
德曲妥珠单抗在是一种靶向HER2的新型ADC药物,既往已在HER2过表达NSCLC中显示出初步良好的疗效。在I期DS 8201-A-J101研究中,德曲妥珠单抗(6.4 mg/kg)在HER2表达或HER2突变NSCLC患者中的客观缓解率(ORR)为55.6%,中位缓解持续时间(DoR)为10.7个月。
基于此,研究者进一步在DESTINY-Lung01研究中评估了德曲妥珠单抗用于HER2过表达(队列1)的疗效。近日,DESTINY-Lung01最新结果刊登Lancet Oncology[5]。研究纳入既往经多线治疗的HER2过表达NSCLC患者。基线特征显示,100%的患者接受过治疗,队列1、队列1A分别有92%、98%的患者接受过含铂化疗,分别有73%、80%的患者接受过PD-1/PD-L1单抗,分别有24%、22%的患者接受过多西他赛,分别有29%、17%的患者接受过HER2 TKI或EGFR TKI治疗。疗效分析显示,队列1(6.4 mg/kg)、队列1A(5.4 mg/kg)中位随访12.0、10.6个月时,中位治疗持续时间分别为4.1、5.5个月,两队列的ORR分别为26.5%(均为部分缓解)、34.1%(完全缓解2例,部分缓解12例);中位DoR分别为5.8个月、6.2个月,中位无进展生存期(PFS)分别为5.7个月、6.7个月,中位总生存期(OS)分别为12.4个月、11.2个月。安全性方面,德曲妥珠单抗显示出与既往研究一致的结果,未出现新的安全性信号。
DESTINY-Lung03首次结果:
再证德曲妥珠单抗单药疗效/安全性双优
DESTINY-Lung03是一项Ib期、开放标签、多中心、剂量递增和扩展研究,旨在评估德曲妥珠单抗单药或德曲妥珠单抗+免疫检查点抑制剂±化疗用于HER2过表达的不可切除、局部晚期或转移性非鳞状NSCLC的疗效。在此次WCLC大会口头报告专场,DESTINY-Lung03首次公布第1部分ID队列研究结果[6]。研究使用 DAKO HER2-low免疫组织化学(IHC)法进行HER2过表达检测;HER2过表达定义为,通过DAKO HER2-low IHC法显示,≥25%肿瘤细胞为IHC 2+或3+。研究终点包括安全性、ORR、DoR、PFS和OS。
主要结果
2024年4月1日数据截止时,中位随访时间为14.9个月,36例HER2过表达NSCLC患者接受5.4 mg/kg德曲妥珠单抗治疗。基线特征:亚洲患者占比88.9%,基线脑转移患者占比30.6%,IHC 3+、IHC2+患者分别占比44.4%、55.6%,分别有58.3%、52.8%、38.9%、22.2%、8.3%的患者接受过靶向疗法、EGFR TKI、含铂化疗、免疫疗法、紫杉烷类化疗。
表1 基线特征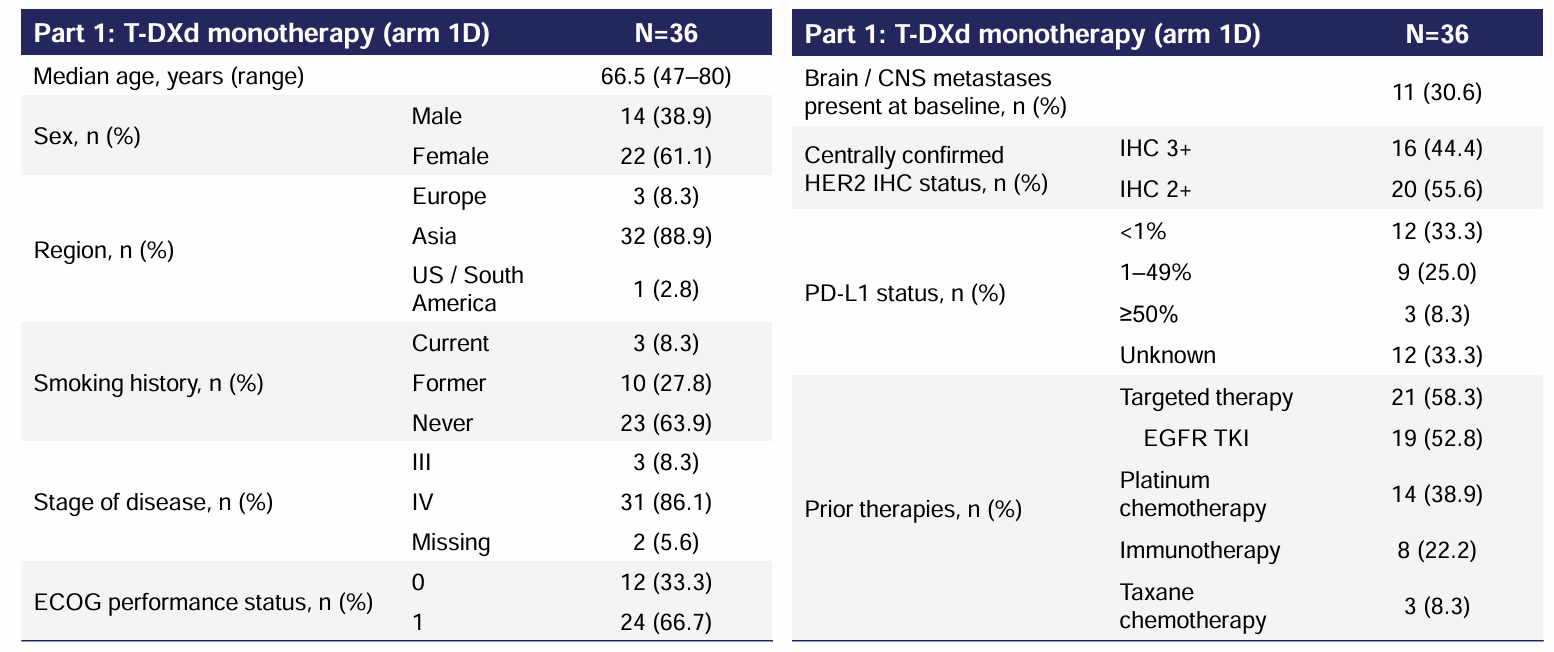
由研究者评估确认的ORR为44.4%,12个月DCR为77.8%,中位 DOR为11个月。中位PFS为8.2个月,中位OS为17.1个月,疗效优异。
表2 疗效分析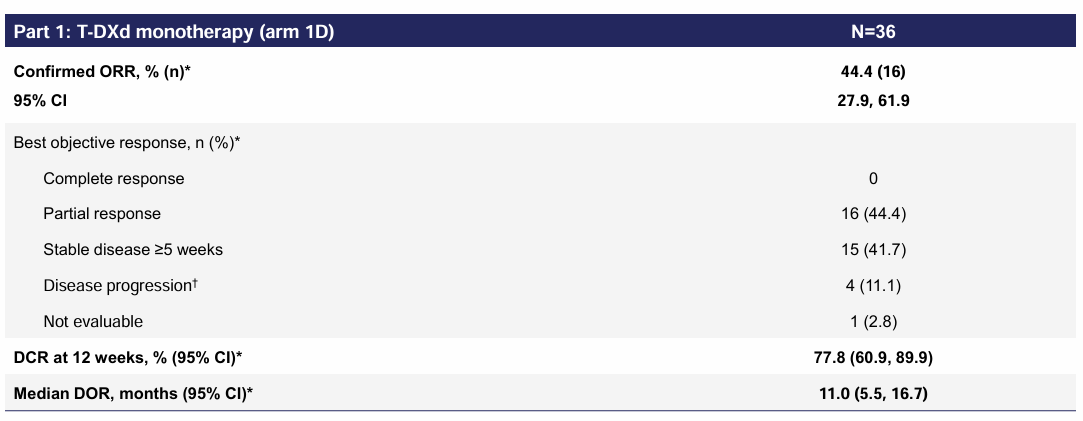
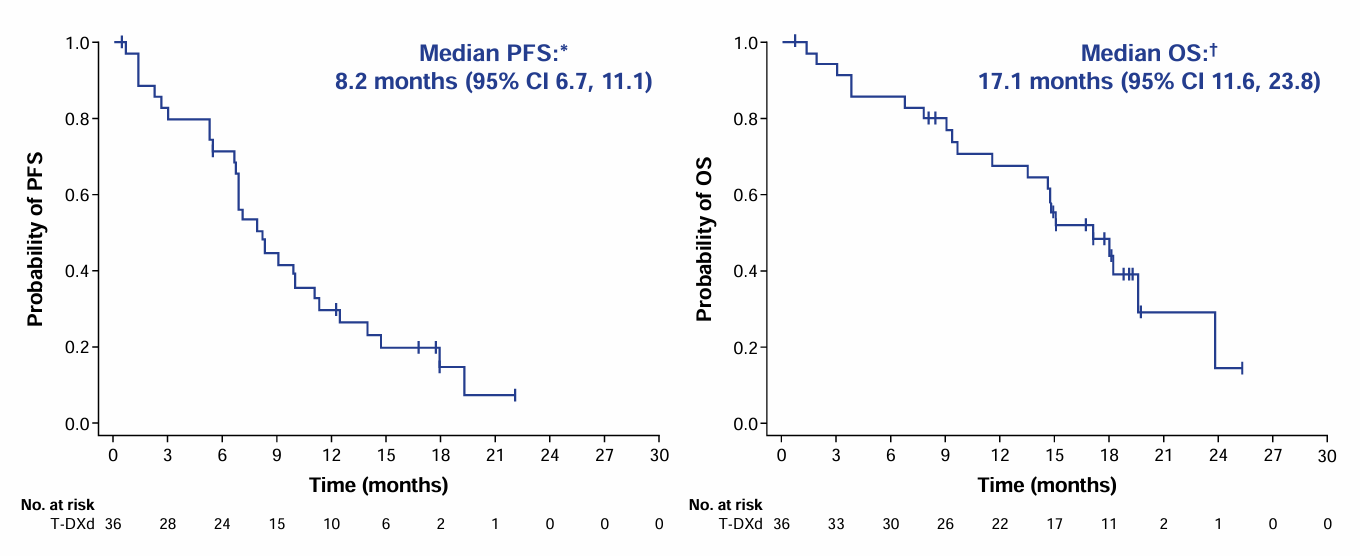 图2 PFS和OS结果
图2 PFS和OS结果
探索性分析显示,IHC 3+、IHC 2+患者确认的ORR分别为56.3%、35.0%,12个月DCR分别为81.3%、75.0%,中位DOR分别为12.5、6.6个月,中位PFS分别为6.9、8.2个月,中位OS分别为16.4、17.1个月。
既往接受和未接受过EGFR TKI患者确认的ORR分别为68.4%、17.6%,12个月DCR分别为84.2%、70.6%,中位DOR分别为11.7、4.6个月,中位PFS分别为8.2、7.1个月,中位OS分别为19.6、14.7个月。
表3 探索性分析结果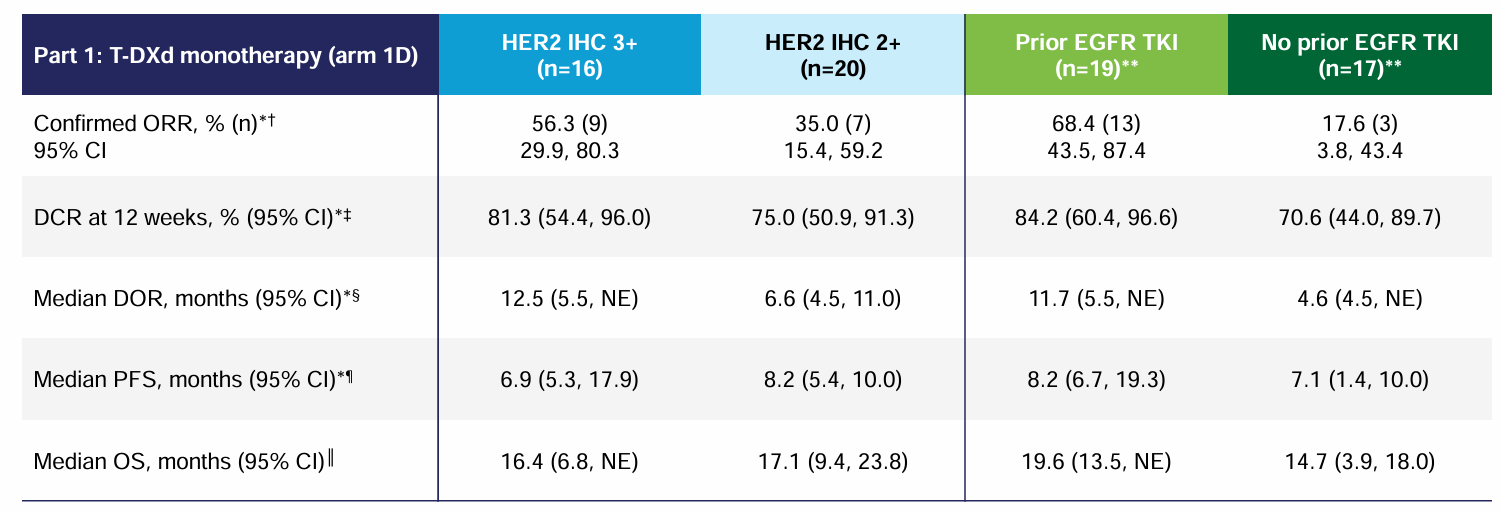
安全性方面,与既往研究结果保持一致,未发现新的安全性信号,最常见(>10%)药物相关不良事件(AE)主要有恶心、呕吐、疲劳,3级及以上AE发生率低。药物相关间质性肺病发生率仅为5.6%,且均为2级事件。
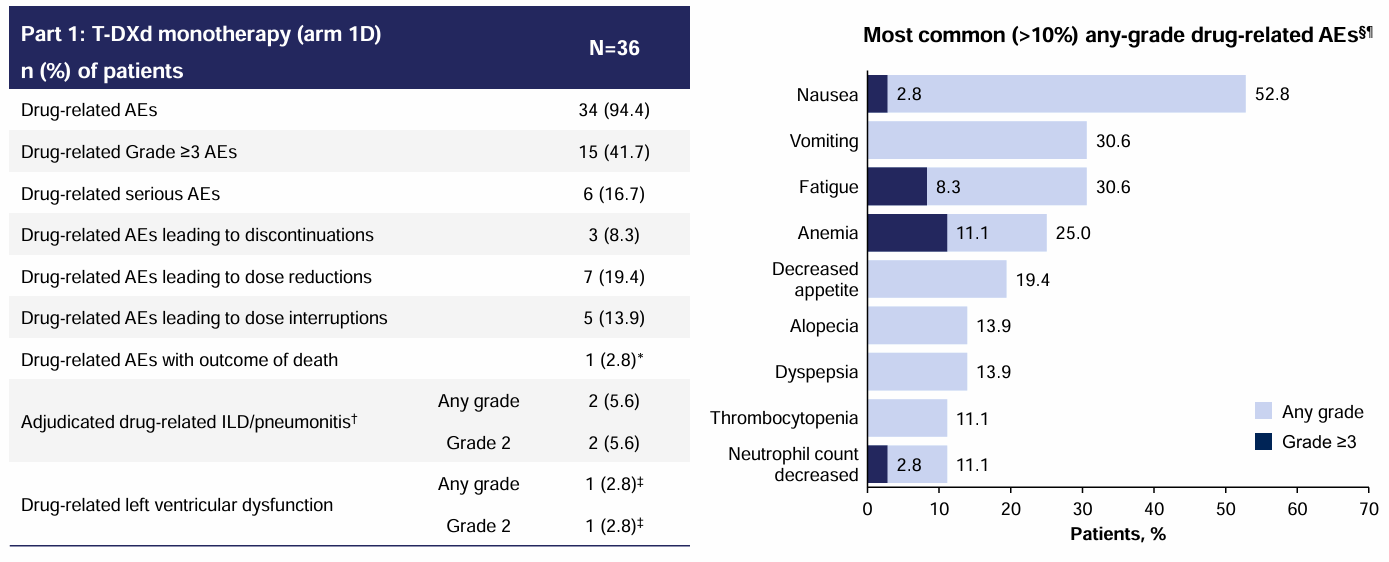 图3 安全性分析
图3 安全性分析
总之,DESTINY-Lung03研究结果再次证实,德曲妥珠单抗单药在经多线治疗的HER2过表达NSCLC患者中具有优异的疗效和可耐受的安全性。此次结果与既往结果共同为德曲妥珠单抗在HER2过表达NSCLC治疗领域的关键性突破提供了有力循证依据。
HER2过表达NSCLC:
迎来ADC泛瘤种治疗时代的新曙光
近年来,新一代ADC药物已在多个实体瘤治疗领域取得显著进展,德曲妥珠单抗是ADC治疗时代的引领者,既往已在多个HER2表达瘤种包括HER2阳性/HER2低表达乳腺癌、HER2阳性胃癌、HER2过表达结直肠癌以及HER2突变NSCLC等瘤种中展开探索,并显示出良好的疗效。
德曲妥珠单抗最早在经治HER2阳性乳腺癌中显示出优异疗效,并促使FDA于2019年加速批准德曲妥珠单抗在实体瘤领域的首个适应症——用于既往接受过一种及以上抗 HER2 治疗的不可切除或转移性 HER2 阳性乳腺癌成人患者。随后德曲妥珠单抗再次获得4项适应症,分别是:德曲妥珠单抗用于既往在转移性疾病阶段接受过至少一种系统治疗的,或在辅助化疗期间或完成辅助化疗之后6个月内复发的,不可切除或转移性HER2低表达(IHC1+或IHC 2+/ISH-)成人乳腺癌患者(第二项适应症)。德曲妥珠单抗用于 HER2 突变且既往接受过至少一种系统治疗的不可切除或转移性NSCLC成人患者(第三项适应症)。德曲妥珠单抗用于既往接受过包括曲妥珠单抗的一种及以上疗法的 HER2 阳性局部晚期或转移性胃或食管胃结合部腺癌成人患者(第四项适应症)。德曲妥珠单抗用于既往接受过全身治疗且没有令人满意的替代治疗方案的不可切除或转移性 HER2 阳性(IHC 3+)实体瘤成年患者(第五项适应症)。
其中第五项HER2过表达实体瘤适应症的获批,主要基于DESTINY-PanTumor02、DESTINY-CRC02和DESTINY-Lung01三项研究的结果。DESTINY-PanTumor02主要针对既往接受过治疗的HER2表达转移性实体瘤患者,包括胆道癌、膀胱癌、宫颈癌、子宫内膜癌、卵巢癌、胰腺癌等。结果显示,德曲妥珠单抗的ORR为51.4%,中位DOR为19.4 个月。DESTINY-CRC02研究在HER2阳性(IHC 3+或 IHC 2+/ISH+)、RAS 野生型或突变型、BRAF野生型且既往接受过标准治疗转移性结直肠癌患者中开展。结果显示,德曲妥珠单抗的ORR为46.9%,中位DOR为5.5个月。DESTINY-Lung01详细研究结果已在上述提及,FDA批准基于的研究数据显示,德曲妥珠单抗的ORR 为 52.9%,中位 DoR为6.9个月。
表4 三项研究疗效分析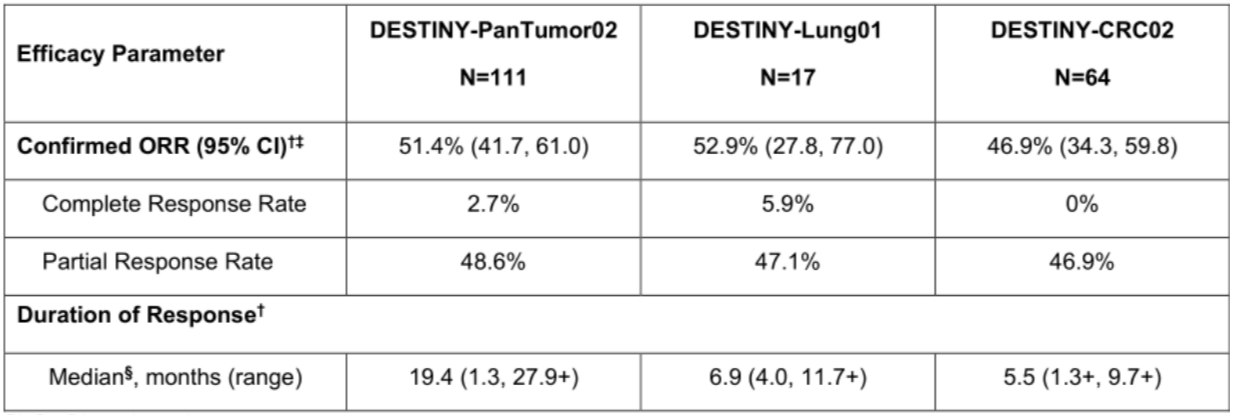
可见,德曲妥珠单抗在HER2表达的泛瘤种中均展现出良好的治疗潜力,有望成为精准治疗时代的主力军。更引人瞩目的是,在HER2靶点致癌机制更加复杂的NSCLC中,德曲妥珠单抗再次取得突破,且是截止目前唯一同时在HER2突变、HER2过表达肺癌领域取得重大突破的ADC药物。研究结果为未来德曲妥珠单抗在HER2靶点NSCLC以及实体瘤领域的进一步探索提供了有力证据,期待更多研究结果为ADC药物的未来临床应用提供证据支持。
结语
今年WCLC大会上,ADC药物取得的进展和突破再次博得业内专家眼球,为如今肺癌精准治疗的画卷再增添了浓墨重彩的一笔。德曲妥珠单抗作为ADC治疗时代的引领者,目前为止同时在HER2突变、HER2过表达NSCLC取得双重突破,同时在HER2靶点泛瘤种中展现强劲治疗前景。在肺癌领域,德曲妥珠单抗用于经治HER2突变、HER2过表达NSCLC的两个适应症已获得FDA批准,期待其在肺癌领域继续探索,为HER2变异带来临床新选择。
[1]Loeffler E, Ancel J, Dalstein V, et al. HER2 Alterations in Non-Small Cell Lung Cancer: Biologico-Clinical Consequences and Interest in Therapeutic Strategies. Life (Basel). 2023 Dec 29;14(1):64. doi: 10.3390/life14010064. PMID: 38255679; PMCID: PMC10820545.
[2]Yu X, Ji X, Su C. HER2-Altered Non-Small Cell Lung Cancer: Biology, Clinicopathologic Features, and Emerging Therapies. Front Oncol. 2022 Mar 29;12:860313. doi: 10.3389/fonc.2022.860313. PMID: 35425713; PMCID: PMC9002096.
[3]Riudavets M, Sullivan I, Abdayem P,et al. Planchard, D. Targeting HER2 in Non-Small-Cell Lung Cancer (NSCLC): A Glimpse of Hope? An Updated Review on Therapeutic Strategies in NSCLC Harbouring HER2 Alterations. ESMO Open 2021, 6, 100260.
[4]Yu X, Ji X, Su C. HER2-Altered Non-Small Cell Lung Cancer: Biology, Clinicopathologic Features, and Emerging Therapies. Front. Oncol. 2022, 12, 860313
[5]Smit EF, Felip E, Uprety D, et al. Trastuzumab deruxtecan in patients with metastatic non-small-cell lung cancer (DESTINY-Lung01): primary results of the HER2-overexpressing cohorts from a single-arm, phase 2 trial. Lancet Oncol. 2024 Apr;25(4):439-454. doi: 10.1016/S1470-2045(24)00064-0. PMID: 38547891.
[6] ]Trastuzumab Deruxtecan Monotherapy in Pretreated HER2-overexpressing Nonsquamous Non-Small Cell Lung Cancer: DESTINY-Lung03 Part 1. 2024 WCLC, OA16.05.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


