
近年来,抗体偶联药物(ADC)在HER2变异非小细胞肺癌(NSCLC)领域取得重要进展。FDA于2022年批准德曲妥珠单抗用于HER2突变晚期NSCLC后线治疗的适应症,于今年4月又批准德曲妥珠单抗用于包括肺癌在内HER2过表达实体瘤后线治疗的适应症。HER2变异的临床检测亦得到NCCN/CSCO/ESMO/ASCO指南的推荐。NSCLC中HER2基因突变、HER2扩增、HER2过表达的规范化检测将有力推动NSCLC的精准治疗。
【肿瘤资讯-HER2学社】第八期特邀中山大学孙逸仙纪念医院欧阳能太教授深入解析HER2变异的临床检测。
细胞分子诊断中心教授
中国抗癌协会肿瘤基因诊断专委会 常委
中国抗癌协会肿瘤标志专委会 常委
中国医学装备协会基因检测分会 常委
HER2变异的不同检测方法及特点
检测HER2变异的常见方法包括实时荧光定量PCR(qPCR)、荧光原位杂交(FISH)、免疫组织化学(IHC)、第二代测序(NSG)等,其他检测平台例如微滴式数字PCR(ddPCR)等正在发展中。不同方法具有各自的特点:qPCR检测平台普遍,检测周期短,但只能检测已知变异类型;FISH检测可以直接定位,结果直观,但对样本质量要求更高,检测及分析过程复杂;IHC检测平台可及性高,廉价、快捷,依赖病理医生的主观判断;高通量测序可检测多种变异类型,能检测未知变异,灵敏度及特异度高,但与产品探针设计覆盖度及生物信息分析能力有关。总体而言,HER2突变、HER2扩增和HER2蛋白过表达是不同的事件,可通过不同的方法进行评估。临床上一般根据不同的应用场景选择合适的检测方法,必要时应进行多平台的检测,以互相验证结果。
表1 HER2变异常见的检测方法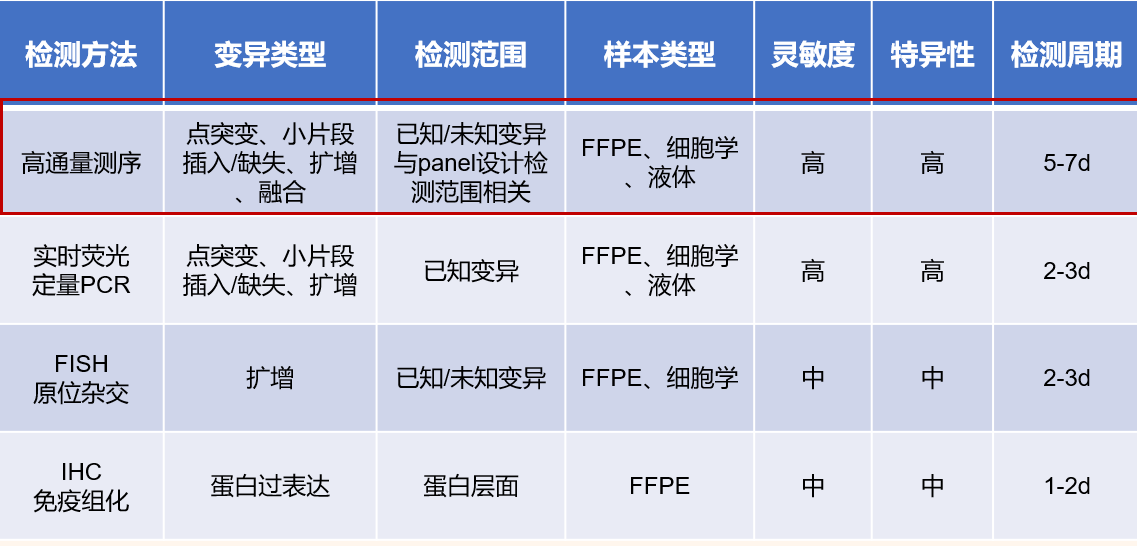
HER2突变的临床检测
检测方法
HER2突变的检测方法包括NGS和ARMS-PCR。不同方法在灵敏度、特异性、样本要求、检测时间、技术复杂度等方面存在差异,应根据实验室条件、样本类型、样本量等选择合适的检测方法。ARMS-PCR灵敏度和特异性高、操作简单,但只能检测已知突变类型;当同时检测多个突变位点时,需要较大的DNA载量,非特异性结合概率会增加。HER2突变的检测应首选NGS平台,理想的NGS检测平台应该能够识别与临床治疗相关的所有类型的HER2外显子20突变,包括外显子20 YVMA插入、非YVMA插入和错义突变等[1,2]。2022年FDA批准德曲妥珠单抗用于HER2突变NSCLC患者后线治疗适应症的同时,亦批准了两款基于NSG平台的HER2突变伴随诊断产品,分别是OncomineTM D×target test(组织样本)、Guardant360® CD×(血浆样本)(若在血浆中未检测到突变,应在组织样本中进行检测)。
样本选择
肿瘤组织样本可以选择新鲜组织样本、福尔马林固定石蜡包埋(FFPE)样本。病理医师需要对肿瘤组织样本的细胞含量进行评估,建议肿瘤细胞含量至少达到20%以上;若低于20%,建议检测前进行肿瘤细胞富集,并在报告中说明样本的局限性。需要按照规范流程处理FFPE样本,建议在组织离体后(1h内)或从液氮中取出后在尽可能短的时间内(10分钟内)浸入中性福尔马林缓冲液中固定。手术组织标本固定时间为12h~48h,但不超过72h;活检组织标本充分固定6h~12h。FFPE样本保存时间建议不超过24个月。
对于无法获取到肿瘤组织的晚期肺癌患者,可采用痰液、肺泡灌洗液、胸腔积液、超声支气管镜引导下的经支气管针吸活检术(EBUS-FNA)的细胞学样本。同样需按照标准操作流程制作成蜡块标本,并评估其肿瘤细胞含量,符合检测标准后进行检测。
对于无法取到肿瘤组织及细胞学样本的晚期肺癌患者,可选择血液、脑脊液上清、胸腔积液上清样本进行液体活检。由于样本中肿瘤细胞含量较少,检测结果可能会出现假阴性,建议选择灵敏度较高的检测技术。若使用一次性EDTA真空采血管收集患者外周血,建议在2-4h内进行血浆分离,如不能立即提取,可于-20±5℃保存,保存时间不超过12个月,或-70℃以下长期保存,避免反复冻融。DNA提取完毕后,建议立即进行检测,否则应置于-20±5℃保存,保存时间不超过12个月。
总体而言,HER2突变检测应优先推荐组织样本,可采用细胞学样本,也可采用液体活检样本。为节约患者肿瘤组织标本,取材时应尽量一次性获取需要的病理诊断和分子诊断的样本量,以便有足够的样本进行检测。患者耐药需要再次活检时,建议进行NGS多基因检测,以便采用有限的标本获得更多基因变异信息,可减少患者创伤,并为后续治疗方案提供信息。
HER2扩增的临床检测
检测方法:
可通过NGS和FISH检测NSCLC中HER2基因拷贝数的变化,目前NGS是临床实践中更常用的检测方法,可以同时检测数百种基因改变,且在分类局部基因扩增和染色体倍性改变等方面具有优势。
FISH是一种分子细胞遗传学诊断技术,原理是利用荧光标记的核酸探针与细胞核中的DNA靶序列杂交,在荧光显微镜下分析与细胞核中的DNA靶序列杂交的探针发出的荧光信号,通过计数信号和比值计算基因拷贝数。HER2拷贝数可以通过计算平均HER2基因拷贝数或HER2/CEP17比值来判断。与平均HER2拷贝数相比,HER2/CEP17 比值被认为能更好地反映HER2扩增状态。在HER2 FISH系统中增加CEP17探针可区分17号染色体的非整倍体与单纯HER2基因扩增,从而能更准确地鉴定低水平HER2扩增。目前NSCLC中HER2扩增的判断标准主要参考乳腺癌[1,2]。
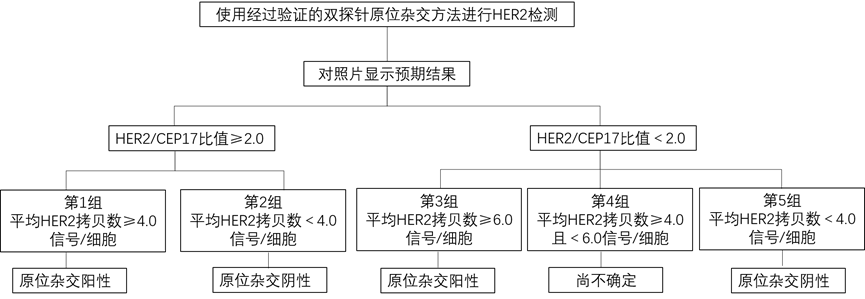
样本选择
HER2扩增的检测同样应优先选择组织样本,可采用细胞学样本,也可采用液体活检样本。液体活检对基因扩增和拷贝数变异的灵敏度较低,若出现ctDNA阴性结果时,应在组织样本中复检。
HER2蛋白过表达的临床检测
检测方法
IHC是检测乳腺癌、胃癌、肠癌和非小细胞肺癌等实体瘤中HER2过表达的标准方法,需要用组织样本(例如手术切除标本)进行检测。HER2 IHC可通过两种方法评估:H评分系统和美国临床肿瘤学会(ASCO)/美国病理学家学会(CAP)推荐的IHC评分系统。
H评分通过染色强度(0-3)乘以阳性细胞百分比(0%-100%)确定分数,可能的范围是0-300。分数>200 通常被认为是过表达。在2023版更新的ASCO/CAP乳腺癌指南中[3],根据膜染色评分可将HER2蛋白表达情况分为0、1+、2+、3+,其中0/1+和3+分别被认为是过表达的阴性和阳性;在IHC结果不明确(评分为2+)的情况下,需要通过原位杂交包括FISH、CISH或SISH等进一步确认结果。
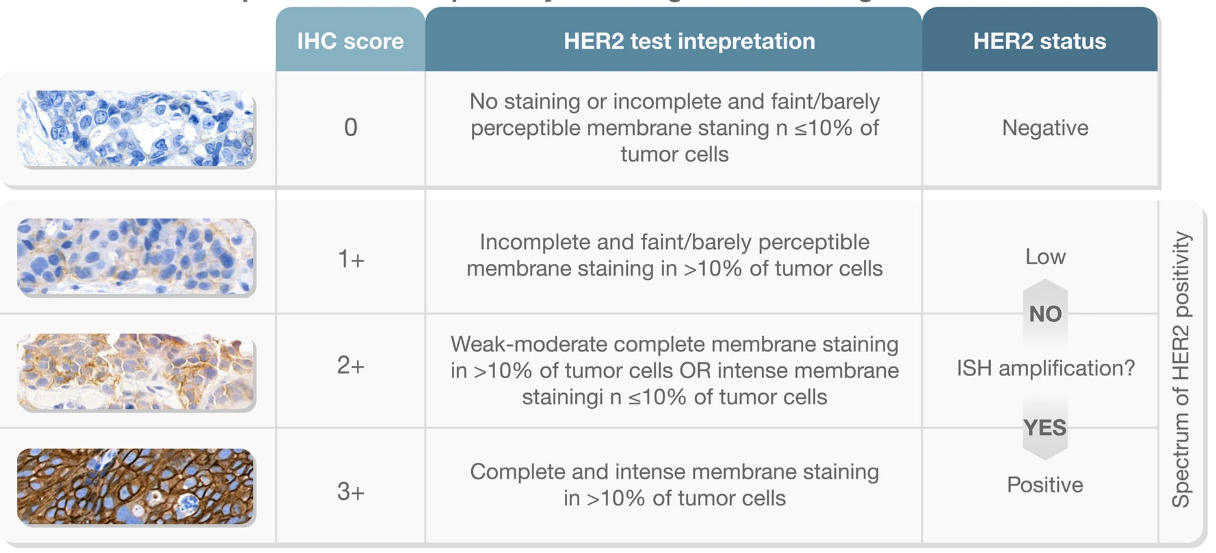 图2 HER2过表达状态(按IHC评分)
图2 HER2过表达状态(按IHC评分)
样本要求
病理医师需要对肿瘤组织样本的细胞含量进行评估,建议选择大于100个癌细胞的细胞学标本,标本固定与前述HER2突变样本类似。用于IHC染色切片厚度以3~5um为宜,原位杂交法以4~5um为宜;IHC检测方法均需HE染色切片作为比对;对于未染色的切片,应置于室温不宜超过6周,以防抗原丢失[1,4]。
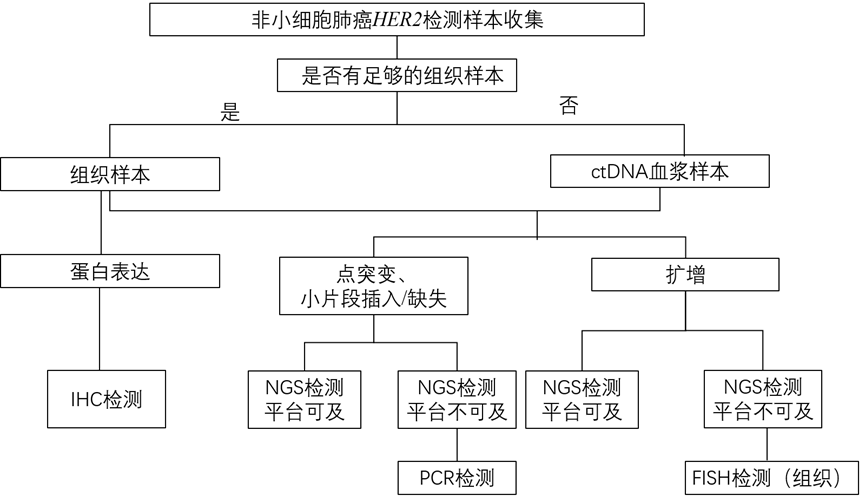 图3 HER2变异检测流程图
图3 HER2变异检测流程图
整体而言,目前临床上已有多种方法可用于HER2变异的检测,实际应用中,医生需要根据标本类型、样本量、肿瘤细胞含量、样本质量、临床需求、实验室检测能力等选择合适的检测平台。在条件允许的情况下,可同时在多个平台进行检测以确保结果的准确性。
HER2变异检测的质量控制和结果报告
在临床实践中,建立规范的质控体系是病理诊断和评估可靠性的关键。为确保HER2变异检测结果的准确性,实验室应建立标准操作流程(SOP)和质控体系。若采用NGS检测HER2变异,NGS实验室应符合国家和国际质量标准,应定期对实验室技术人员进行实验技能培训,并定期对检测结果进行总结和分析。实验室应参与病理学质量控制中心(PQCC)、CAP或美国临床实验室改进修正案(CLIA)等年度质量控制计划或其他实验室间质量评估。及时发布清晰、简洁、全面的病理报告对于促进临床决策起着至关重要的作用;为保证质量,必须严格遵守SOP和诊断工作流程。
表2 HER2变异报告内容要求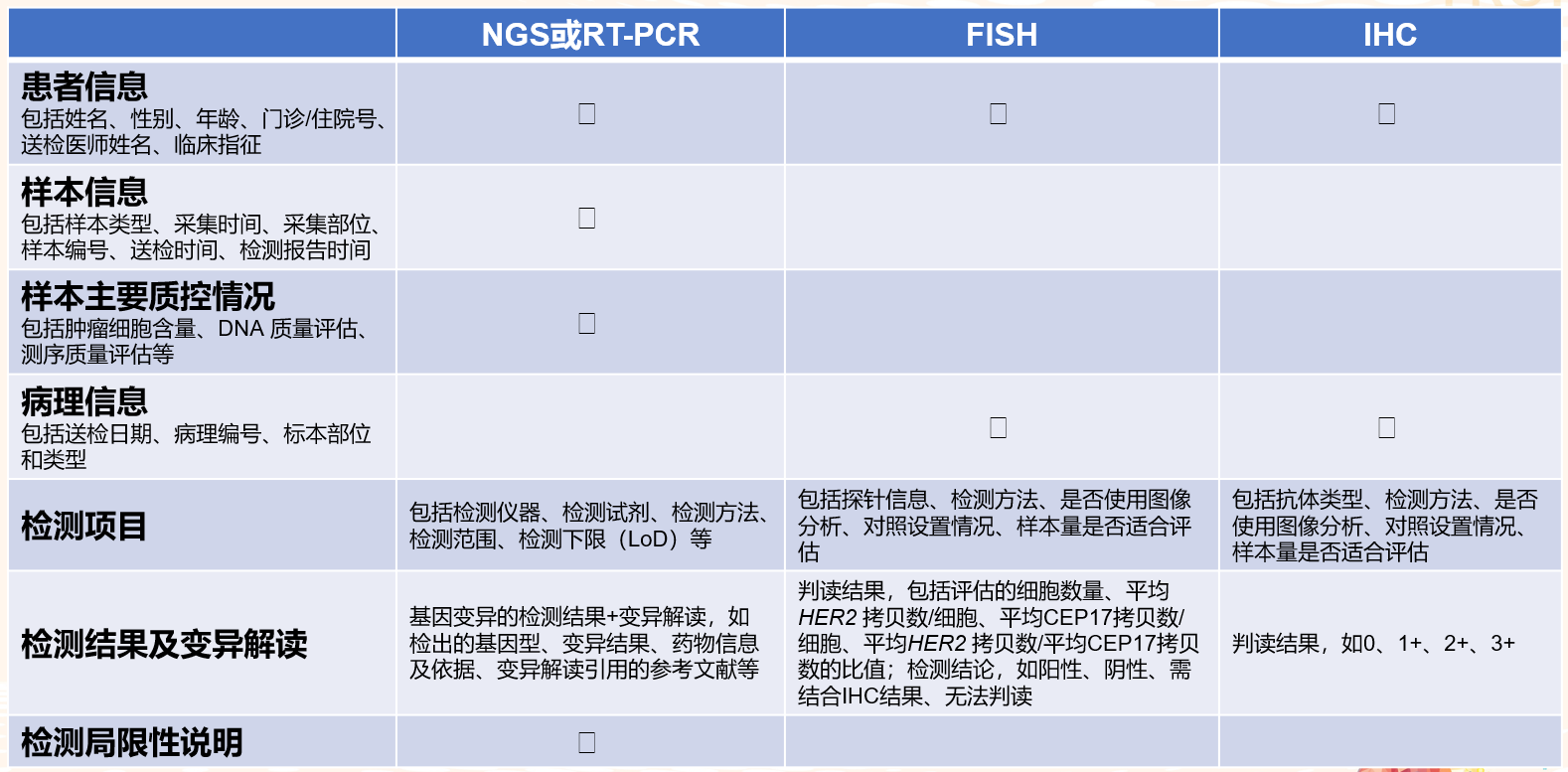
总结
在NSCLC领域,HER2 ADC药物德曲妥珠单抗引领HER2变异晚期NSCLC进入了精准治疗的新时代。HER2突变、HER2扩增、HER2过表达的规范化检测势在必行,三种变异类型的精准检测将有效指导NSCLC的精准治疗。整体而言,三类变异的检测可优选组织样本;HER2突变推荐NGS法,并可与EGFR、ALK、ROS1、RET、NTRK 等其他驱动基因同时检测;HER2扩增推荐NGS/FISH法,HER2过表达应采用IHC法,必要时可采用多种方法验证结果。样本选择、质量控制和报告内容需要符合要求,确保检测的准确性和可靠性。未来需要进一步完善HER2三类变异的检测流程及伴随诊断方法,鼓励在HER2变异NSCLC中开展临床研究,以提供高质量证据,优化检测方法。
[1]Ren S, Wang J, Ying J, et al. Consensus for HER2 alterations testing in non-small-cell lung cancer. ESMO Open. 2022 Feb;7(1):100395. doi: 10.1016/j.esmoop.2022.100395. Epub 2022 Feb 8. Erratum in: ESMO Open. 2022 Jun;7(3):100482. doi: 10.1016/j.esmoop.2022.100482. PMID: 35149428; PMCID: PMC8844658.
[2] Zhang S, Wang W, Xu C, et al. Chinese expert consensus on the diagnosis and treatment of HER2-altered non-small cell lung cancer. Thorac Cancer. 2023 Jan;14(1):91-104. doi: 10.1111/1759-7714.14743. Epub 2022 Nov 28. PMID: 36444143; PMCID: PMC9807451.
[3]Wolff AC, Somerfield MR, Dowsett M, et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: ASCO-College of American Pathologists Guideline Update. J Clin Oncol. 2023 Aug 1;41(22):3867-3872. doi: 10.1200/JCO.22.02864. Epub 2023 Jun 7. PMID: 37284804.
[4]杨文涛,步宏. 乳腺癌HER2检测指南(2019版).[J] 中华病理学杂志,2019,48(3):169-174
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


