肺越寰宇,大咖论道——肺癌前沿诊疗学术交流线上会议已圆满落幕。此次会议聚焦抗体偶联药物(ADC)在非小细胞肺癌(NSCLC)领域的临床研究进展与应用,深度探讨了ADC的发展方向和突破。会议期间,中山大学附属第一医院唐可京教授分享了《新型药物在NSCLC治疗格局中的新突破》。【肿瘤资讯】整理Dato-DXd、德曲妥珠单抗(DS-8201/T-DXd)相关精华内容,以飨读者。
专家介绍
中山大学附属第一医院呼吸与危重症医学科副主任,药学部主任/党总支部书记、感染性疾病科主任
美国范德堡 (Vanderbilt) 大学医学中心访问学者
美国德州大学西南医学中心 (UTSW) Harold C. Simmons综合癌症中心访问科学家
中国医师协会呼吸医师分会肺癌工作委员会 委员
中国肺癌防治联盟免疫治疗委员会 常委
中国抗癌协会个案管理专业委员会 常务委员
中国初级卫生保健基金会胸部肿瘤精准治疗专委会 常务委员
广东省医师协会临床试验专业委员会 副主任委员
广东省临床试验协会(GACT / CTONG)理事
广东省基层医药学会肺癌专业委员会 副主任委员
广东省女医师协会肺癌专业委员会 常务委员
广东省医师协会呼吸科医师分会常务委员,感染与重症专业工作组组长
广东省医学会临床药学分会 副主任委员
广东省医学会呼吸病学分会 常务委员
广东省女医师协会呼吸与危重症医学专业委员会 副主任委员
广东省临床医学学会呼吸病学专业委员会 副主任委员
点击观看完整视频
TROP2 ADC Dato-DXd
集“精准、强效、安全”3大优势于一身
针对TROP2、HER2等的靶点是ADC在肺癌领域的热点研究方向。TROP2是一种跨膜糖蛋白,在多种实体瘤中高表达,在NSCLC中表达更高,肺腺癌中约64%的患者TROP2高表达,且与预后差相关。这也是ADC选择TROP2作为治疗靶点的原因所在。
TROP2 ADC研发赛道异常火热,Dato-DXd作为引领者走在最前列,在结构上有更多优势
● 低亲和力抗体,KD值为0.74nM
Dato-DXd的抗体是经改造过的、低亲和力的lgG1单抗MAAP-9001a,较低的亲和力可保证抗体仅在高表达肿瘤区域结合,而与正常组织结合力降低。
● 高抗肿瘤活性载荷,IC50值为0.31μmoL/L
拓扑异构酶I抑制剂DXd是伊沙替康活性代谢产物,抗肿瘤活性是SN38的10倍,是常见化疗药物的1000倍;此外DXd半衰期短仅1.37小时,游离DXd能快速代谢,保证用药安全性;游离DXd具有较高的细胞膜渗透性,可通过旁观者效应杀伤周围异质性肿瘤细胞,使得抗肿瘤活性进一步增强。
● 酶促四肽连接子
Dato-DXd采用含GGFG的四肽连接子,在血浆中高度稳定,能够实现更优的给药方案,Dato-DXd给药方式为每三周一次,与目前常见化疗、免疫治疗药物给药周期相同;连接子仅在肿瘤特异性上调的溶酶体的作用下裂解,可避免载荷提前释放而带来的脱靶毒性。
● 针对TROP2靶点的优化DAR值
TROP2广泛表达于皮肤、肺、乳腺等组织器官,过高DAR值会损害正常组织。因此针对TROP2靶点,Dato-DXd将DAR值优化为4,扩大治疗窗保证药效的同时降低了药物聚集及脱靶毒性风险。
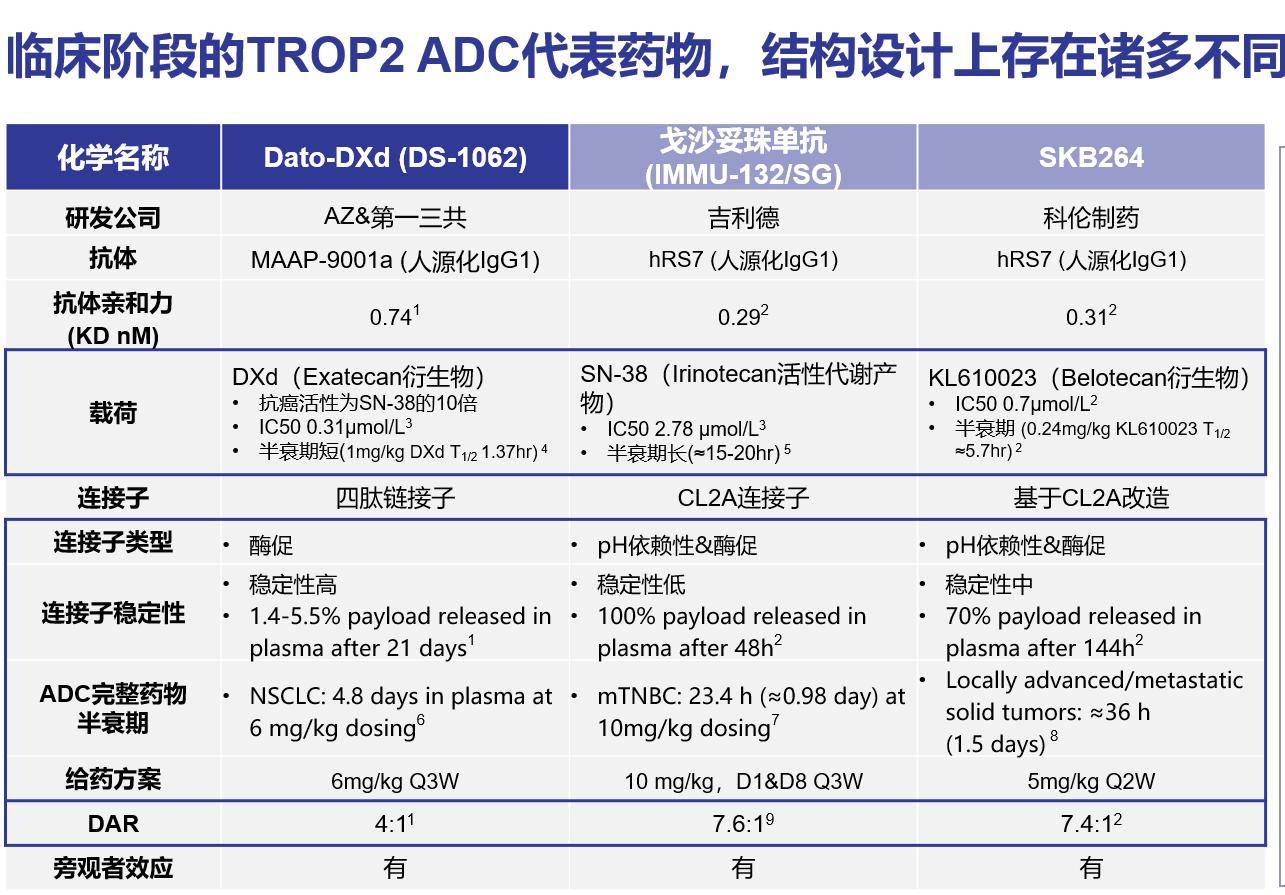 图1 不同TROP2 ADC结构特点
图1 不同TROP2 ADC结构特点
TROPION-Lung01:ADC 在肺癌领域首个且唯一获得主要研究终点阳性结果的 III 期注册研究
TROPION-Lung01研究是一项全球性、多中心、开放标签III期随机对照研究,旨在评估Dato-DXd对比多西他赛用于既往至少接受过一次治疗、伴或不伴可靶向基因组改变(AGA)IIIB-IV期NSCLC患者的疗效和安全性。研究纳入大多数经治的伴AGA和无AGA人群。
● AGA患者为经确认携带≥1种AGA(包括EGFR、ALK、NTRK、BRAF、ROS1、RET、MET ex14跳变),此类患者既往接受过1-2线已获批靶向疗法和含铂化疗,以及至多一种PD-L/PD-L1单抗。
● 无AGA患者既往接受过1-2线治疗,包括含铂化疗和PD-L/PD-L1单抗。
入组患者按1:1比例随机分配接受Dato-DXd(6mg/kg)或多西他赛(75mg/m2)治疗。双重独立主要终点为BICR评估的无进展生存期(PFS)和总生存期(OS)。
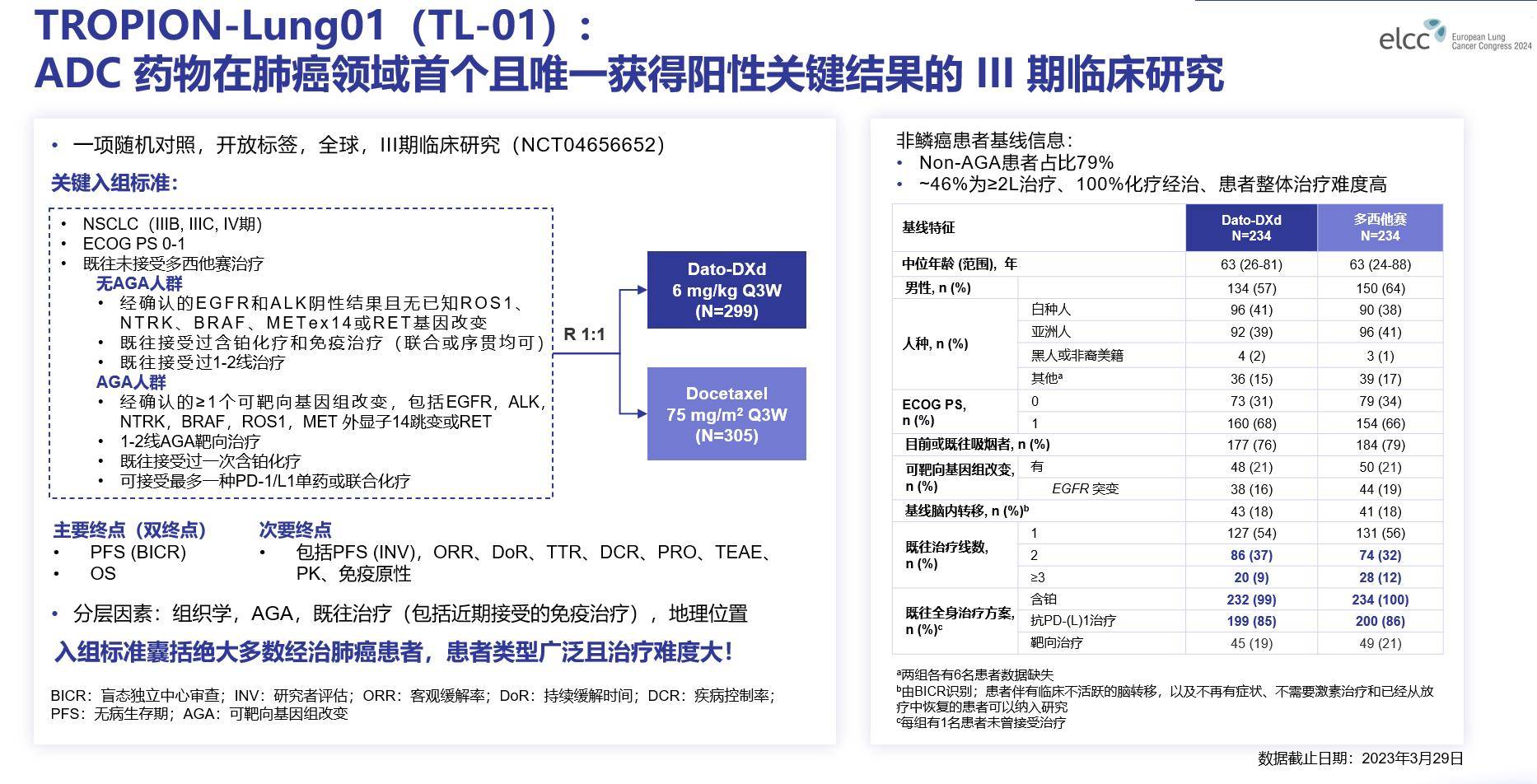 图2 TROPION-Lung01研究设计及基线特征
图2 TROPION-Lung01研究设计及基线特征
主要结果:
基线特征显示,大部分患者为重度经治患者,近一半的患者接受过2线及以上的治疗;99%的患者接受过含铂化疗,约86%的患者接受过免疫治疗;79%的患者为非鳞状NSCLC;亚洲人群约占40%。
2023 ESMO大会上,研究公布达到PFS主要终点,Dato-DXd对比多西他赛显著改善总人群PFS。2024 ELCC大会TL 01研究非鳞亚组数据进一步公布,非鳞状NSCLC患者获益更多,Dato-DXd延长患者中位PFS约2个月(5.5个月 vs 3.6个月),降低疾病进展或死亡风险达37%(HR=0.63)。Dato-DXd组和多西他赛组患者的客观缓解率(ORR)分别为31% vs 13%,Dato-DXd对比多西他赛提升有效率近3倍,且Dato-DXd组分别有2%、30%的患者达到完全缓解(CR)和部分缓解(PR),多西他赛组无患者达到CR。两组的疾病控制率(DCR)分别为80% vs 61%。提升疗效的同时,Dato-DXd显著延长疗效持续时间,两组的中位缓解持续时间(DoR)分别为7.7个月vs 5.6个月。亚组分析显示,无论基线是否伴脑转移、有或无AGA,各关键亚组均有一致的获益趋势,其中AGA亚组获益程度最大,HR值低至 0.35。
安全性方面,相比多西他赛组,Dato-DXd组观察到的≥3级TRAEs发生率更低(22%)。口腔炎、恶心、脱发是Dato-DXd最常见的TRAE,多为1-2级。相比多西他赛,Dato-DXd大幅减少血液学毒性发生率,中性粒细胞减少发生率仅4%,≥3级的发生率不到1%。
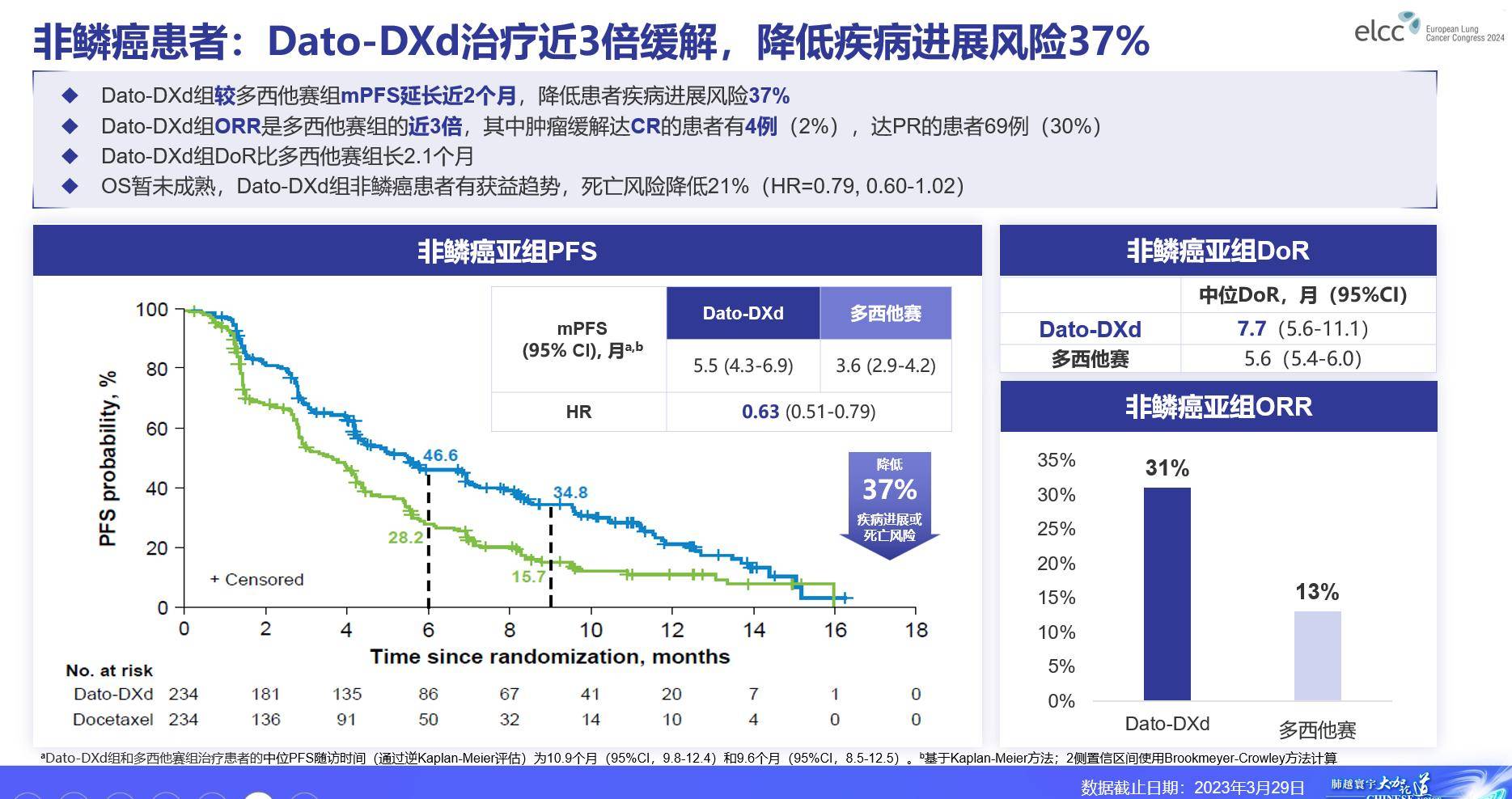 图3 TROPION-Lung01研究非鳞状NSCLC结果
图3 TROPION-Lung01研究非鳞状NSCLC结果
总体而言,TROPION-Lung01研究纳入经化疗/靶向/免疫治疗耐药后的人群,且纳入有和无AGA患者人群,几乎纳入一线治疗耐药后的全部人群,治疗难度大,且这部分患者临床治疗选择有限。令人鼓舞的是,大型III期TROPION-Lung01研究证实,Dato-DXd对比多西他赛在难治性、经多线治疗晚期非鳞状NSCLC患者中,仍能取得优异的疗效。基于此,Dato-DXd已于2024年2月和4月分别在美国和欧盟递交上市申请,期待 Dato-DXd全球上市造福经治晚期NSCLC患者。
HER2 ADC德曲妥珠单抗:设计独特,精准传递高活性细胞毒载药
德曲妥珠单抗是基于DXd-ADC平台设计的新型ADC,同样采用了高活性载荷DXd和基于四肽的可裂解连接子,保证了整体药物更高的抗肿瘤活性,并最大限度减少了系统毒性。德曲妥珠单抗:抗体部分采用人源化HER2 IgG1单抗——曲妥珠单抗,可精准识别并靶向结合HER2阳性肿瘤细胞,并保留曲妥珠单抗的生物学活性,因此具有高选择性和高亲和力。值得注意的是,HER2变异仅发生于肿瘤细胞,较高DAR值不会影响正常细胞,且临床前研究显示德曲妥珠单抗的抗肿瘤活性随DAR的升高而增强。因此德曲妥珠单抗采用了较DAR值约为8,同时稳定且均一的DAR使更多细胞毒载药进入肿瘤细胞,从而能发挥更高的抗肿瘤活性。
DESTINY-Lung02开创HER2突变肺癌治疗新时代
HER2突变是被公认的关键致癌驱动因素,HER2突变在晚期NSCLC患者中的发生率约为2%-4%。数十年来,HER2突变晚期NSCLC领域未取得较大突破,直至2022年8月FDA批准德曲妥珠单抗用于HER2突变晚期NSCLC患者的后线治疗,HER2突变晚期NSCLC患者进入了ADC治疗的新时代。
DESTINY-Lung02研究是一项多中心、随机双盲、剂量优化、非对照研究,旨在评估两剂量德曲妥珠单抗(5.4mg/kg、6.4mg/kg)用于经治HER2突变不可切除或转移性NSCLC患者的疗效。研究纳入携带HER2突变的转移性NSCLC,既往接受过含铂化疗,排除以往或当前患非感染性间质性肺病(ILD)患者。入组患者按2:1比例随机分配接受5.4mg/kg和6.4mg/kg(Q3W)德曲妥珠单抗主要终点为BICR评估的ORR。次要终点包括研究者评估的ORR、DoR、DCR、PFS、OS和安全性。基于该研究初步结果, FDA批准德曲妥珠单抗作为首个用于HER2突变晚期NSCLC患者的靶向疗法在美国上市。总体而言,DESTINY-Lung02研究确定德曲妥珠单抗的最佳剂量,并实现了HER2突变精准靶点“从零到一”的突破。
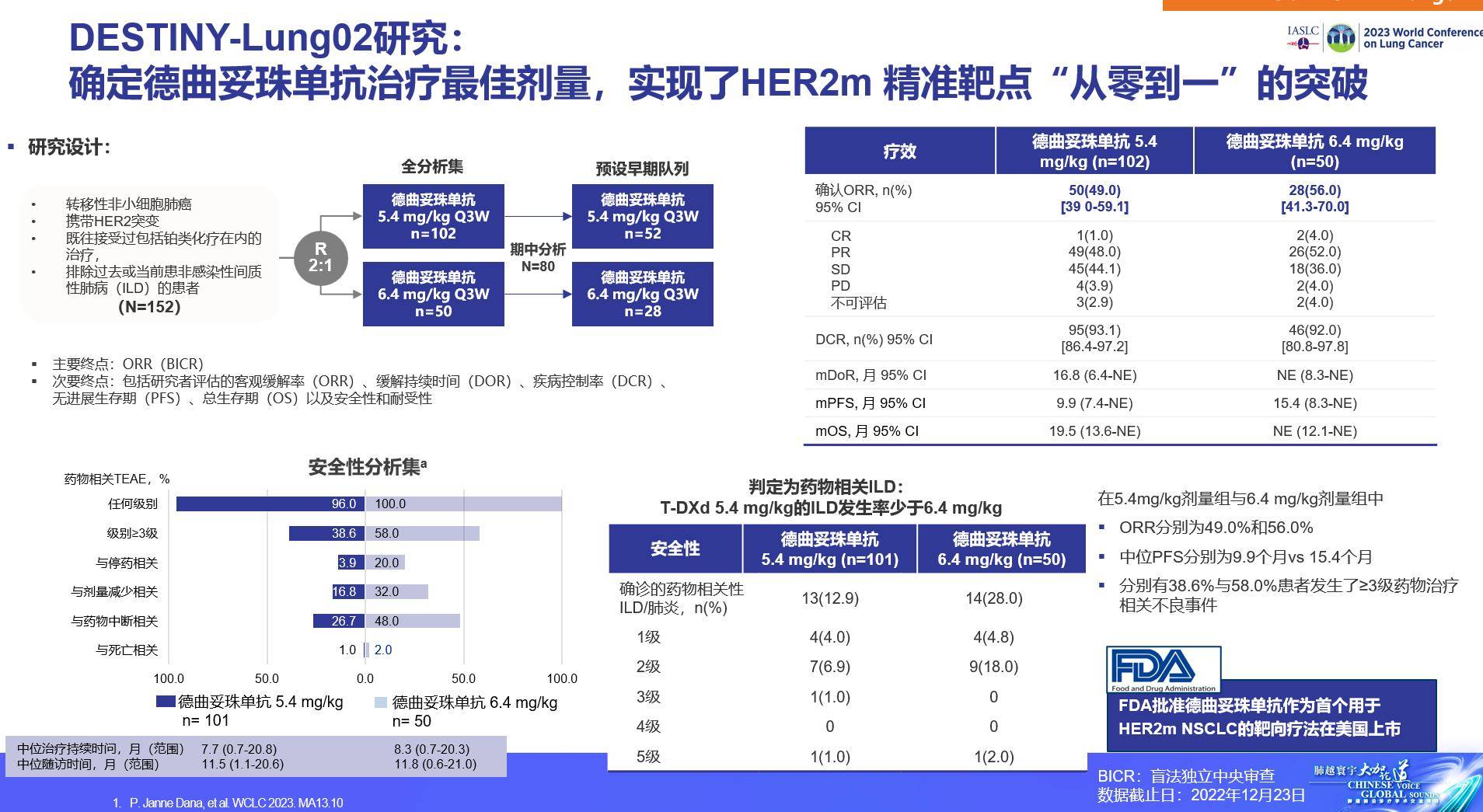 图4 DESTINY-Lung02研究结果
图4 DESTINY-Lung02研究结果
最终分析结果:
DESTINY-Lung02研究结果多次亮相国际学术舞台,在刚落下帷幕的ASCO大会上,该研究公布了最终分析结果。此次最终分析截止日期为2023年8月25日,基线特征显示,5.4mg/kg和6.4mg/kg组亚裔人群分别占比61.8%、60%,分别有73.5%、78%的患者既往接受过PD-1/PD-1单抗。两组的中位随访时间分别为15.8个月、16.5个月,确认的ORR分别为50%、56%;中位DoR分别为12.6个月、12.2个月,DCR分别为93.1%、92%。5.4mg/kg、6.4mg/kg组患者的中位PFS分别为10.0个月、12.9个月,两组中位OS分别为19个月、17.3个月。安全性方面,两剂量组德曲妥珠单抗仍然显示出与既往研究一致的优异抗肿瘤疗效,未出现新的安全性信号,且5.4mg/kg剂量德曲妥珠单抗的安全性更优。总之,最终分析结果与初步分析结果一致,证实了5.4mg/kg剂量德曲妥珠单抗的优异疗效和良好安全性。
DESTINY-Lung05研究为德曲妥珠单抗用于中国人群提供更直接循证依据
DESTINY-Lung05研究是由程颖教授牵头在中国30多家中心开展的一项开放标签、单臂、II期临床研究,旨在评估5.4mg/kg德曲妥珠单抗用于至少一线治疗期间或治疗进展后HER2突变转移性NSCLC中国患者的疗效和安全性。关键入组标准包括病理学确认的非鳞状转移性NSCLC患者、至少接受过一种抗肿瘤全身治疗、经FFPE肿瘤组织检测为HER2突变、WHO或ECOG评分为0或1、按RECIST 1.1标准经研究者至少有一个可测量病灶。主要终点经ICR评估确认的ORR,次要终点包括由研究者评估确认的ORR、以及ICR和研究者评估的DoR、DCR、PFS。
主要结果:
2024 AACR大会上公布的结果显示,中位随访9.8个月时,全分析人群纳入72例至少接受过1剂5.4mg/kg德曲妥珠单抗的HER2突突转移性NSCLC患者。基线特征显示,分别有58.3%、41.7%的患者既往接受过2线及以上、1线治疗。分别有93.1%、90.3%、68.1%、68.1%的患者既往接受过细胞毒化疗、含铂化疗、免疫治疗、抗血管生成药物。
由ICR评估确认的ORR为58.3%,中位DoR未达到,DCR为91.7%,中位PFS未达到。由研究者评估确认的ORR为58.3%,中位DoR为9个月,DCR为93.1%,中位PFS为10.8个月。
安全性方面,和既往试验相比,未发现新的安全性信号。大多数药物相关性间质性肺疾病/肺炎均为低级别(2级)。
 图5 DESTINY-Lung05研究结果
图5 DESTINY-Lung05研究结果
结语:Dato-DXd是对比多西他赛用于经治NSCLC目前首个且唯一III期研究取得PFS阳性结果的ADC药物,且研究发现非鳞状NSCLC是Dato-DXd治疗的更优获益人群。基于TROPION-Lung01研究结果,Dato-DXd已美国和欧盟递交上市申请,Dato-DXd有望成为晚期经治NSCLC患者的新选择。
基于DESTINY-Lung02研究结果,德曲妥珠单抗成为肺癌领域首个获得FDA批准的ADC药物。DESTINY-Lung05研究证实德曲妥珠单抗在中国人群中具有与全球人群一致优异的疗效、良好的安全性,且德曲妥珠单抗已被纳入CDE优先评审,德曲妥珠单抗有望进一步在中国获批并造福中国患者。
排版编辑:肿瘤资讯-Ale











 苏公网安备32059002004080号
苏公网安备32059002004080号


