哈佛医学院联合培养博士生
湖北省临床肿瘤学会第一届肿瘤微环境专家委员会委员
湖北省医学生物免疫学会(ESMI)专家委员会委员
主持 1项国家自然科学基金青年项目
以第一或通讯作者在Hepatology、Clinical cancer research、JBC等医学杂志发表论文多篇
2024 ASCO解读文献
Abstract:1021
TBCRC 048 (olaparib expanded) expansion cohorts: Phase 2 study of olaparib monotherapy in patients (pts) with metastatic breast cancer (MBC) with germline (g) mutations in PALB2 or somatic (s) mutations in BRCA1 or BRCA2
TBCRC 048(奥拉帕利)扩展队列:奥拉帕利单药治疗携带PALB2 胚系基因突变(gPALB2)或 BRCA1、BRCA2 体细胞突变(sBRCA)的转移性乳腺癌患者的II期研究
摘要
背景
TBCRC 048是一项由研究者发起的原理验证II期临床研究,该试验证明了单药奥拉帕利对携带gPALB2或sBRCA突变的转移性乳腺癌患者的治疗效果。本次大会则报道了针对gPALB2(队列1a)或 sBRCA(队列 2a)突变患者扩展队列的研究结果。
方法
2020 年 9 月至 2023 年 10 月间,24 例携带 gPALB2和 30 例 sBRCA突变的转移性乳腺癌患者被纳入相应的扩展队列。纳入标准包括:患者具有可测量的转移性乳腺癌病灶;存在 gPALB2 或sBRCA突变(且gBRCA基因未突变);既往转移阶段化疗线数≤2。排除标准包括:既往使用过PARP抑制剂,或经过铂类药物治疗后进展的患者。入组后,患者接受奥拉帕利 300mg/次、每日2次,直至疾病进展或出现不可耐受的毒性反应。当出现 > 13例应答时,则拒绝所在扩展队列的零假设(即客观应答率(ORR) ≤ 30%)。次要终点指标包括:18周临床获益率(CBR)、无进展生存期(PFS)、应答持续时间(DOR)以及应答者的突变等位基因频率(MAF)是否显著高于无应答者。gPALB2 扩展队列因入组速度慢而提前终止入组。我们采用 Kaplan-Meier 检验估算 PFS 和 DOR,Wilcoxon 秩和检验评估MAF与应答状态之间的相关性。
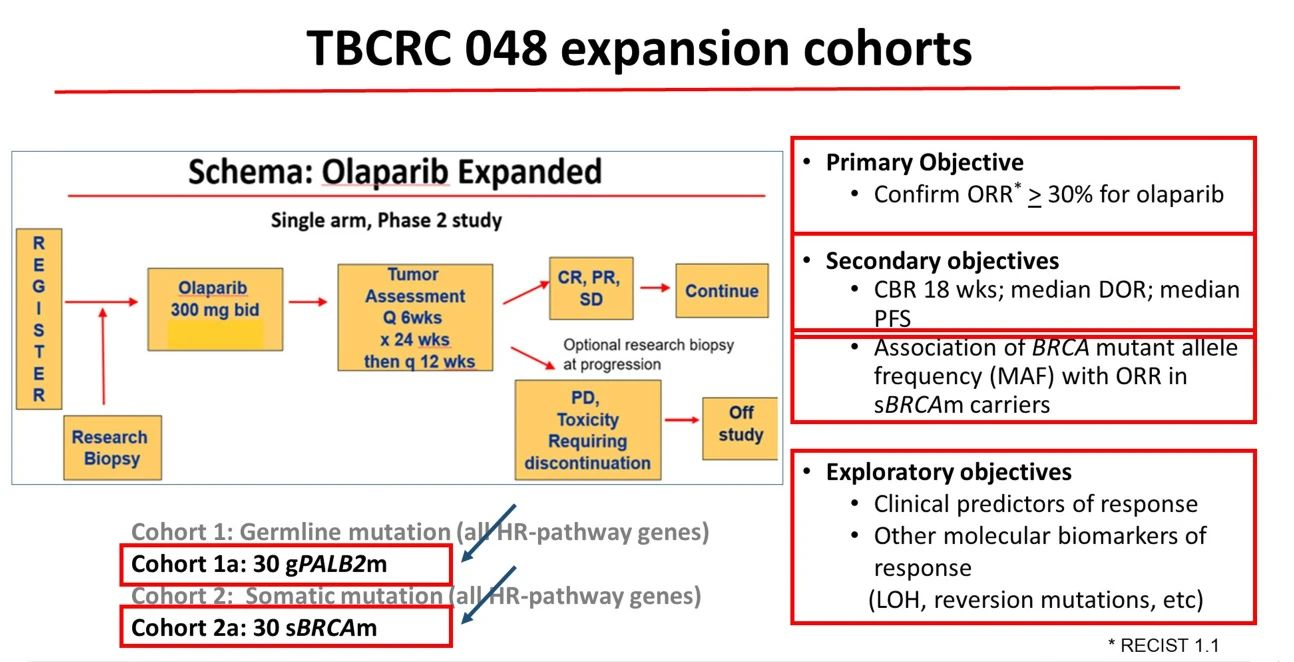
结果
队列1a(gPALB2,n = 24)中,患者的中位年龄为 52.5 岁(范围:26-86)。其中,19名患者为ER+HER2阴性,2名为HER2阳性,3名为三阴性乳腺癌(TNBC)。
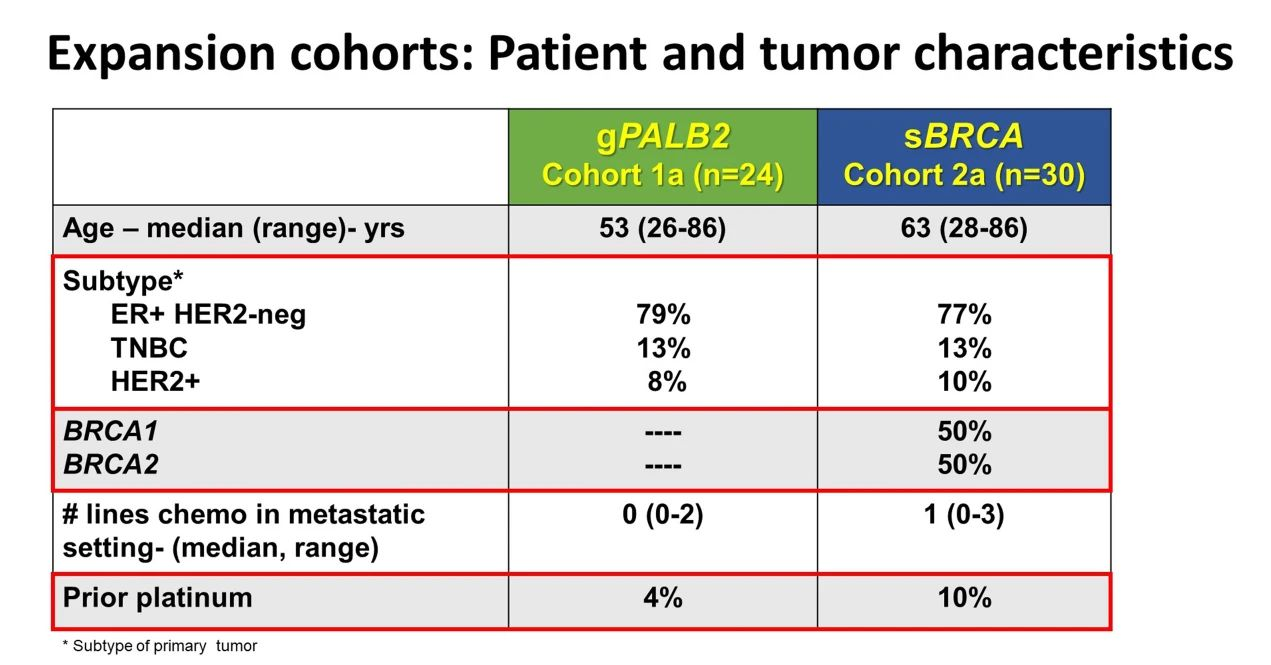
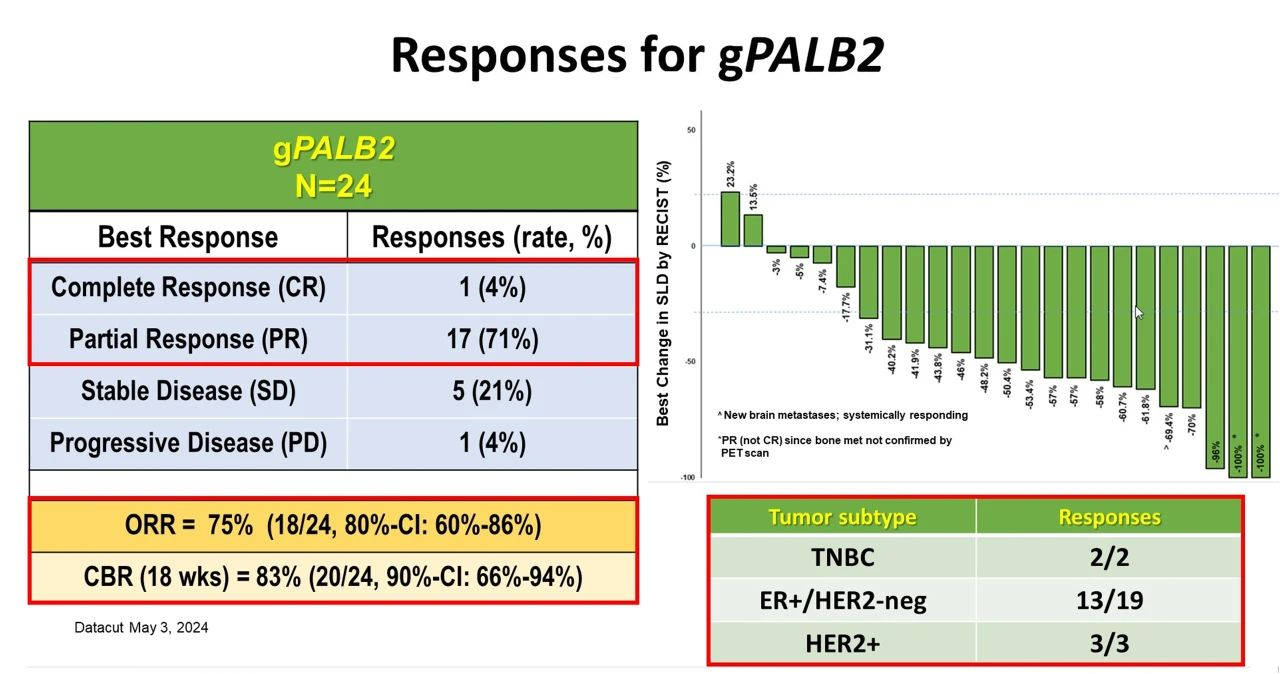
ORR为75%(18/24,80% CI:60.2%-86.3%),18周CBR为83.3%(90% CI:65.8%-94.1%),中位 PFS 为 9.6 个月(90% CI:8.3-12.4),中位 DOR 为 7.1 个月(90% CI:5.6-11.0)。
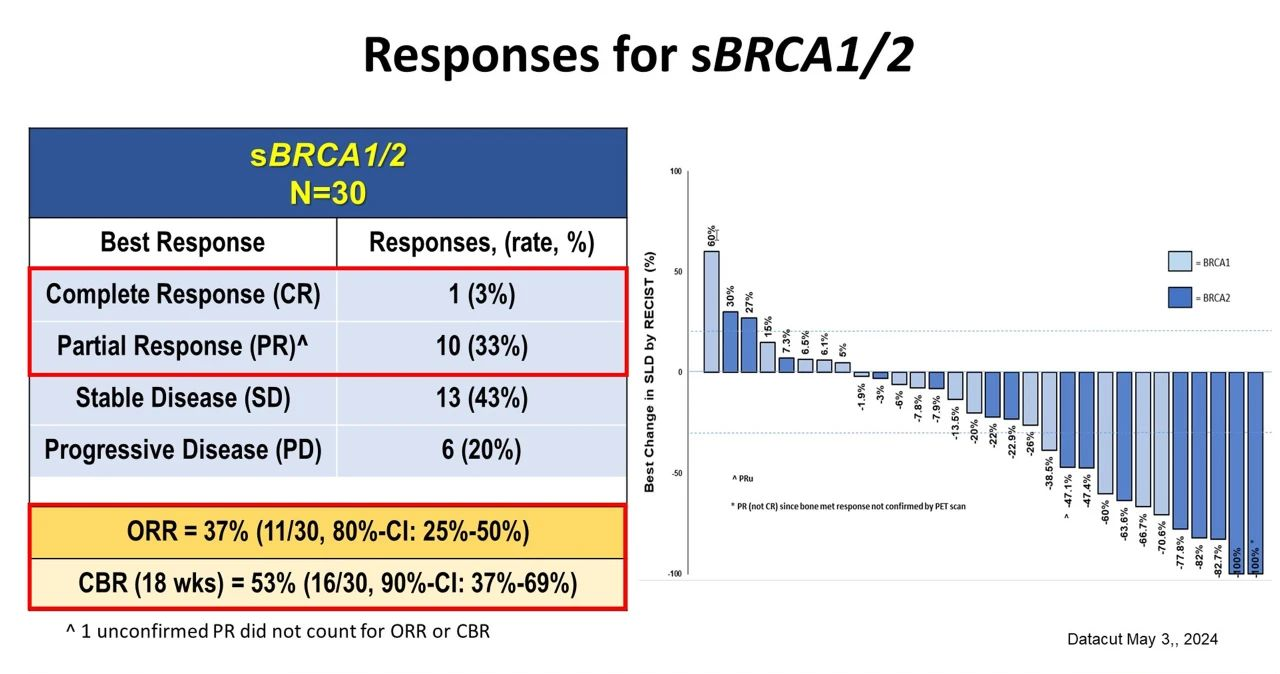
队列 2a(sBRCA1/2,n=30)包含15 例sBRCA1突变型和15 例sBRCA2突变型患者。其中,23名患者为ER+HER2阴性,3名患者为HER2阳性,4名患者为TNBC。ORR 为 36.7%(11/30,80% CI:24.8%-50%), CBR为53.3%(90% CI:37%-69.2%),中位PFS为5.6个月(90% CI:3.0-8.3),中位DOR 为 12.4 个月(90% CI:4.3-未达到)。目前,一名sBRCA突变患者初始报告出现PR,但尚未确认。奥拉帕利治疗反应相关的临床和分子因素正在分析中。
在队列2 +队列2a中,经肿瘤活检鉴定的sBRCA突变患者共46 例,其中33 例可获得 MAF 结果并进行后续评估。应答患者的平均 MAF 为 43%,无应答患者为 39%(p = 0.7),两者无显著性差异。
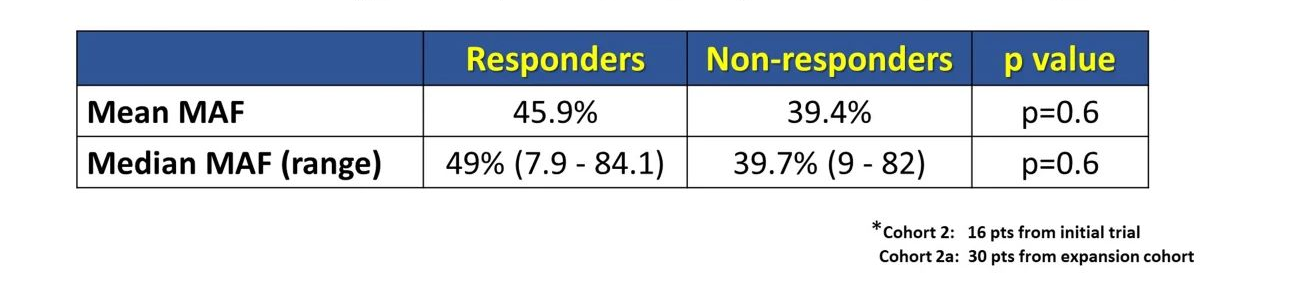
结论
本研究再次证实了对于携带gPALB2突变的转移性乳腺癌女性患者奥拉帕利的高ORR(75%)。此外,奥拉帕利对携带sBRCA突变转移性乳腺癌患者的作用也得到了确认;在这一亚组中,为了确认PARP抑制剂治疗的潜在获益人群,寻找并鉴定应答预测因子至关重要。
临床试验信息:NCT02032823.
解读
PARP抑制剂作用机制,围魏救赵
同源重组修复是细胞修复DNA双链断裂最主要的途径,是一组复杂的蛋白质相互作用的过程,参与的蛋白质主要包括BRCA 1、BRCA 2、ATM、CHEK 2、PALB 2等。表达这些蛋白质的基因发生突变可能引起同源重组修复失败。
碱基切除修复是细胞修复DNA单链断裂最重要的途径,PARP是这一途径的关键修复蛋白。应用PARP抑制剂会形成PARP-PARP抑制剂复合体,导致复制叉停滞、DNA双链断裂,从而启动同源重组修复;同源重组修复缺陷的肿瘤细胞因修复失败而死亡,以达到杀灭肿瘤细胞的作用[1,2]。III期OlympiAD研究已证实PARP抑制剂奥拉帕利在HER-, gBRCA突变的转移性乳腺癌患者的疗效,使其成为首个基于基因突变的乳腺癌精准治疗药物[3]。
Beyond gBRCA,有据可循
除gBRCA1/2突变以外,携带其它同源重组相关基因突变的乳腺癌患者接受PARP抑制剂治疗是否同样有效呢?
TBCRC 048是一个开放标签、非随机、多中心的II期临床研究。该研究从药物作用机制出发,探索奥拉帕利单药对胚系或体细胞同源重组通路基因突变的转移性乳腺癌患者(gBRCA1/2突变除外)的疗效。结果显示奥拉帕利对gPALB2和sBRCA1/2突变患者也具有很好的疗效,ORR分别为82%和50%;而对ATM,CHEK2突变患者治疗效果有限[3]。但值得注意的是,该研究中gPALB2(n=11)、sBRCA1/2 (n=15)突变患者样本量均较小。
为明确上述结果,研究者开展了针对携带 gPALB2和sBRCA突变的转移性乳腺癌患者的奥拉帕利扩展队列研究。此次扩展队列分析结果显示,gPALB2和sBRCA1/2突变人群的ORR和PFS分别为75%和9.6个月,36.7%和5.6个月。同此前OlympiAD研究结果(奥拉帕利单药在gBRCA1/2突变转移性乳腺癌人群的ORR约60%,PFS约为7.0个月)相比,奥拉帕利对gPALB2突变人群的疗效似乎更佳。乳腺癌患者中,2-5%携带gBRCA1/2突变,约1%携带gPALB2突变,3-4%携带sBRCA1/2突变(且gBRCA1/2突变阴性)[4];因此,当奥拉帕利的治疗范围拓展到gPALB2、gBRCA1/2和sBRCA1/2突变人群,获益的患者比例将增加至6-10%。
精准治疗,未来可期
奥拉帕利在部分同源重组缺陷乳腺癌患者中已经表现出了优异的疗效。由于充分地评估奥拉帕利对所有同源重组修复相关基因突变乳腺癌患者的疗效极为困难,这使得鉴定奥拉帕利应答的预测因子,包括肿瘤突变特征、功能学实验、双等位基因失活等,从这一维度精准识别奥拉帕利治疗的获益人群至关重要,是未来需要开展的工作;同时,PARP抑制剂联合其它治疗,如免疫治疗、抗血管生成药物以及其它靶向药物的联合治疗临床试验正在进行,这可能使PARP抑制剂有更好的临床应用前景,最终使更多乳腺癌患者从中获益。
姚静教授—华中科技大学同济医学院附属协和医院
胡悦医生解读的这篇ASCO摘要为TBCRC 048的扩展队列研究结果。因TBCRC 048前期已证实奥拉帕利在gPALB2、sBRCA1/2突变患者中同样获益,但因样本量太少而进行了后续扩展队列研究。该ASCO会议摘要提前汇报了该扩展队列非常优异的结果,有望将奥拉帕利的适用范围从gBRCA1/2拓展到gPALB2、gBRCA1/2和sBRCA1/2, 从而让更多的转移性乳腺癌患者获益。胡医师不仅对摘要进行了简明、扼要和准确地翻译,还从PARP抑制剂作用机制出发,循序渐进地引导大家理解该临床研究的目的,精彩解读了研究结果,分析了未来应用的前景。此次解读深入浅出,逻辑清晰,发人深思。
【温馨提示】:如果您觉得胡悦医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. James M Cleary, Andrew J Aguirre, Geoffrey I Shapiro, Alan D D'Andrea. Biomarker-Guided Development of DNA Repair Inhibitors. Mol Cell. 2020 Jun 18;78(6):1070-1085.
2. Laura Cortesi, Claudia Piombino, Angela Toss. Germline Mutations in Other Homologous Recombination Repair-Related Genes Than BRCA1/2: Predictive or Prognostic Factors? J Pers Med.2021 Mar 28;11(4):245.
3. Mark Robson, Seock-Ah Im, Elżbieta Senkus, etal.Olaparib for Metastatic Breast Cancer in Patients with a Germline BRCA Mutation. N Engl J Med. 2017 Aug 10;377(6):523-533.
4. Nadine M Tung, Mark E Robson, Steffen Ventz, et al. TBCRC 048: Phase II Study of Olaparib for Metastatic Breast Cancer and Mutations in Homologous Recombination-Related Genes. J Clin Oncol. 2020 Dec 20;38(36):4274-4282.











 苏公网安备32059002004080号
苏公网安备32059002004080号


