食管癌患者的早期临床症状较为隐匿,大多数患者确诊时已为局部晚期或存在远处转移。而这类患者进行单纯的手术治疗获益有限,,因此,国内外指南均推荐术前行新辅助治疗,。目前,已有高质量证据的荟萃分析结果显示,同单纯手术治疗相比,新辅助治疗模式能显著改善了局部晚期/局部进展期食管癌患者术后的总生存期(OS)。
近年来,随着免疫治疗进展,已有部分临床研究探索了新辅助免疫治疗在局晚期食管癌中的获益情况,并取得了初步疗效,,但目前局晚期食管癌新辅助免疫治疗的标准模式仍未建立,临床上能否为局晚期食管癌患者使用新辅助免疫治疗?以及如何平衡免疫治疗的疗效与安全性?这些问题都给临床决策带来了一定的阻力。
本文特分享一例局晚期食管癌患者新辅助免疫治疗术后pCR的真实临床病例,希望能为局晚期食管癌患者的临床治疗带来更多启发。
病例介绍
基本情况
一般情况:患者男性,55岁
主诉:确诊食管癌2月余,要求进一步治疗
既往史:无殊
个人史:吸烟史30年,40支/日,戒烟3月
体格检查:T:36.3℃,HR:81次/分,R:16次/分,BP:143/94mmHg。 颈部软,颈静脉无充盈,气管居中,颈部、锁骨上等浅表淋巴结未触及肿大;胸部无畸形,呼吸运动对称,无胸壁压痛,语颤对称,叩诊双侧对称、清音,听诊两肺呼吸音清,未闻及干湿罗音;心律齐,未闻及病理性杂音。
治疗前辅助检查
2023-7-25 胸部增强CT:食管中上段壁明显环形增厚,并见结节状腔内突出,大小约31mm*36mm,增强后病灶可见不均匀轻度强化,纵隔多发肿大淋巴结,较大者位于右上纵隔,大小约34mm*47mm。考虑食管中上段MT伴纵隔多发肿大转移淋巴结。
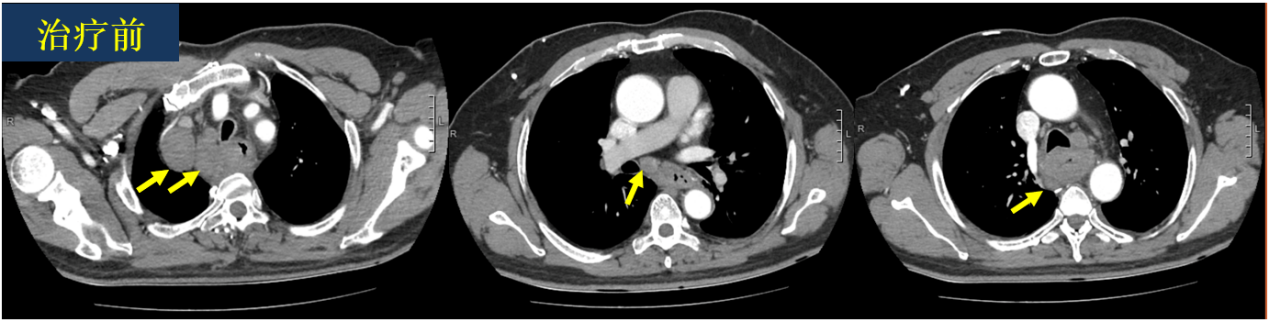
2023-7-25 胸部增强CT
2023-08-01 电子胃镜:距门齿25-30cm可见一巨大溃疡性病变,周围粘膜不规则隆起,予活检僵硬,易出血。
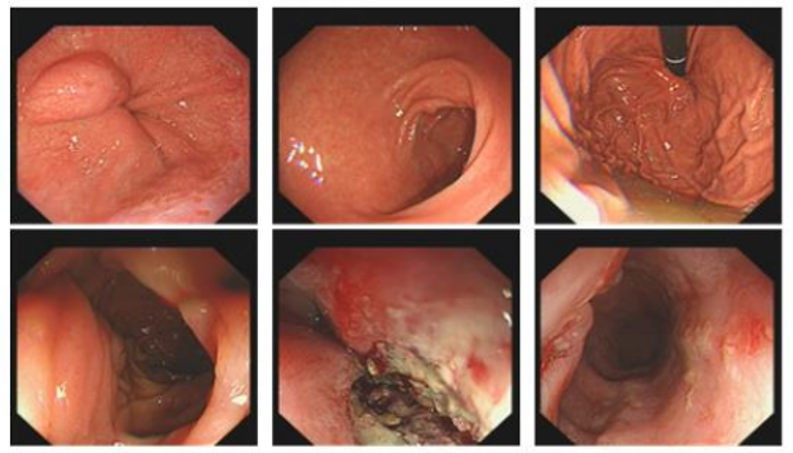
2023-08-01 电子胃镜
2023-08-07 胃镜活检:(食道中段)大片坏死组织中见极少量异型上皮,免疫组化:(蜡块)(食道中段):CK(pan)(+), P40(+), P53(克隆号DO-7):(异常过表达), Ki-67(+80%)(食道中段)结合免疫组化,大片坏死组织中见极少量鳞状细胞癌。
临床诊断
食管恶性肿瘤 (鳞癌, cT3N2M0) (IIIb期)
治疗经过
(1) 新辅助治疗
完善新辅助治疗前检查,未见明显禁忌。患者于2023-08-12、2023-09-02、2023-09-23分别行新辅助治疗,共3个周期。方案为:多西他赛120mg+奈达铂100mg+斯鲁利单抗300mg化疗免疫治疗。治疗期间无明显不良反应。
(2)新辅助治疗后辅助检查
2023-10-14 电子胃镜:距门齿25-30cm可见一溃疡性病变,表面稍充血。占位较前缩小。
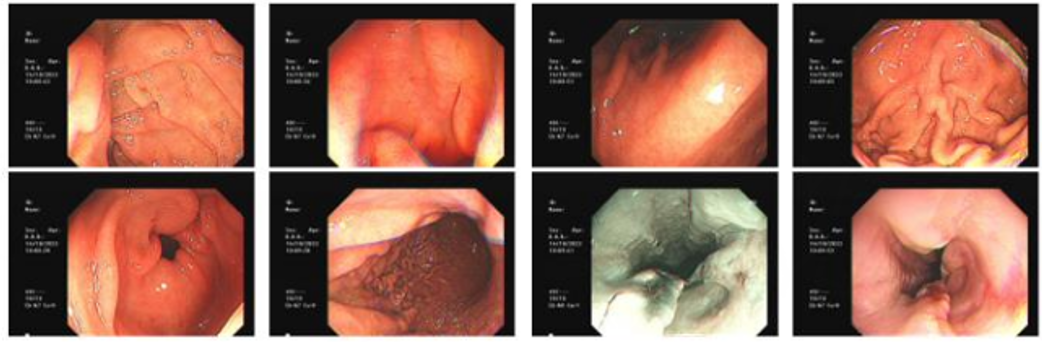
2023-10-14 电子胃镜
2023-10-15 胸部增强CT:食道中上段壁稍增厚,增强后病灶可见不均匀轻度强化,周围可见多发淋巴结影,较大者位于右上纵隔,大小约31mm×19mm,增强后可见轻度强化。对比2023-07-25 CT增强:纵隔淋巴结较前缩小,食管壁增厚情况较前好转。
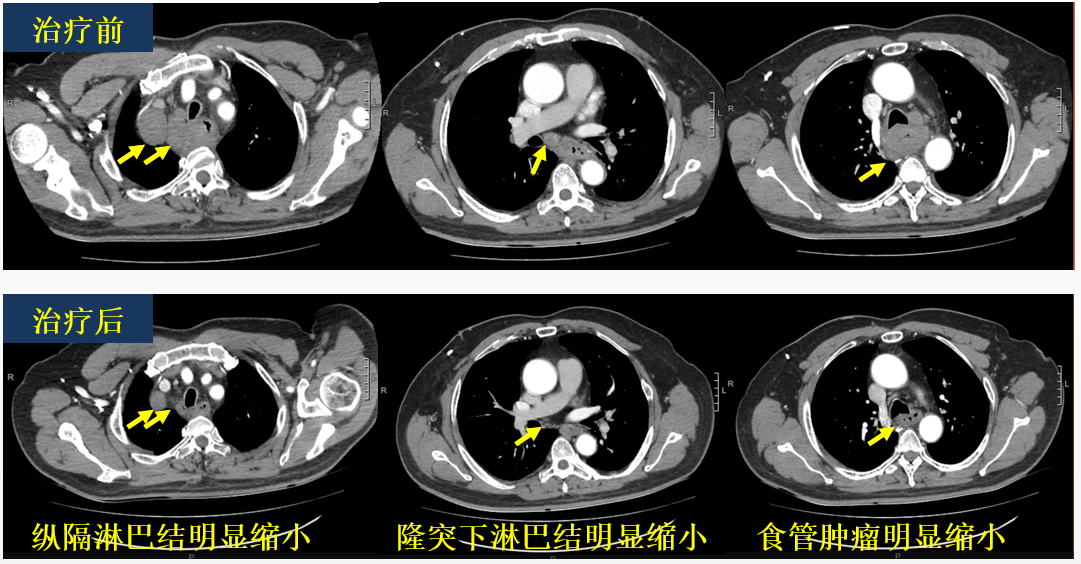
治疗前与治疗后的胸部增强CT对比
(3)手术治疗
患者于2023-10-13入住我科,排除手术禁忌后。于2023-10-18在全麻下行胸腔镜辅助颈胸腹三切口 (Mc-Keown) 食管癌根治术。术中快速冰冻病理:食管切缘(-),胃切缘(-),右前上纵隔肿瘤符合淋巴组织增生伴广泛纤维化。术后常规病理:患者食管中上段鳞癌 (pTisN0M0)。
(4)术后病理结果
术后病理结果提示达到病理学完全缓解 (pCR)。

(5)术后治疗方案
患者出院后拟继续化疗联合免疫治疗2个周期,2个周期后免疫单药维持。
病例小结
该病例患者为男性,55岁,因“确诊食管癌2月余,要求进一步治疗”入院,进行胸部CT、电子胃镜和胃镜活检等检查后诊断为食管鳞癌IIIb期。经完善新辅助治疗前检查后,于2023-08-12、2023-09-02、2023-09-23分别行3周期新辅助治疗,方案为“多西他赛120mg+奈达铂100mg+斯鲁利单抗300mg”的免疫治疗联合化疗,3周期后复查电子胃镜及胸部增强CT均显示肿瘤缩小。随后于2023-10-18在全麻下行胸腔镜辅助颈胸腹三切口 (Mc-Keown) 食管癌根治术,术后病理结果提示达到病理学完全缓解 (pCR),术后继续予以化疗联合免疫治疗2个周期,2个周期后免疫单药维持。
讨论
对于局晚期食管鳞癌患者,手术治疗以及围手术期的新辅助、辅助治疗是其标准治疗方案3。然而对于这类患者,能否使用新辅助免疫治疗,由于尚缺乏大型III期随机对照试验的证据,因此临床上尚未建立新辅助免疫治疗标准。
最近,一项系统评价和荟萃分析研究探讨了新辅助免疫治疗对可切除局部晚期食管鳞状细胞癌(ESCC)患者的疗效和安全性。该研究纳入了涉及1406名患者的30项试验,结果显示,新辅助免疫治疗的汇总pCR 率为30%(95% CI: 0.26–0.33)。其中,新辅助免疫联合放化疗(nICRT)的pCR率显着高于新辅助免疫联合化疗(nICT)(nICRT:48%;nICT:29%; p=0.03);在安全性方面,与接受nICT治疗的患者相比,接受nICRT治疗的患者3-4 级治疗相关的不良事件(TRAE)发生率更高(nICRT:46%;nICT:14%;p = 0.03)。这些结果支持新辅助免疫治疗联合化疗或联合放化疗在临床上的广泛应用,但由于纳入的研究大多为单臂II期临床研究,且缺乏长期生存结果,因此仍需要更多的证据来证明新辅助免疫治疗的疗效及安全性。
另外,我国的一项真实世界多中心回顾性研究也探讨了免疫检查点抑制剂(ICIs)在食道癌的新辅助治疗中的有效性和安全性。该研究回顾性分析了370例局晚期食管癌患者,结果显示,有80.8%的患者接受了新辅助免疫联合化疗,11%为新辅助免疫单药治疗,8%为新辅助免疫联合放化疗,共有92.2%患者在新辅助治疗后接受了手术,且97.7%的患者实现了R0切除,原发肿瘤的局部pCR率达到了34.6%;在安全性方面,有53.8%的患者观察到TRAE,大部分为1~2级。这项真实世界研究提示,新辅助免疫治疗对局部晚期食管癌具有良好的疗效和耐受性,但长期生存结果还有待进一步研究。
本病例患者新辅助免疫治疗中使用的斯鲁利单抗,是由我国自主研发上市的一款PD-1抑制剂。尽管目前尚无关于斯鲁利单抗的新辅助免疫治疗临床研究,但ASTRUM-007研究提示,斯鲁利单抗联合化疗一线治疗晚期ESCC取得了亮眼的结果。该研究的最新数据显示,在中位随访时间为24.2个月时,斯鲁利单抗+化疗较安慰剂+化疗可显著延长OS,中位OS分别为14.6个月和11.2个月(HR 0.70, 95% CI 0.57–0.86; P =0.0006)。亚组分析数据还显示,在PD-L1 CPS≥10人群中,斯鲁利单抗+化疗方案的获益更加突出,两组的中位OS分别为18.6个月和13.9个月(HR=0.59,p=0.0082),斯鲁利单抗显著降低死亡风险41%。
在本病例中,这位局晚期食管癌患者经过斯鲁利单抗联合化疗一线治疗3周期后,电子胃镜及胸部增强CT均显示肿瘤缩小,术后病理结果也提示达到了pCR,这提示斯鲁利单抗联合化疗方案作为新辅助治疗在局晚期食管癌的临床实践中同样具有良好的疗效。期待未来有更多的大型临床研究数据,来证明斯鲁利单抗联合化疗在局晚期食管癌新辅助治疗中的疗效和安全性,为更多的局晚期食管癌患者带来更好的新辅助治疗手段。
主治医师
苏州大学医学院胸外科硕士研究生
长期从事普胸外科临床工作
专业方向:肺磨玻璃结节、纵隔肿瘤、食管肿瘤、气胸、手汗症的诊断与微创治疗
先后在国际、国内期刊发表多篇论文
1.Reeh M, Nentwich MF, Asani S, et al. Locally advanced esophageal carcinoma: is there still a role of surgery alone without neoadjuvant treatment?. J Gastrointest Surg. 2015;19(4):587-593.
2.Yu S, Zhang W, Ni W, et al. A propensity-score matching analysis comparing long-term survival of surgery alone and postoperative treatment for patients in node positive or stage III esophageal squamous cell carcinoma after R0 esophagectomy. Radiother Oncol. 2019;140:159-166.
3.NCCN Guidelines Version 3.2023:Esophageal and Esophagogastric Junction Cancers.
4.中国临床肿瘤学会(CSCO).食管癌诊疗指南2023.
5.Fan N, Wang Z, Zhou C, et al. Comparison of outcomes between neoadjuvant chemoradiotherapy and neoadjuvant chemotherapy in patients with locally advanced esophageal cancer: A network meta-analysis. EClinicalMedicine. 2021;42:101183.
6.Yin J, Yuan J, Li Y, et al. Neoadjuvant adebrelimab in locally advanced resectable esophageal squamous cell carcinoma: a phase 1b trial. Nat Med. 2023;29(8):2068-2078.
7.Liu J , Li Z , X Fu, et al. 127P A prospective phase II clinical trial exploring neoadjuvant immunotherapy combined with chemotherapy in resectable thoracic esophageal squamous cell cancer (TESCC) with multi-station lymph node metastases (NICE study): Preliminary results. Annals of Oncology, 31.
8.He W, Wang C, Li C, et al. The efficacy and safety of neoadjuvant immunotherapy in resectable locally advanced esophageal squamous cell carcinoma: A systematic review and meta-analysis. Front Immunol. 2023;14:1118902.
9.Yang Y, Tan L, Hu J, et al. Safety and efficacy of neoadjuvant treatment with immune checkpoint inhibitors in esophageal cancer: real-world multicenter retrospective study in China. Dis Esophagus. 2022;35(11):doac031.
10.Issafras H, et al. PLoS One. 2021;16(12):e0257972.
11.Jing Huang, et al. 2023 ASCO.#Abstract e16016.
12.Song Y, et al. Nat Med. 2023;29(2):473-482.
排版编辑:肿瘤资讯-王佳媛











 苏公网安备32059002004080号
苏公网安备32059002004080号


