人类表皮生长因子受体2(HER-2)为胃癌治疗的标志性靶点,自2010年起,随着抗HER-2单抗曲妥珠单抗的问世,胃癌进入了精准靶向治疗新时代。然而在此后相当长一段时间内,针对HER-2阳性胃癌的靶向治疗研究进展缓慢。直至近年来,随着针对HER-2的抗体药物偶联物(ADC)在胃癌治疗领域取得显著成果,这一领域再次迎来了治疗新突破。惠州市中心人民医院谢丹医生分享1例HER-2(3+)晚期胃癌病例:患者男性,62岁,胃中-低分化腺癌。胃癌根治术后诊断为ⅢA期胃癌(pT4aN1M0),术后4个月出现复发,经一线、二线治疗进展后,三线治疗采用我国自主研发的抗HER-2 ADC维迪西妥单抗联合PD-1单抗治疗,最终达到临床完全缓解(cCR),且无进展生存期(PFS)已超过12个月。【肿瘤资讯】将病例诊疗过程整理如下,并邀请惠州市中心人民医院欧阳考滨教授对病例进行点评,以飨读者。
病例介绍
专家介绍
广东省医学教育协会肿瘤诊疗技术转化专业委员会委员
广东省临床医学学会真实世界研究专业委员会委员
惠州市抗癌协会委员惠州市医学会肿瘤学分会委员
惠州市抗癌协会肺癌专业委员会委员
惠州市中西医结合学会肿瘤专业委员会委员
基本情况
患者,男性,62岁。
现病史:于2020年1月出现反复排黑色成形大便,在当地医院就诊,查血常规:血红蛋白 105g/L。
既往史:有高血压病史。
个人史、家族史:无特殊。
诊疗经过
2020-01-17全腹CT平扫及增强结果:1.胃角-胃窦部胃壁增厚、局部软组织肿块影,考虑恶性肿瘤(胃癌?)可能性大,建议活检,排除其他病变(图1)。
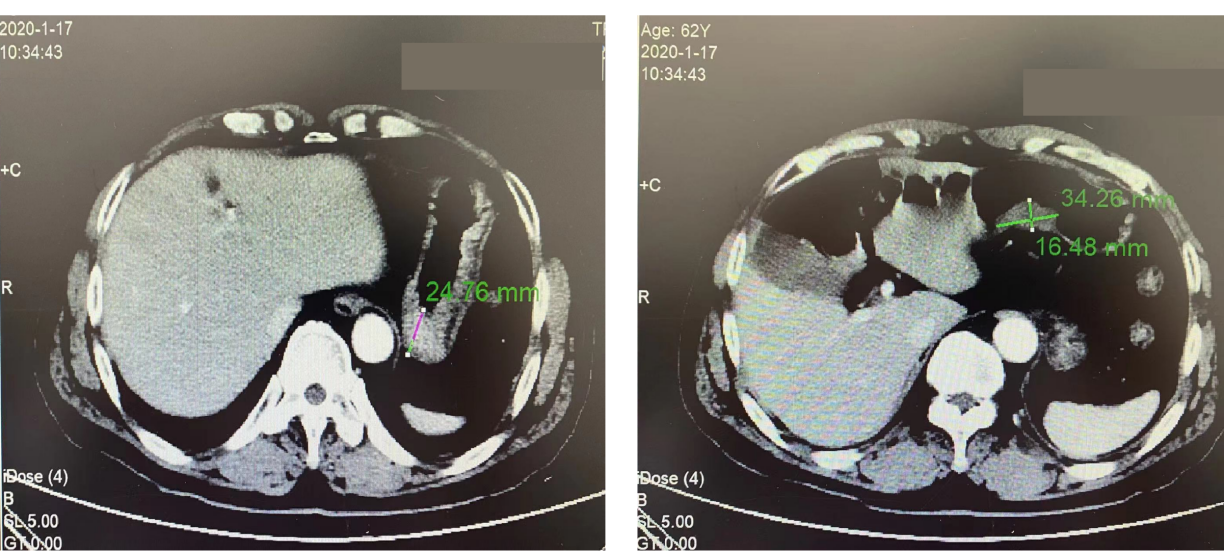
图1 2020-01-17全腹CT平扫及增强
2020-01-19胃镜病理检查显示c-erbB2(3+)。
2020-01-22行腹腔镜远端胃根治性切除+肠粘连松解+腹腔引流术,组织学:(胃窦肿物)浸润性中-低分化腺癌,部分呈粘液腺癌,癌组织侵及胃壁全层达周围脂肪组织,并见脉管及神经侵犯,两切缘及另送(远、近切缘)未见癌。(胃周淋巴结)见癌转移(2/11)。术后病理示:1.浸润性腺癌,腺泡型约占50%,乳头型占30%,实体型占10%;2.淋巴结均未见癌转移。
术后诊断:ⅢA期胃癌(pT4aN1M0)
术后恢复可,术后患者未遵医嘱行抗肿瘤化疗。
2020-05-20患者反复上腹部隐痛,查体剑突下可触及可疑包块。外院复查PET-CT,考虑腹膜转移灶可能性大(图2)。
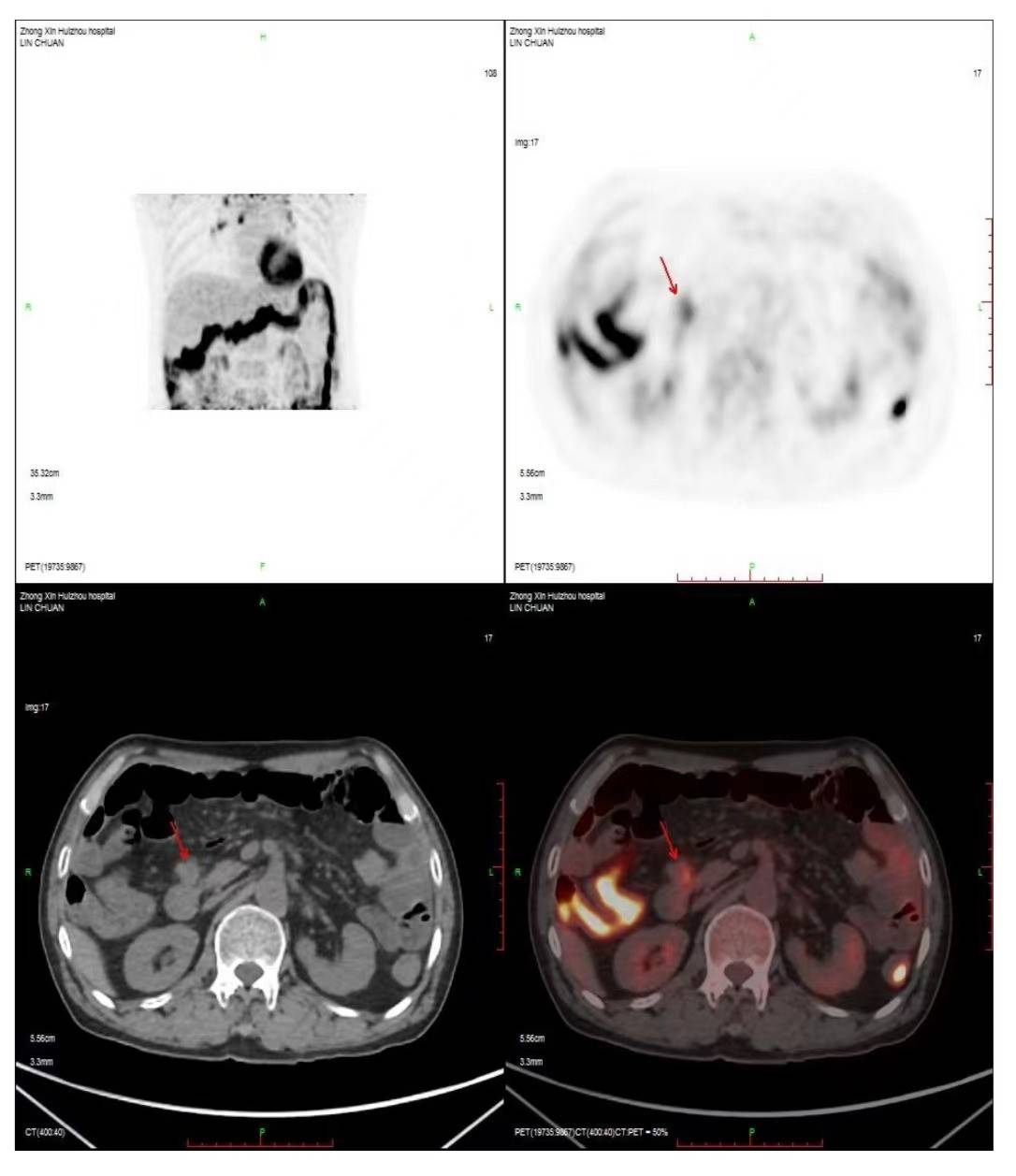
图2 2020-05-20 PET-CT
一线治疗
2020-05-22至2021-07-15行伊立替康+替吉奥方案化疗6程,具体为伊立替康280mg d1+替吉奥80mg d1-14,过程顺利,3程、6程化疗后,评效:疾病稳定(SD)。随后行单药S-1维持化疗13程,具体为替吉奥80mg D1-14,过程顺利。3程、6程、9程、12程治疗后,评效:SD。
2021-4-9复查CT:胃大部分切除术后改变,残胃及吻合口壁稍厚,未见明显肿块及异常强化灶。
二次手术治疗
2021-10-09外院PET-CT示:胃癌术后、化疗后,十二指肠盲端高代谢结节影较前增大、代谢增高,考虑为肿瘤复发(较前进展)(图3)。
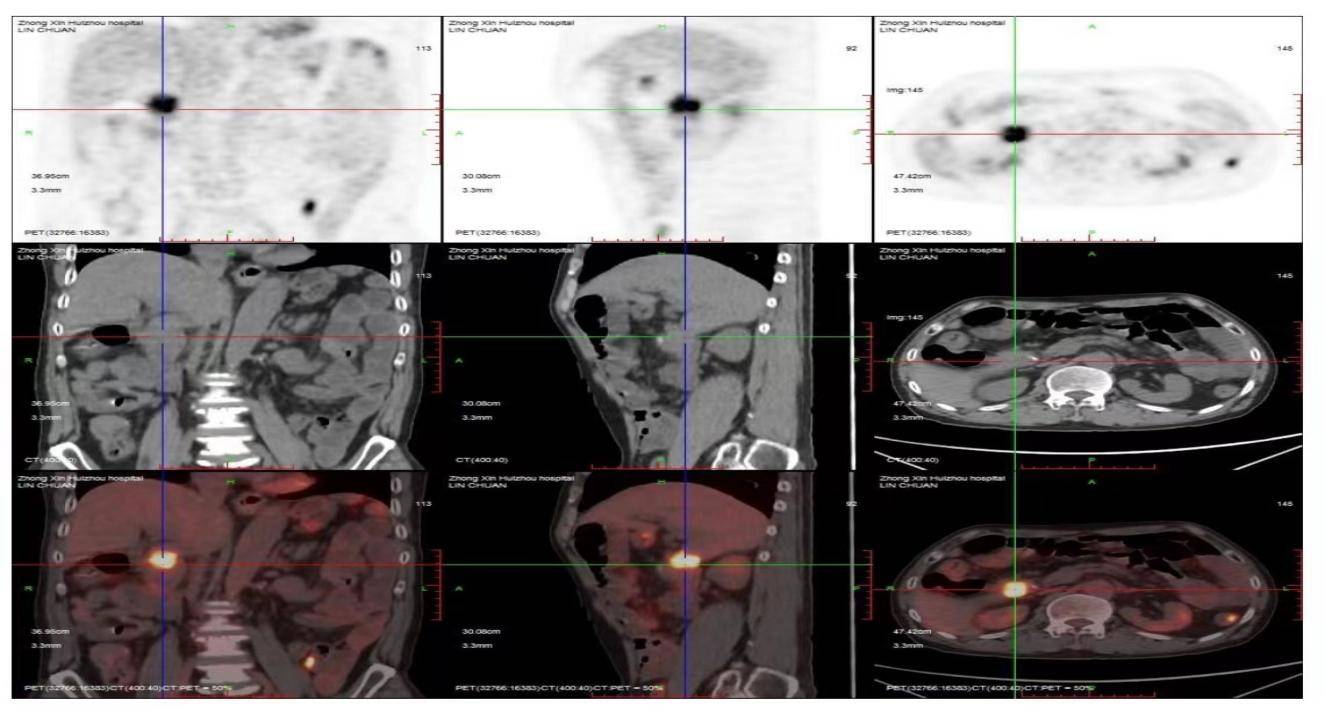
图3 2021-10-9 PET-CT
2021-10-27行“腹腔镜探查+中转开腹+胰十二指肠切除术”。术后病理提示胃腺癌转移。
二线治疗
2021-12-10到2022-7-13予曲妥珠单抗+XELOX方案6程,具体为曲妥珠单抗400mg(首次)/300mg+奥沙利铂180mg+卡培他滨3.0g D1-14;随后予曲妥珠单抗+卡培他滨减量方案5程,具体为曲妥珠单抗280mg+卡培他滨2.0g D1-14。
2022-05-22复查CT:残胃及吻合口壁稍厚;未见明显肿块及异常强化灶;胰-肠吻合口壁增厚并周围多发小淋巴结,大致同前。
三线治疗
2022-7-19外院PET-CT示:1.肝尾状叶前方、中腹部系膜区新增2个结节状高代谢病灶,考虑为转移; 2.肝右叶后上段新增2枚转移灶(图4)。
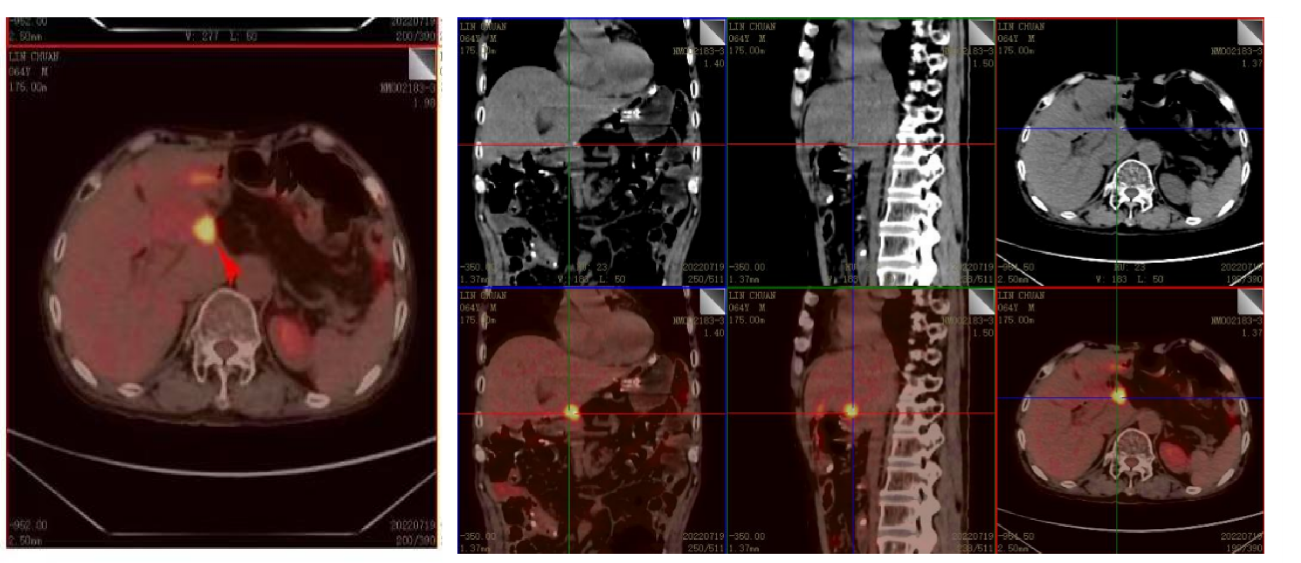
图4 2022-7-19外院PET-CT
肝右叶新发2个病灶,考虑病情进展,与患者及其家属沟通病情后,建议改用ADC药物(维迪西妥单抗),家属表示理解并同意,予“维迪西妥单抗 120mg Q2W”靶向治疗。
2022-08-03至2023-01-13予“维迪西妥单抗 120mg Q2W”靶向治疗11次,过程顺利。2022-08-18至2023-01-13予联合“信迪利单抗 200mg Q3W”免疫治疗7程。2022-01-30复查CT:残胃及吻合口壁稍厚;未见明显肿块及异常强化灶;胰-肠吻合口壁增厚并周围多发小淋巴结,大致同前。评效:SD。
2023-1-30至2023-04-25考虑到患者病程中体重下降明显,治疗耐受性差,予以调整药物剂量“维迪西妥单抗110mg+信迪利单抗130mg”5程。
2023-05-16复查PET-CT提示肝部病灶完全消失、中腹部肠系膜转移灶消失。评效:临床完全缓解(cCR)(图5)。
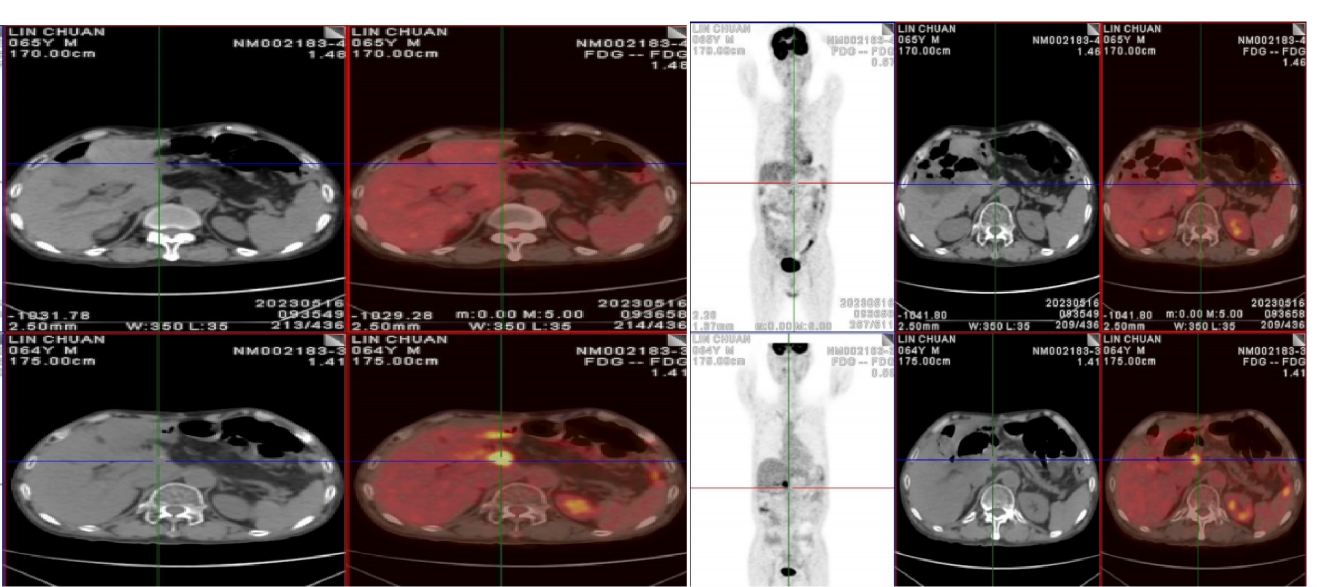
图5 2023-5-16外院PET-CT
使用维迪西妥单抗+PD-1单抗后患者的CEA、CA72-4明显下降,最终降至正常水平。CEA、CA72-4复查结果变化趋势见图6-7。
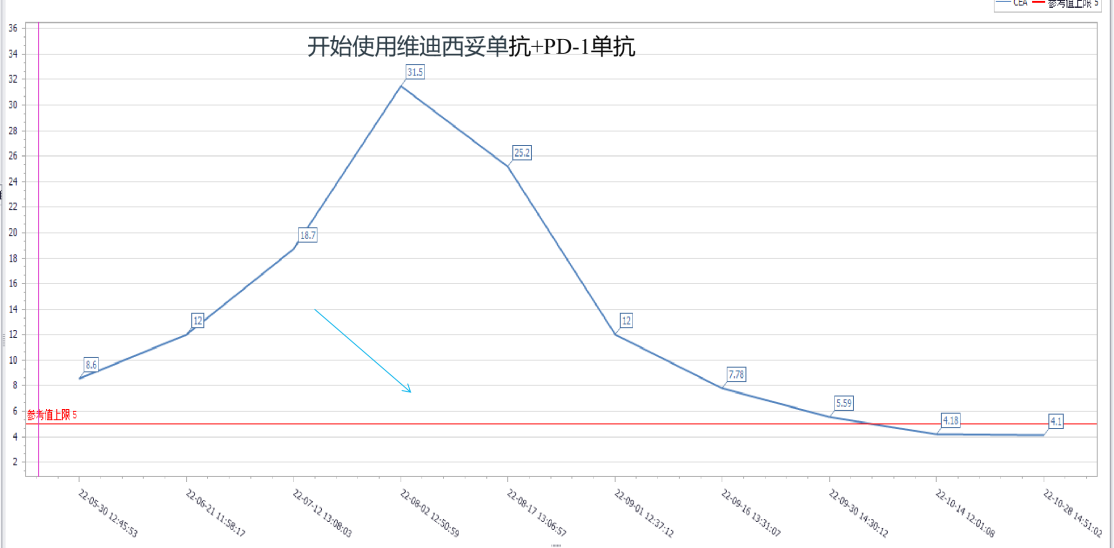
图6 CEA变化趋势
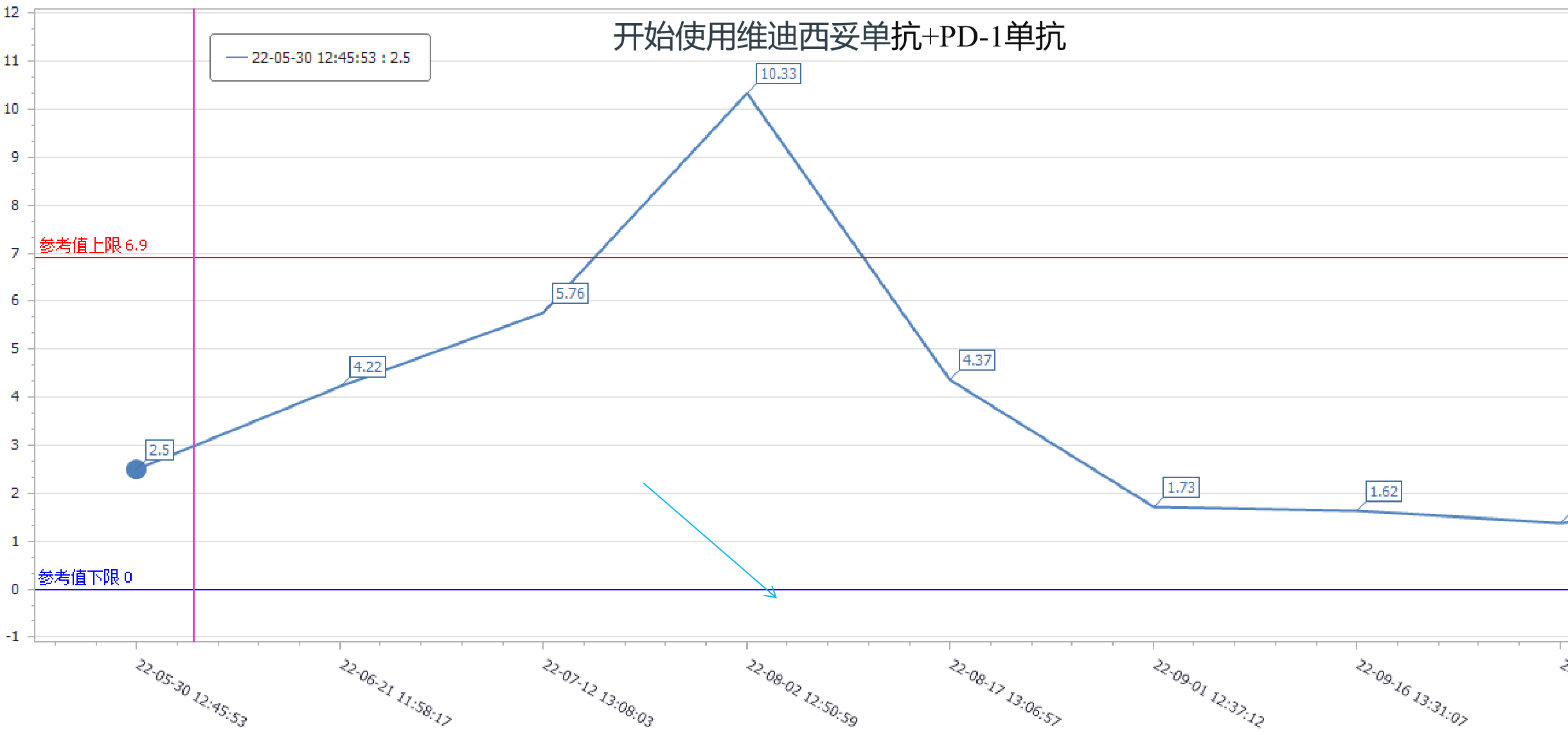
图7 CA72-4变化趋势
诊疗经过见图8。
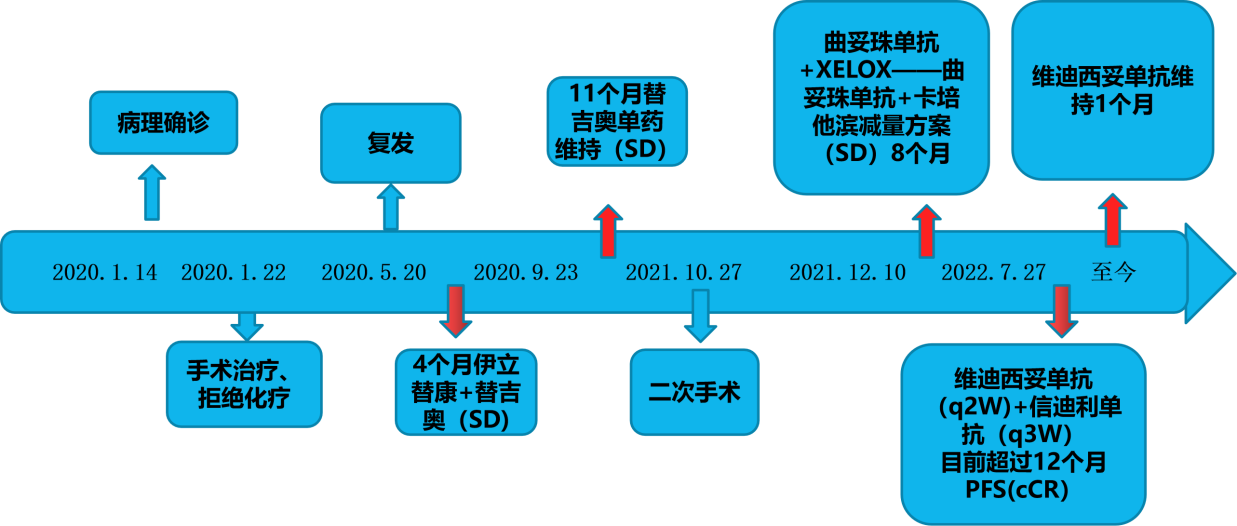
图8 诊疗经过
病例总结:
该62岁男性患者,胃浸润性中-低分化腺癌。行腹腔镜远端胃根治性切除+肠粘连松解+腹腔引流术,术后诊断为ⅢA期胃腺癌(pT4aN1M0),HER2(3+)。术后患者恢复可,未遵医嘱行抗肿瘤化疗。复发后一线采用伊立替康+替吉奥方案化疗6程,3程后达到SD。随后单药替吉奥维持化疗12程,维持SD。二线采用曲妥珠单抗+XELOX方案化疗6程,复查CT未见明显肿块,但患者出现体重降低,进行减量治疗。三线采用ADC药物维迪西妥单抗联合PD-1单抗治疗,复查PET-CT,提示肝部病灶完全消失、中腹部肠系膜转移灶消失,达到cCR。
病例点评
专家介绍
亚太原发性肝癌专家协会(APPLE)委员
中国抗癌协会肿瘤临床化疗专业委员会委员
中国抗癌协会肿瘤消融治疗专业委员会委员
中国抗癌协会感染性肿瘤专业委员会委员
中国医院协会精准医疗分会委员
中国医药教育协会肿瘤内放射治疗专委会委员
广东省器官医学与技术学会肿瘤精准医学专委会常委
广东省抗癌协会肿瘤微创介入专业委员会 委员
广东省肝脏病协会微创分会 委员
广东省医学会肿瘤学分会第八届青委
广东省医学会肿瘤内科学委员会青委
本例患者诊断为HER2(3+)中-低分化胃腺癌,胃癌根治术后未遵医嘱进行规范的抗肿瘤治疗,这可能是导致疾病复发的关键因素。在复发后,患者首先接受了伊立替康+替吉奥方案一线化疗,并随后进行了单药替吉奥维持化疗,虽然达到了SD,但未能有效阻止病情进一步进展。鉴于患者HER2(3+)的表达状态,二线治疗采用曲妥珠单抗联合XELOX方案,但患者出现了一定程度的耐受性问题,需要对治疗剂量进行调整。
面对疾病再次进展,患者接受了维迪西妥单抗联合PD-1单抗三线治疗,这一决策成为治疗过程中的重要转折点。维迪西妥单抗,作为我国首个自主研发的抗体药物偶联物(ADC),由全新HER-2单克隆抗体、组织蛋白酶可裂解连接子和MMAE组成,兼具ADC的经典效应和旁路杀伤效应,展现出高亲和力、强效杀伤力和良好的安全性[1]。在关键性研究C008[2]中,维迪西妥单抗治疗≥2线标准治疗失败的HER-2 IHC 3+及HER-2 IHC 2+晚期胃癌患者,客观缓解了(ORR)达24.8%,mPFS为4.1个月,mOS明显延长,达7.9个月。安全性与耐受性良好,≥3级治疗相关不良事件发生率低。基于C008研究的优异结果,2021年6月,维迪西妥单抗在我国获批用于至少接受过2种系统化疗的HER-2过表达局部晚期或转移性胃癌患者。HER-2阳性(IHC3+或2+)晚期胃癌三线及以上治疗,《2023CSCO胃癌诊疗指南》I级推荐维迪西妥单抗[3]。
此外,C013研究作为首个针对HER2表达晚期胃癌患者采用靶向HER2-ADC与PD-1单抗联合治疗的研究,其初步数据令人鼓舞。该研究为维迪西妥单抗联合PD-1单抗二线及以上治疗HER2表达晚期胃癌提供了重要循证医学证据。在24例接受维迪西妥单抗联合PD-1单抗治疗的胃/胃食管结合部癌(GC/GEJC)患者中,ORR 50%,mPFS 6.2个月,mOS 16.8个月。特别值得一提的是,HER2阳性患者的ORR高达56%,且其mPFS延长至7.8个月[4]。在本病例中,维迪西妥单抗联合PD-1单抗方案显著有效,这与临床研究中的获益趋势相吻合。经治疗,患者肝部病灶完全消失、中腹部肠系膜转移灶消失,实现了cCR,且PFS已超过12个月。它表明,即使是在疾病晚期,对于特定类型的胃癌患者,如HER2阳性患者,通过精准的治疗方案仍有可能实现显著的治疗突破。
总体来看,本病例的治疗历程凸显了多学科综合治疗策略的重要性,涵盖了手术、化疗、靶向治疗和免疫治疗等多种治疗手段,为患者带来了显著的临床益处。此外,临床医生需严密监测患者的治疗反应和副作用,及时调整治疗策略,以应对疾病的进展或复发,并确保患者获得最佳的治疗效果。
[1] 中国抗癌协会肿瘤药物临床研究专业委员会, 国家抗肿瘤药物临床应用监测专家委员会, 国家肿瘤质控中心乳腺癌专家委员会, 等. 抗体药物偶联物治疗恶性肿瘤临床应用中国专家共识(2023版)[J]. 中华肿瘤杂志, 2023, 45(9):741-762.
[2] Peng Z, Liu T, Wei J, et al. Efficacy and safety of a novel anti-HER-2 therapeutic antibody RC48 in patients with HER-2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond). 2021;41(11):1173-1182.
[3] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)胃癌诊疗指南[M]. 北京:人民卫生出版社,2023.
[4] Wang Y, et al. Disitamab vedotin (RC48) plus toripalimab for HER2-expressing advanced gastric or gastroesophageal junction and other solid tumours: a multicentre, open label, dose escalation and expansion phase 1 trial. EClinicalMedicine. 2024 Jan 5;68:102415.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


