日前,2024年美国癌症研究协会(AACR)年会已在美国加州圣地亚哥圆满落幕。本次会议上,在实体瘤尤其是肺癌治疗领域有多项关于抗体偶联药物(ADC)的创新临床研究结果公布。HER2(ERBB2)ADC德曲妥珠单抗(DS-8201,T-DXd)再次获得耀眼佳绩,首次公布了中国人群DESTINY-Lung05临床研究结果。此次【肿瘤资讯】特邀复旦大学附属肿瘤医院王佳蕾教授解读DESTINY-Lung系列研究已取得的结果及其临床意义。
专家简介
复旦大学胸部肿瘤研究所副所长
中国抗癌协会临床化疗专委会青委会副主任委员
上海市女医师协会肺癌专业委员会主任委员
中国临床肿瘤学会(CSCO)非小细胞肺癌专委会、血管靶向专委会、老年肿瘤防治专委会委员
中国医疗保健促进会肿瘤内科分会、胸部肿瘤分会常委
中国医药教育协会肺部肿瘤专业委员会常委
泛长三角胸部肿瘤联盟专业委员会副主席
中国肺癌防治联盟肺癌免疫治疗委员会常委
上海市抗癌协会脑转移瘤专委会、癌症康复与姑息治疗专委会(CRPC)、肿瘤药物临床研究专委会、转化医学专委会常委
上海市抗癌协会肺癌专委会常委
内科学组组长
美国M.D. Anderson肿瘤中心访问学者
成果丰硕,DESTINY-Lung系列临床研究结果回顾与盘点
锋芒毕露,DESTINY-Lung01研究刊登NEJM
DESTINY-Lung01是一项开放标签、多中心、双队列、II期临床研究,旨在评估德曲妥珠单抗(DS-8201,T-DXd)用于HER2(ERBB2)过表达(队列1)和HER2(ERBB2)突变(队列2)转移性非小细胞肺癌(NSCLC)患者的疗效和安全性,初步研究结果于2022年刊登在新英格兰医学杂志(NEJM)[1]。中位随访13个月时,德曲妥珠单抗(DS-8201,T-DXd)(6.4mg/kg)用于治疗经治HER2(ERBB2)突变NSCLC患者的客观缓解率(ORR)为55%,中位缓解持续时间(DOR)为9.3个月,中位无进展生存期(PFS)和中位总生存期(OS)分别为8.2个月和17.8个月(图1)。
 图1 DESTINY-Lung01研究2022年刊登NEJM
图1 DESTINY-Lung01研究2022年刊登NEJM
2022 年ESMO大会上DESTINY-Lung01研究更新结果显示[2],在HER2(ERBB2)突变NSCLC人群中6.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)的ORR和疾病控制率(DCR)分别为54.9%和92.5%,中位PFS和中位OS分别为8.2个月和18.6个月。另外更新结果显示,基线时存在/不存在无症状中枢神经系统(CNS)转移患者的ORR分别为54.5%和55.2%(表1),中位PFS分别为7.1个月和9.7个月,中位OS分别为14个月和27个月;既往接受≤2线/>2线治疗患者的ORR分别为55.7%和53.3%,中位PFS分别为8.3个月和6.8个月,中位OS分别为22.1个月和13.8个月。更新数据支持德曲妥珠单抗(DS-8201,T-DXd)可作为经治HER2(ERBB2)突变晚期NSCLC患者的标准治疗方案,且关键亚组分析提示不论分层因素如何,德曲妥珠单抗(DS-8201,T-DXd)均可带来更优的疗效和获益。
表1 DESTINY-Lung01研究更新结果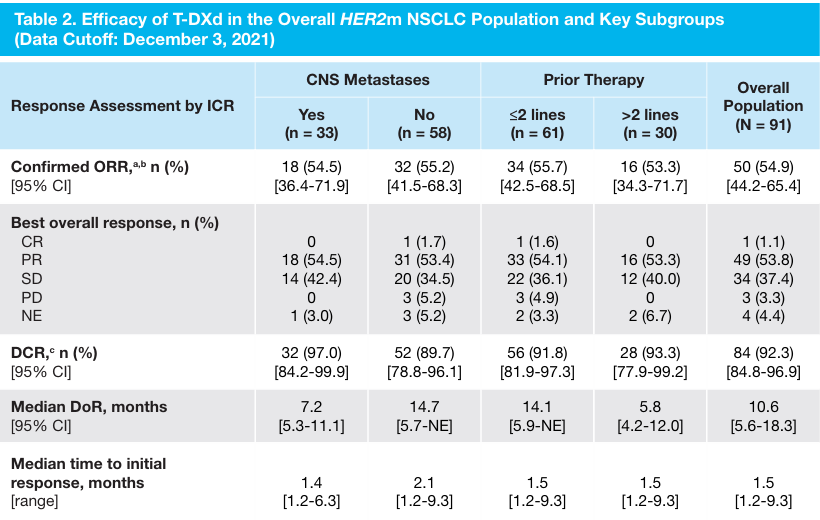
DESTINY-Lung02研究为德曲妥珠单抗(DS-8201,T-DXd)全球上市提供关键依据
2022年8月,FDA加速批准德曲妥珠单抗(DS-8201,T-DXd)用于经治HER2(ERBB2)突变转移性NSCLC患者,因此德曲妥珠单抗(DS-8201,T-DXd)成为肺癌领域目前首个且唯一获批的HER2(ERBB2)ADC药物。此次获批主要基于DESTINY-Lung02研究。这是一项多中心、随机双盲、剂量优化、非对照研究,旨在评估两种剂量德曲妥珠单抗(DS-8201,T-DXd)(5.4mg/kg和6.4mg/kg)用于经治HER2(ERBB2)突变不可切除或转移性NSCLC患者的疗效。2022 年ESMO大会上DESTINY-Lung02研究中期分析结果显示[3],在预先指定的早期队列中,5.4mg/kg、6.4mg/kg组的中位随访时间分别为5.6个月和5.4个月,德曲妥珠单抗(DS-8201,T-DXd)治疗组的ORR分别为53.8%和42.9%,DCR分别为90.4%和92.9%(表2)。安全性结果显示,5.4mg/kg安全性更优,大部分与剂量调整相关的药物相关间质性肺病(ILD)为1-2级不良事件。研究结果证实,5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)具有更优的安全性,且在HER2(ERBB2)突变晚期NSCLC患者二线及以上治疗中显示出有临床意义的缓解,并展现了与6.4mg/kg剂量相当的卓越疗效。该结果进一步为FDA批准的5.4mg/kg使用剂量提供了循证依据。
表2 DESTINY-Lung02研究中期分析结果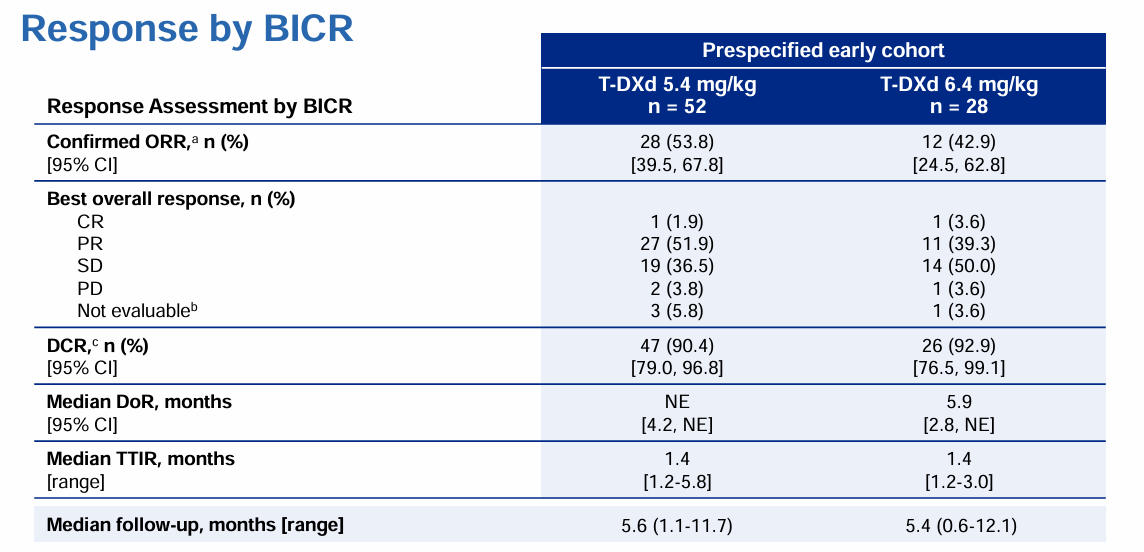
2023年 WCLC大会上,DESTINY-Lung02研究再次以口头汇报形式更新结果[4]。此次分析时5.4mg/kg和6.4mg/kg组的中位随访时间分别为11.5个月和11.8个月,德曲妥珠单抗(DS-8201,T-DXd)的ORR分别为49%和56%,DCR分别高达93.1%和92%(表3),中位PFS分别为9.9个月和15.4个月,1年PFS率分别为45%和53%,中位OS分别为19.5个月和未达到,1年OS率分别为67%和73%。安全性结果显示出与既往研究的一致性,5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)安全性更优。5.4mg/kg和6.4 mg/kg剂量组≥3级治疗期间不良事件(TEAE)的发生率分别为38.6%和58.0%,两组中最常见的≥3级TEAE主要为血液学毒性,包括中性粒细胞减少症(18.8%和36.0%)和贫血(10.9%和16%)。此次会议上DESTINY-Lung02再次更新了令人鼓舞的研究结果,并同步发表于临床肿瘤学杂志(JCO),再次共同证实德曲妥珠单抗(DS-8201,T-DXd)的优效性、应答的持久性,且显示出优异的PFS和OS结果。
表3 DESTINY-Lung02研究更新结果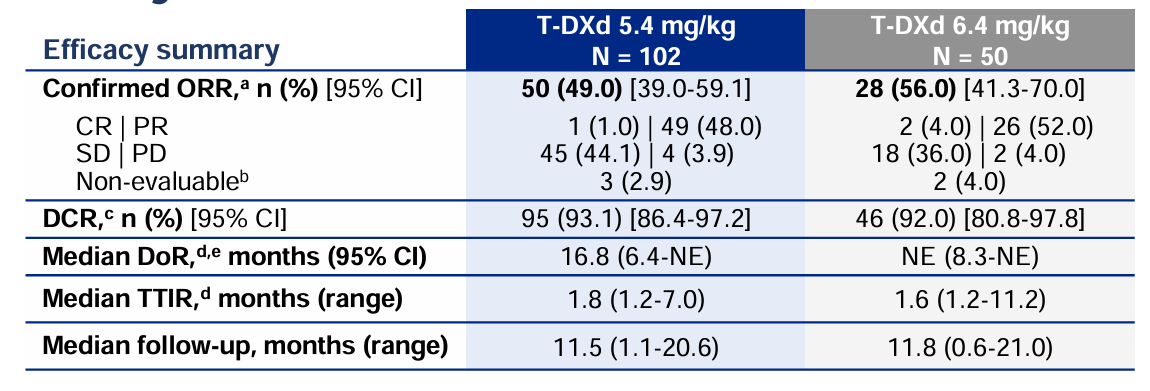
5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)展现更优颅内疗效
另外德曲妥珠单抗(DS-8201,T-DXd)在伴脑转移HER2(ERBB2)突变转移性NSCLC患者中显示出的良好颅内疗效,值得关注。2023年ESMO大会上,DESTINY-Lung01和DESTINY-Lung02汇总分析结果显示[5],5.4mg/kg和6.4mg/kg组患者确认的颅内ORR(IC-cORR)分别为50%和30%,颅内疾病控制率(IC-DCR)分别为92.9%和73.3%,中位颅内缓解持续时间(IC-DOR)分别为9.5个月和4.4个月(表4)。总体而言,两剂量组德曲妥珠单抗(DS-8201,T-DXd)在伴脑转移HER2(ERBB2)突变转移性NSCLC患者中均具有良好的颅内活性,而5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)的颅内疗效更优。
表4 汇总分析颅内疗效分析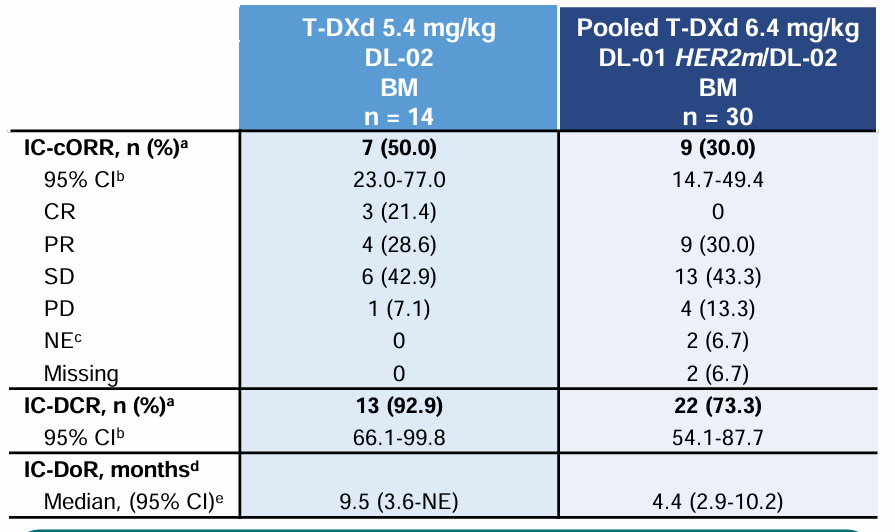
德曲妥珠单抗(DS-8201,T-DXd)在亚裔人群中临床研究证据丰富,有望成为HER2(ERBB2)突变晚期NSCLC亚裔人群的新选择
DESTINY-Lung02研究亚洲人群与全球人群疗效一致
2023年ESMO ASIA大会上,DESTINY-Lung02研究公布亚洲亚组数据[6],截止2022年12月23日数据分析时,5.4mg/kg和6.4 mg/kg组患者接受德曲妥珠单抗(DS-8201,T-DXd),经确认的ORR分别为50.8%和73.3%,中位DOR分别为16.8个月和未达到,中位PFS分别为10.8个月和15.4个月,12个月PFS率分别为45.5%和57.8%,中位OS分别为19.5个月和未达到,12个月OS率分别为71.3%和76.3%(表5)。安全性方面,与6.4mg/kg组相比,5.4mg/kg组导致停用、剂量减少和治疗中断药物相关TEAEs的发生率更低。总体而言,亚洲患者的疗效及安全性结果与总人群一致。结果提示,5.4mg/kg、6.4 mg/kg德曲妥珠单抗(DS-8201,T-DXd)在亚洲患者中同样显示出强效的缓解和临床可管理的安全性,且结果支持5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)用于经治HER2(ERBB2)突变晚期NSCLC患者的优效性。
表5 DESTINY-Lung02亚洲亚组疗效分析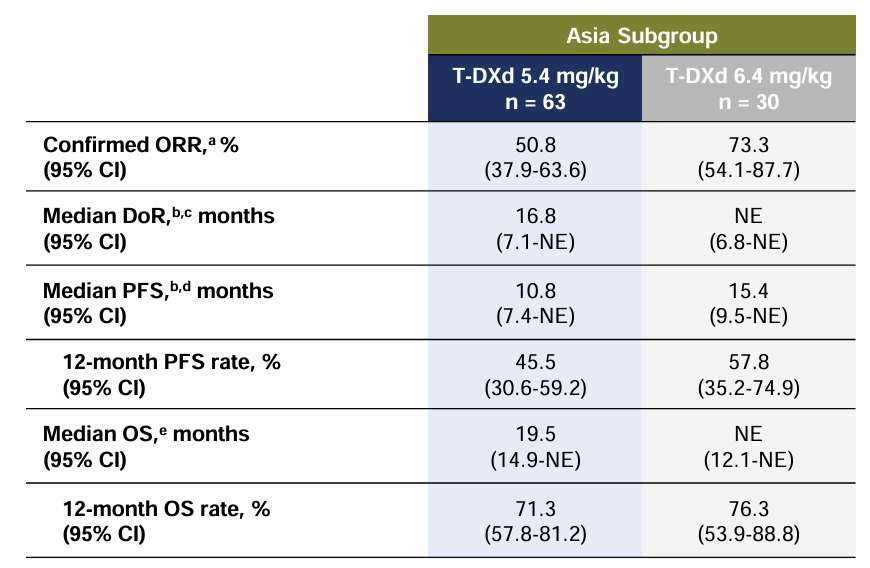
闪耀AACR,DESTINY-Lung05研究公布中国人群亮眼数据
DESTINY-Lung01、DESTINY-Lung02研究结果的发布和多次更新以及DESTINY-Lung02研究亚洲亚组的结果共同验证并重现了德曲妥珠单抗(DS-8201,T-DXd)在HER2(ERBB2)突变二线及后线转移性NSCLC患者中的卓越疗效,并通过优化剂量设计证实5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)具有更优的安全性和相当的疗效。今年AACR大会上DESTINY-Lung05研究首次重磅公布结果[7]。该研究由程颖教授牵头,30多家中心参与,是一项开放标签、单臂、II期临床研究,旨在评估德曲妥珠单抗(DS-8201,T-DXd)用于至少一线治疗期间或治疗进展后HER2(ERBB2)突变转移性NSCLC中国患者的疗效和安全性。研究结果显示,中位随访9.8个月,72例HER2(ERBB2)突突转移性NSCLC患者接受5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)治疗(全分析人群)。分别有58.3%和41.7%的患者既往接受过2线及以上和1线治疗。分别有93.1%、90.3%、68.1%、68.1%的患者既往接受过细胞毒化疗、含铂化疗、免疫治疗、抗血管生成药物。疗效结果显示,中位随访9.8个月,由ICR评估确认的ORR为58.3%,其中1.4%的患者达到完全缓解,56.9%的患者达到部分缓解,中位DOR未达到,DCR为91.7%,中位PFS未达到,12个月PFS率为55.1%(表6,图2)。由研究者评估确认的ORR为58.3%,中位DOR为9个月,DCR为93.1%,中位PFS为10.8个月,12个月PFS率为39.7%。安全性特征与德曲妥珠单抗(DS-8201,T-DXd)已知安全性类似。总体而言,5.4mg/kg德曲妥珠单抗(DS-8201,T-DXd)在HER2(ERBB2)突突转移性NSCLC中国人群中显示出有临床意义和持久的缓解,以及良好的安全性。研究结果支持在中国人群中使用德曲妥珠单抗(DS-8201,T-DXd)5.4mg/kg。
表6 DESTINY-Lung05研究疗效分析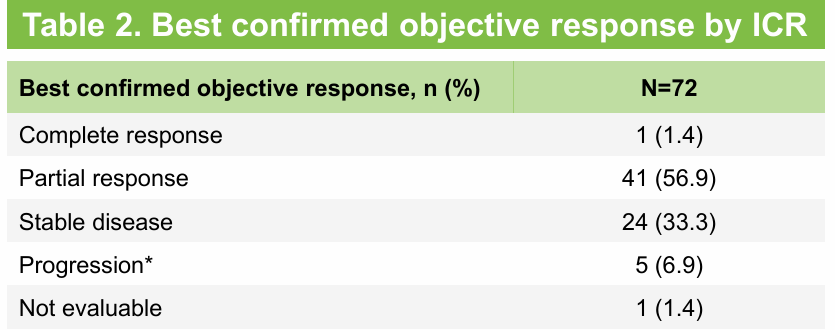
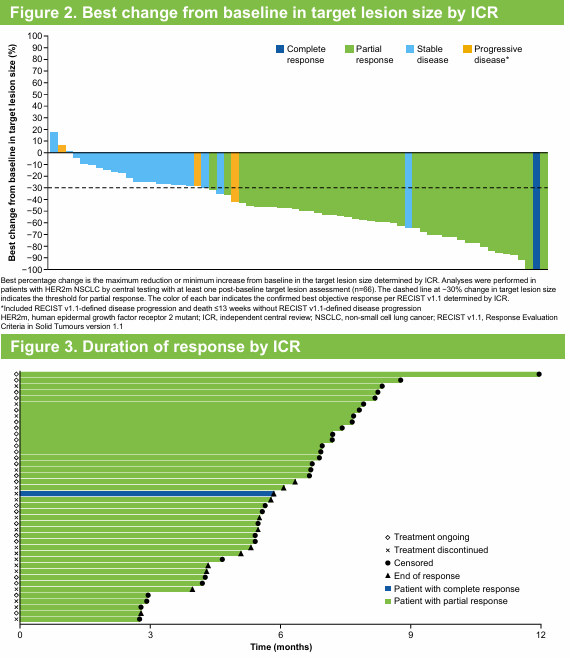 图2 ICR评估的靶病灶最佳缓解和DOR
图2 ICR评估的靶病灶最佳缓解和DOR
总而言之,DESTINY-Lung02全球人群、DESTINY-Lung02亚洲亚组、DESTINY-Lung05中国人群研究数据的陆续公布,共同证实了德曲妥珠单抗(DS-8201,T-DXd)在HER2(ERBB2)突变转移性NSCLC患者中的优越疗效和安全性。我们更关注的是,德曲妥珠单抗(DS-8201,T-DXd)同样在亚洲患者、中国人群中展现卓越疗效和良好安全性。目前德曲妥珠单抗(DS-8201,T-DXd)单药治疗经治HER2(ERBB2)突变晚期NSCLC患者的适应症已被CDE纳入优先评审。基于已公布的多项研究数据,HER2(ERBB2)突变转移性NSCLC患者中国人群有望迎来新的适应症和新的治疗选择,期待德曲妥珠单抗(DS-8201,T-DXd)造福中国晚期肺癌患者。
总结与展望
目前为止,DESTINY-Lung系列研究取得了丰硕的研究结果,德曲妥珠单抗(DS-8201,T-DXd)在经治HER2(ERBB2)突变转移性NSCLC患者包括关键亚组人群、亚洲人群和中国患者中均显示出卓越的疗效和良好的安全性。德曲妥珠单抗(DS-8201,T-DXd)凭借疗效和安全性双重优势,获得FDA的加速批准并被CDE纳入优先评审,这是HER2(ERBB2)突变肺癌治疗领域的突破性进展,期待德曲妥珠单抗(DS-8201,T-DXd)获得NMPA批准正式上市。
但需要指出的是,目前DESTINY-Lung系列研究为II期临床研究。更令人期待的是,大型III期DESTINY-Lung04临床研究目前正在开展中,该研究旨在评估一线德曲妥珠单抗(DS-8201,T-DXd)对比标准治疗(帕博利珠单抗联合培美曲塞/铂类)在经治HER2(ERBB2)突变的不可切除、局部晚期或转移性非鳞状NSCLC患者中的疗效和安全性。另外,在HER2(ERBB2)过表达领域,德曲妥珠单抗(DS-8201,T-DXd)已开展了初步探索,并显示出初步良好疗效。在一线治疗领域,例如Ib期DESTINY-Lung03研究将进一步探索一线德曲妥珠单抗(DS-8201,T-DXd)+免疫治疗±化疗治疗转移性HER2(ERBB2)过表达非鳞状NSCLC患者的疗效。总体而言,德曲妥珠单抗(DS-8201,T-DXd)在肺癌各个治疗领域的临床研究非常值得期待,同时期待其在中国人群中开展更多的临床研究。
[1]Li BT, Smit EF, Goto Y, et al. DESTINY-Lung01 Trial Investigators. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2022 Jan 20;386(3):241-251. doi: 10.1056/NEJMoa2112431. Epub 2021 Sep 18. PMID: 34534430; PMCID: PMC9066448.
[2]Bob T Li,et al. Trastuzumab Deruxtecan in Patients With HER2 Mutant Metastatic Non–Small-Cell Lung Cancer: Interim Results From the Phase 2 DESTINY-Lung02 Trial ESMO 2022. Abstract : 976P
[3]LBA55-Trastuzumab deruxtecan (T-DXd) in patients (Pts) with HER2-mutant metastatic non-small cell lung cancer (NSCLC): Interim results from the phase 2 DESTINY-Lung02 trial. 2022 ESMO.
[4]MA13.10-Trastuzumab Deruxtecan in Patients with HER2-Mutant Metastatic Non-Small Cell Lung Cancer: Primary Results of DESTINY-Lung02.2023 WCLC.
[5] Li BT, et al. Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2(ERBB2)-mutant (HER2m) metastatic non small cell lung cancer (NSCLC) with and without brain metastases (BMs):Pooled analyses from DESTINY-Lung01 and DESTINY Lung02. 2023 ESMO 1321MO.
[6] Trastuzumab deruxtecan (T-DXd) in Asian patients (Pts) with human epidermal growth factor receptor 2 (HER2; ERBB2)-mutant (HER2m) metastatic non-small cell lung cancer (mNSCLC): Subgroup analysis of DESTINY–Lung02(DL-02). 2023 ESMO Asia 510MO.
[7]Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2 mutant non-small cell lung cancer (NSCLC): primary analysis from the Phase 2 DESTINY-Lung05 (DL-05) trial. Abstract CT248/7,2024 AACR.
排版编辑:肿瘤资讯-Rex











 苏公网安备32059002004080号
苏公网安备32059002004080号


