胃癌是我国常见的恶性肿瘤,每年新发病例约占全球的40%,而且我国约80%的胃癌患者在发现时已处于进展期,总体5年生存率不足50%[1]。对于可切除或潜在可切除的局部进展期胃癌,围手术期综合治疗可使肿瘤降期、提高R0切除率和改善整体生存[1,2]。近年来,随着胃癌精准治疗时代的到来,靶向和免疫治疗在胃癌围手术期治疗中的应用成为研究热点。重庆大学附属肿瘤医院闫孟华医师分享1例人类表皮生长因子受体2(HER-2)低表达不可切除局部进展期胃癌病例:患者男性,68岁,胃底低分化腺癌,III期。采用抗HER-2抗体偶联药物(ADC)联合PD-1单抗及口服化疗药物转化治疗3个周期,肿瘤明显缩小,行腹腔镜探查+根治性全胃切除术,术后病理提示达到病理完全缓解(pCR)。目前无事件生存期(EFS)已经超过6个月。【肿瘤资讯】将病例诊疗过程整理如下,并邀请重庆大学附属肿瘤医院孙浩教授做病例点评。
病例介绍
专家介绍
重庆大学附属肿瘤医院,胃肠肿瘤中心
重庆市解剖学会理事
重庆市医学会微创外科专业委员会胃肠外科学组委员
重庆市中西医结合协会胃肠外科专业委员
以第一作者和共同作者发表中文及SCI数篇
参与国家自然科学基金课题2项
省部级课题1项
基本情况
患者,男性,68岁。
主诉:因“进食后哽咽15天 ”于2023年5月入院。
现病史:进食后哽咽感,逐渐加重,伴剑突下隐痛不适。
既往史:7年前胃溃疡病史、吸烟史40年。
家族史:无特殊。
腹部查体:无特殊。
本次诊疗经过
2023年5月17日 CT示:胃壁可疑增厚,肝胃间隙占位(图1)。
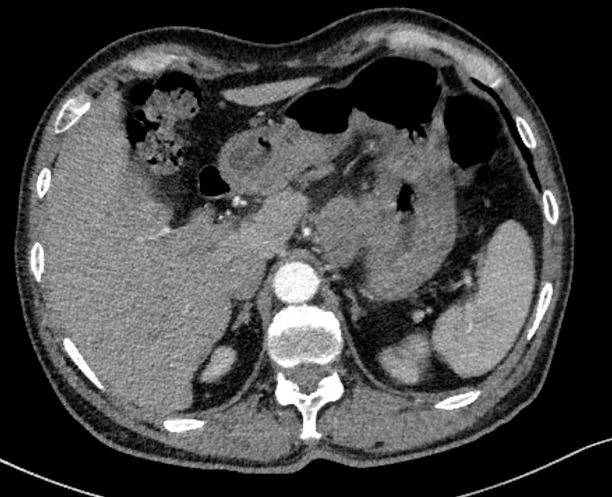 图1 2023年5月CT
图1 2023年5月CT
2023年5月19日 胃镜示:胃底见一不规则隆起,大小约3.0cm×5.0cm,表面有明显的溃疡形成,底部附着污浊苔,溃疡边缘呈坡状隆起及结节状,溃疡边缘和底部向深层及周围浸润性生长,界限欠清,隆起中央质韧,周边质脆,触之易出血,予以活检;黏液湖呈黑色粘稠液(图2)。
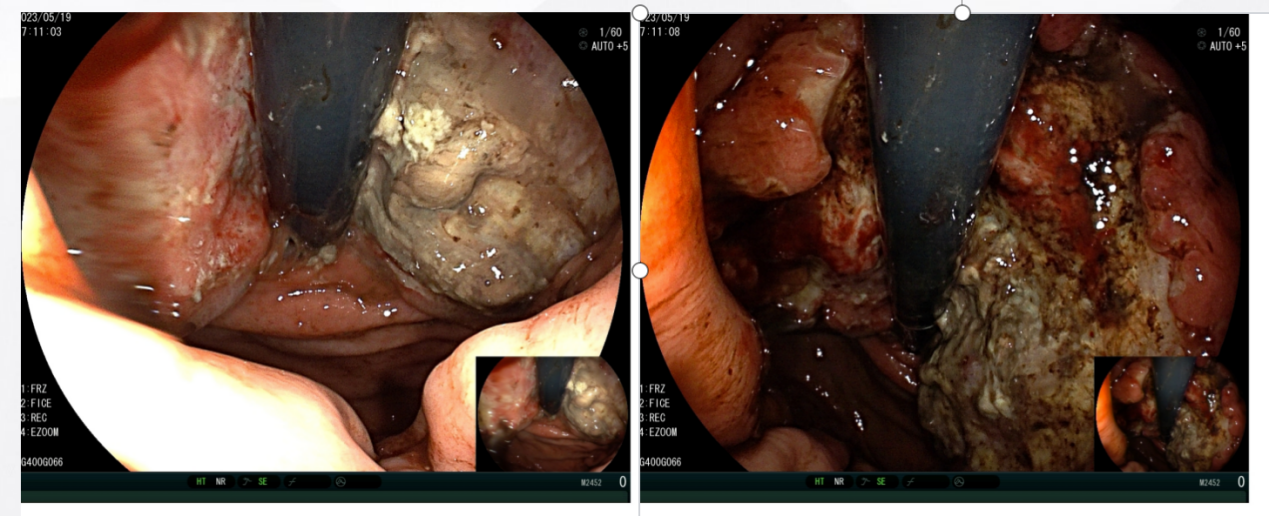 图2 2023年5月胃镜
图2 2023年5月胃镜
2023年5月19日 PET/CT示:胃贲门及胃体小弯壁增厚伴代谢增高,考虑恶性肿瘤可能大,请结合病理。肝胃间隙淋巴结转移(图3)。
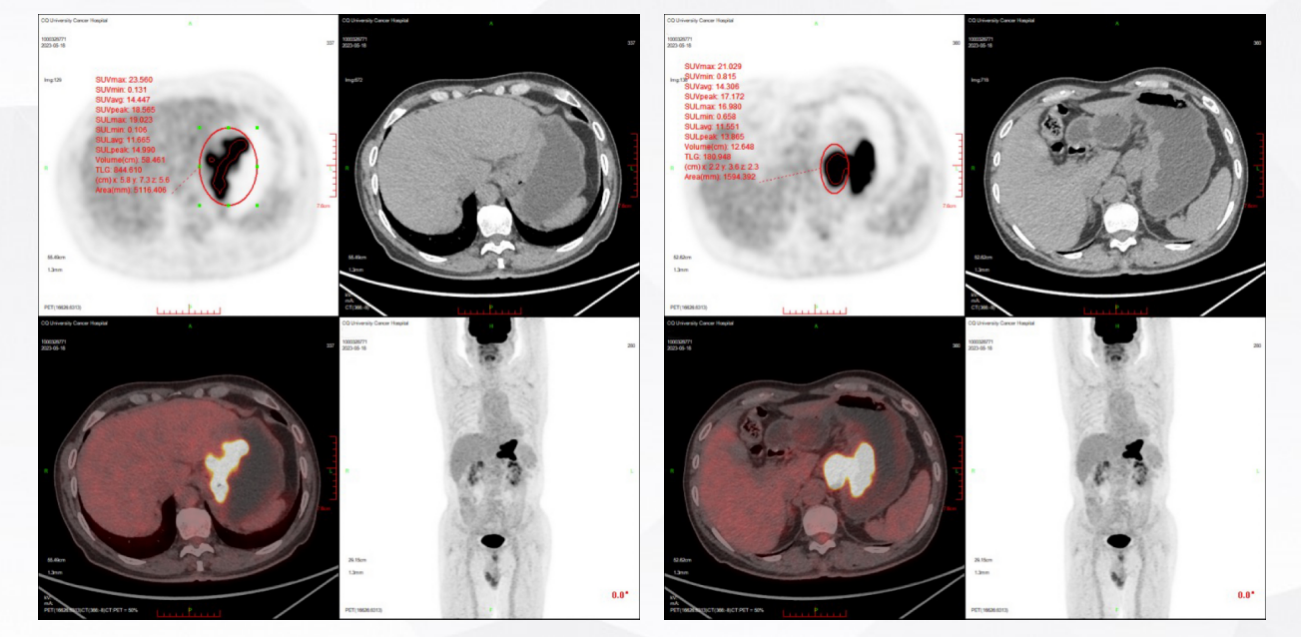 图3 2023年5月PET/CT
图3 2023年5月PET/CT
病理检测结果:(胃底)低粘附性癌,弥漫型。免疫组化结果:CDX2(+),CK-pan(+),HER-2(1+),P53(约90%强+,考虑突变型),Ki-67(约90%+),MSH2(+),MSH6(+),PMS2(+),MLH1(+),Villin(+),CK-L(35βH11)(+)。
基因检测:ERBB2基因:p.G776V第20外显子错义突变,c.2327G>T (p.G776V) 频率16.75%;TP53基因:p.E285V第8外显子错义突变 c.854A>T (p.E285V) 频率31.21% 。
临床诊断:胃底恶性肿瘤,低分化腺癌,cT4N+M0,III期,HER-2(1+),ERBB2突变,MSS。
MDT讨论认为,患者的治疗目标为缩小肿瘤,实现R0切除,并消除微转移灶,控制不良反应,延长生存。考虑到患者HER-2(1+),新型ADC药物可以给HER-2(1+)患者带来获益,联合免疫治疗可以进一步提高疗效,选择口服化疗药物+ADC药物+PD-1单抗方案转化治疗。
2023年5月25日、6月15日、7月11日给予维迪西妥单抗+信迪利单抗+替吉奥治疗3个周期。
2023年8月2日转化治疗3周期后复查CT示:与2023-05-17旧片比较:1.前片胃底壁不均匀稍增厚,此次显示不清,请结合临床、随诊;2.肝胃间隙软组织结节,考虑转移可能,较前缩小;3.肝内多发囊性结构,较前相仿。双肾囊肿,较前相仿;4.腹腔内、腹膜后多发淋巴结显示,较前相仿;5.右肺中叶内侧段、左肺上叶舌段少许慢性炎症,较前相仿(图4)。
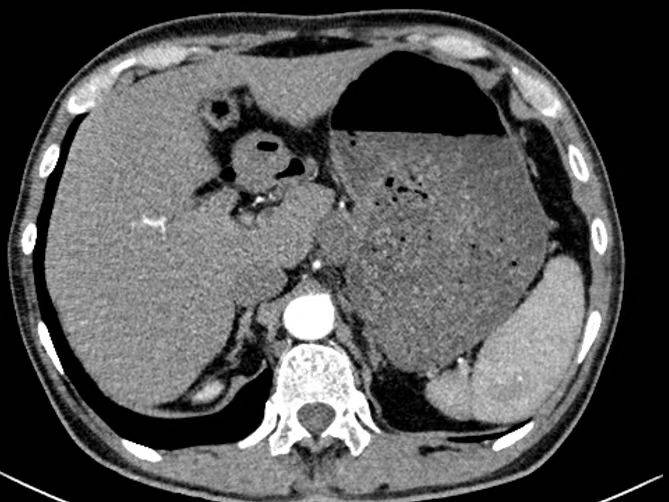 图4 2023年8月CT
图4 2023年8月CT
2023年8月 复查肿瘤标志物示:CA199、CEA、CA125均下降(图5)。
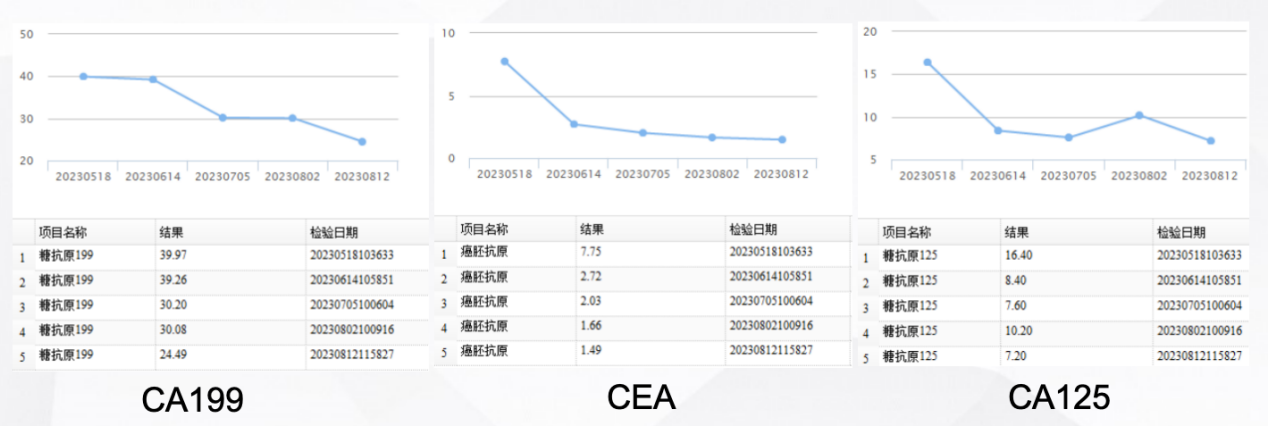 图5 2023年5月至8月肿瘤标志物变化
图5 2023年5月至8月肿瘤标志物变化
治疗副反应:I度骨髓抑制;肢体麻木;轻度消化道反应。
2023年8月17日 行腹腔镜探查+根治性全胃切除术,腹腔镜探查示:腹盆腔无明显积液;横结肠系膜与胃后壁粘连,肿瘤位于贲门小弯侧,浆膜未见明显受侵,胃左动脉及幽门附近可见明显肿大淋巴结,大者直径约2.5cm(图6)。术中诊断为:贲门胃底腺癌(sT3N+M0)。
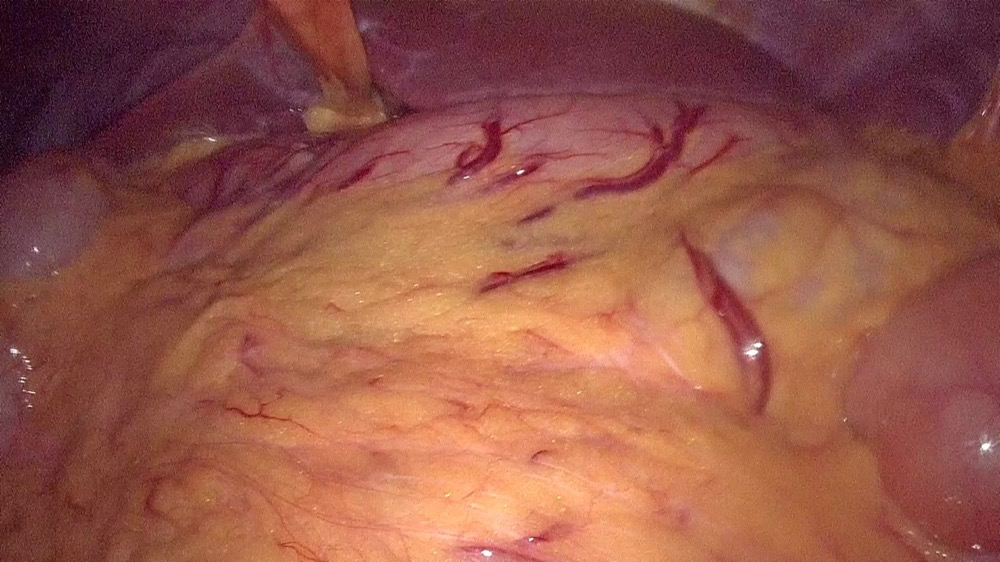 图6 2023年8月腹腔镜探查
图6 2023年8月腹腔镜探查
术后病理示:(全胃及肿瘤)“胃癌化疗后”,胃粘膜病变区经广泛取材,镜下见胃粘膜间质纤维增生伴淋巴细胞、浆细胞浸润,可见出血,局灶见细胞外粘液及少量漂浮细胞簇,细胞轻度不典型,未见确切肿瘤细胞残留,肿瘤退缩分级TRG:0级(注:参考2014AJCC/CAP评级标准);紧邻病变于浆膜侧见一坏死结节,周围脂肪内查见淋巴结18枚未见确切癌转移,其中3枚淋巴结见坏死及巨细胞反应,结合病史,考虑治疗后改变。
疗效评价:pCR。
2023年9月11日 复查CT示:1.胃切除术后,食管-小肠、小肠-小肠吻合口稍增厚,伴周围少许渗出,左上腹肠管走形紊乱,部分小肠扩张积气;2.肝内多发囊性结构,较前相仿。双肾囊肿,较前相仿;3.脾脏内条状影,脾梗死?随诊;4.腹腔内、腹膜后多发淋巴结显示,较前相仿;5.腹盆腔少许积液、渗出;6.前列腺增生、钙化,增强扫描强化不均匀;7.右侧髋臼旁低密度,退行性改变可能,左侧髂骨骨岛可能,随诊;8.右肺中叶内侧段、双肺下叶基底段少许慢性炎症,较前相仿(图7)。
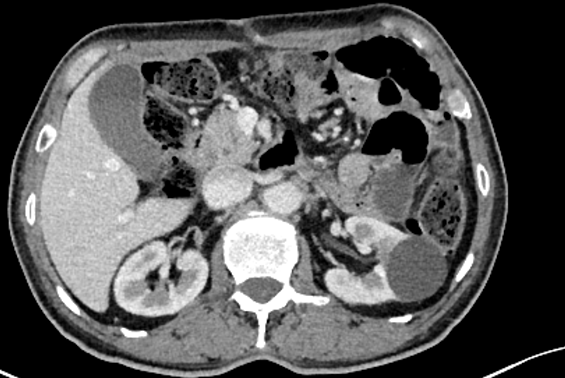 图7 2023年9月CT
图7 2023年9月CT
2023年11月1日 复查CT示:与2023-09-11旧片比较:1.胃切除术后,食管-小肠、小肠-小肠吻合口稍增厚,伴周围少许渗出,较前减少;左上腹肠管走形紊乱,部分小肠扩张积气,较前变化不大;2.肝内多发囊性结构,较前相仿。双肾囊肿,较前相仿;3.脾脏内条状影,脾梗死?较前减小,随诊;4.腹腔内、腹膜后多发淋巴结显示,较前变化不大;5.腹盆腔少许积液、渗出,较前减少;6.前列腺增生、钙化,增强扫描强化不均匀,较前变化不大,请结合临床及MR检查;7.右侧髋臼旁低密度,退行性改变可能;左侧髂骨骨岛可能,随诊。均较前变化不大;8.右肺中叶内侧段、双肺下叶基底段少许慢性炎症,双肺下叶较前减少,余变化不大(图8)。
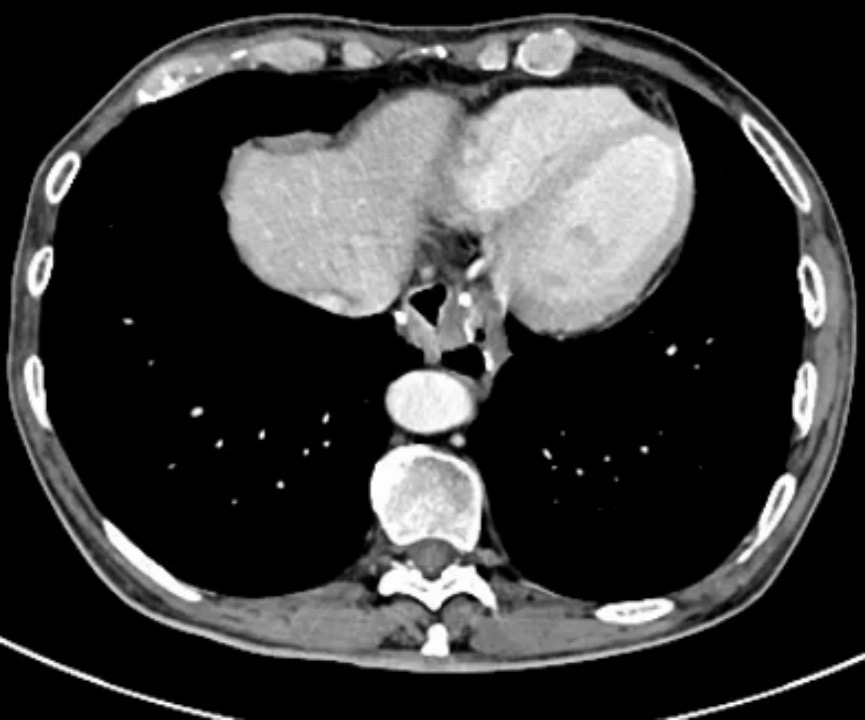 图8 2023年11月CT
图8 2023年11月CT
病例总结
该患者为老年男性,不可切除局部进展期胃底低分化腺癌,HER-2低表达。采用维迪西妥单抗+信迪利单抗+替吉奥治疗3个周期,成功使肿瘤缩小,转化为可切除,行腹腔镜探查+全胃切除术,术后病理提示pCR。转化治疗过程中出现的不良反应较轻,可控制。目前患者EFS已经超过6个月。
病例点评
专家介绍
重庆大学附属肿瘤医院胃肠肿瘤中心科室主任
九三学社重庆市第五届委员会医药卫生专门委员会副主任
中国医师协会结直肠肿瘤专业委员会委员
中国医师协会结直肠肿瘤专业委员会ERAS学组常务委员
中国医师协会结直肠肿瘤专业委员会腹腔镜学组委员
中国抗癌协会第一届腹膜肿瘤专业委员会常务委员
中国抗癌协会第一届肿瘤微环境专业委员会委员
中国医师协会NOSES联盟重庆分会常务理事
重庆市胃肠肿瘤联盟理事
重庆市中西医结合学会姑息治疗专委会副主任委员
重庆市健康促进与健康教育学会第一届普外科专委会副主任委员
中国抗癌协会重庆市分会GIST专委会常务委员
全国卫生产业企业管理协会疝和腹壁外科产业及临床研究分会第六学术委员会常务委员
对于初始不可切除局部进展期胃癌,可考虑化疗或同步放化疗,争取肿瘤缩小后转化为可切除,单纯化疗参考新辅助化疗方案[1]。然而,根据中国胃肠肿瘤外科联盟2020年度数据报告,局部进展期胃癌患者接受新辅助化疗或放化疗后pCR率仅为11.4%[3],亟需寻找更加高效的新辅助和转化治疗方案。HER-2是胃癌靶向治疗的经典靶点,2010年,ToGA研究[4]证实抗HER-2靶向药物曲妥珠单抗可显著改善HER-2过表达晚期胃癌患者的预后,但是进一步分析发现,获益仅限于IHC 2+ FISH+或IHC 3+患者,HER-2低表达患者不能从曲妥珠单抗治疗中获益。
近年来,靶向HER-2的ADC药物在胃癌领域开始崭露头角。我国自主研发的抗HER-2 ADC药物关键研究C008[5]纳入了125例≥2线标准治疗失败的HER2 IHC 3+及HER2 IHC 2+晚期胃癌患者,HER2 IHC 2+患者无需检测HER2基因扩增状态,即研究中纳入了部分IHC 2+/FISH-的患者。研究结果显示,抗HER2 ADC药物治疗的客观缓解率(ORR)达到24.8%,中位PFS为4.1个月,中位总生存期(OS)达到7.9个月。进一步分析发现,抗HER2 ADC药物在HER2低表达患者中的疗效与其他亚组一致。最常见不良事件为血液学毒性和乏力,对症支持治疗后可获得缓解。
此外,研究发现,ADC药物可以提高胃癌组织中T淋巴细胞浸润程度,增强抗肿瘤免疫反应,进而提高PD-1单抗的治疗效果[6]。本例患者为不可切除HER2低表达局部进展期胃底腺癌,采用ADC药物联合PD-1单抗转化治疗成功,术后病理达到pCR。目前探索ADC药物联合PD-1单抗一线治疗HER-2表达晚期胃癌或胃食管交界处癌的研究正在进行中,期待研究取得阳性结果,并进一步将联合治疗探索推进到围手术期阶段,最终造福更多患者。
[1] 中华人民共和国国家卫生健康委员会医政医管局. 胃癌诊疗指南(2022年版).中华消化外科杂志, 2022, 21(9):1137-1164.
[2] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)胃癌诊疗指南[M]. 北京:人民卫生出版社,2023.
[3] 赵林勇, 胡建昆. 胃癌新辅助治疗的现状和挑战[J]. 中华消化外科杂志, 2021, 20(9): 933-937.
[4] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER-2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-97.
[5] Peng Z, Liu T, Wei J, et al. Efficacy and safety of a novel anti-HER-2 therapeutic antibody RC48 in patients with HER-2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond). 2021;41(11):1173-1182.
[6] 康殷楠,陈顺,解有成,等. 抗体药物偶联物在HER2阳性晚期胃癌中的应用进展和展望[J]. 中国癌症杂志, 2023, 33 (8): 790-800.
排版编辑:Riddy











 苏公网安备32059002004080号
苏公网安备32059002004080号


