近年来,抗体偶联药物(ADC)取得了飞速发展,一路高歌猛进,掀起了肺癌领域抗肿瘤精准治疗的新浪潮。目前多项TROP2 ADC药物临床研究正在开展中,2023 ESMO大会上,III期TROPION-Lung01研究公布其达到主要终点:Dato-DXd对比多西他赛用于经治NSCLC患者显示出有统计学意义的PFS获益。近期III期EVOKE-01研究宣布未达到主要终点,戈沙妥珠单抗对比多西他赛用于经治NSCLC患者未显示出有统计学意义的OS改善。不同TROP2 ADC药物目前取得了不同的临床研究结果,其疗效和安全性与药物结构设计息息相关,为进一步了解不同药物的结构特点和差异,【肿瘤资讯】特邀上海交通大学附属胸科医院李子明教授详细介绍不同TROP2 ADC结构特点以及结构设计对药物理化性质的影响。
上海交通大学附属胸科医院
上海市胸科医院肺部肿瘤临床医学中心副主任
中华医学会肿瘤学分会青年委员会委员
中国临床肿瘤学会(CSCO)青年委员会委员
中国抗癌协会肺癌专业委员会青年委员会委员兼内科学组秘书
海峡两岸医药卫生交流协会肿瘤防治专家委员会胸部肿瘤专业学组委员
美国纽约叶史瓦大学爱因斯坦医学院访问学者(2014.8-2015.9)
主要成就:上海市青年拔尖人才、上海市浦江人才、上海市人才发展基金资助。作为第一/共同第一作者发表SCI收录10篇,总IF=73.43,包括:Nature Communications、PNAS、JTO、Chest等杂志。承担国家自然科学基金青年项目等多项课题
TROP2是ADC药物的绝佳靶点,在NSCLC中高表达且通过多重途径影响患者预后,已成为肺癌治疗的重要靶点
TROP2是一种跨膜糖蛋白,具有肿瘤细胞过表达、组成型内吞、送至溶酶体等特性,使其成为ADC药物极具吸引力的靶点。与正常组织相比,TROP2在肿瘤细胞中的内吞作用更强,肿瘤细胞表面过表达的TROP2可被优先结合,这提示TROP2是ADC药物的绝佳靶点[1]。
TROP2可通过激活下游信号通路发挥重要作用,促进细胞的增殖、存活、侵袭和转移[2-4]。TROP2在各种上皮组织中均表达,包括肺、乳腺、胃等各种器官和组织,且与正常组织相比,TROP2在肿瘤中呈高表达状态,而TROP2在肺鳞癌和肺腺癌的表达相比其他瘤种更高[2,4,5],TROP2目前已成为肺癌治疗的重要靶点之一。有研究显示,228例肺腺癌患者中TROP2阳性达到100%,103例肺腺癌患者中TROP2阳性达到92%[6]。另有研究探究了TROP2在肺鳞癌和肺腺癌中的表达强度[5],结果发现,肺腺癌患者中有64%患者TROP2高表达,肺鳞癌患者中有75%患者TROP2高表达。还有研究发现,TROP2高表达与肺癌患者预后相关[5,6],TROP2高表达与肺腺癌患者(尤其是无EGFR突变肺腺癌)总生存期(OS)缩短显著相关。
Dato-DXd的抗肿瘤作用机制
ADC由特异性抗体、连接子及细胞毒性药物载荷三部分组成,特异性抗体精准识别肿瘤细胞表面特异性抗原后,细胞毒药物载荷被精准释放于肿瘤细胞而高效杀伤肿瘤细胞。Dato-DXd作为肺癌治疗领域研发进展速度最快、临床研究布局最广的TROP2 ADC,其抗肿瘤作用机制在新型TROP2 ADC药物中最具代表性。首先,Dato-DXd选择性的与肿瘤细胞表面过表达的TROP2结合,随后Dato-DXd被表达TROP2的肿瘤细胞内吞并进入细胞,四肽连接子被肿瘤细胞内上调表达的溶酶体蛋白酶裂解,因而有效载荷DXd被释放至肿瘤细胞中。Dato-DXd的有效载荷DXd是一种拓扑异构酶I抑制剂,游离DXd进入细胞核后,可损伤肿瘤细胞DNA而导致肿瘤细胞死亡。另外,有效载荷DXd具有高细胞膜渗透性,会产生旁观者效应,可消除目标肿瘤细胞及周围异质性肿瘤细胞[7-11]。
Dato-DXd独特分子结构,集“精准、强效、安全”3大优势于一身
Dato-DXd、戈沙妥珠单抗和SKB264是目前临床研究阶段TROP2 ADC的三款代表药物。虽同为TROP2 ADC,但三种药物结构上存在诸多不同(表1)。经过科学严谨的设计和合理优化,Dato-DXd呈现出独特的分子结构特征,使得Dato-DXd在TROP2 ADC药物同品类中展现出疗效、安全性最优的潜力。
表1 不同TROP2 ADC结构特点[9,12-19]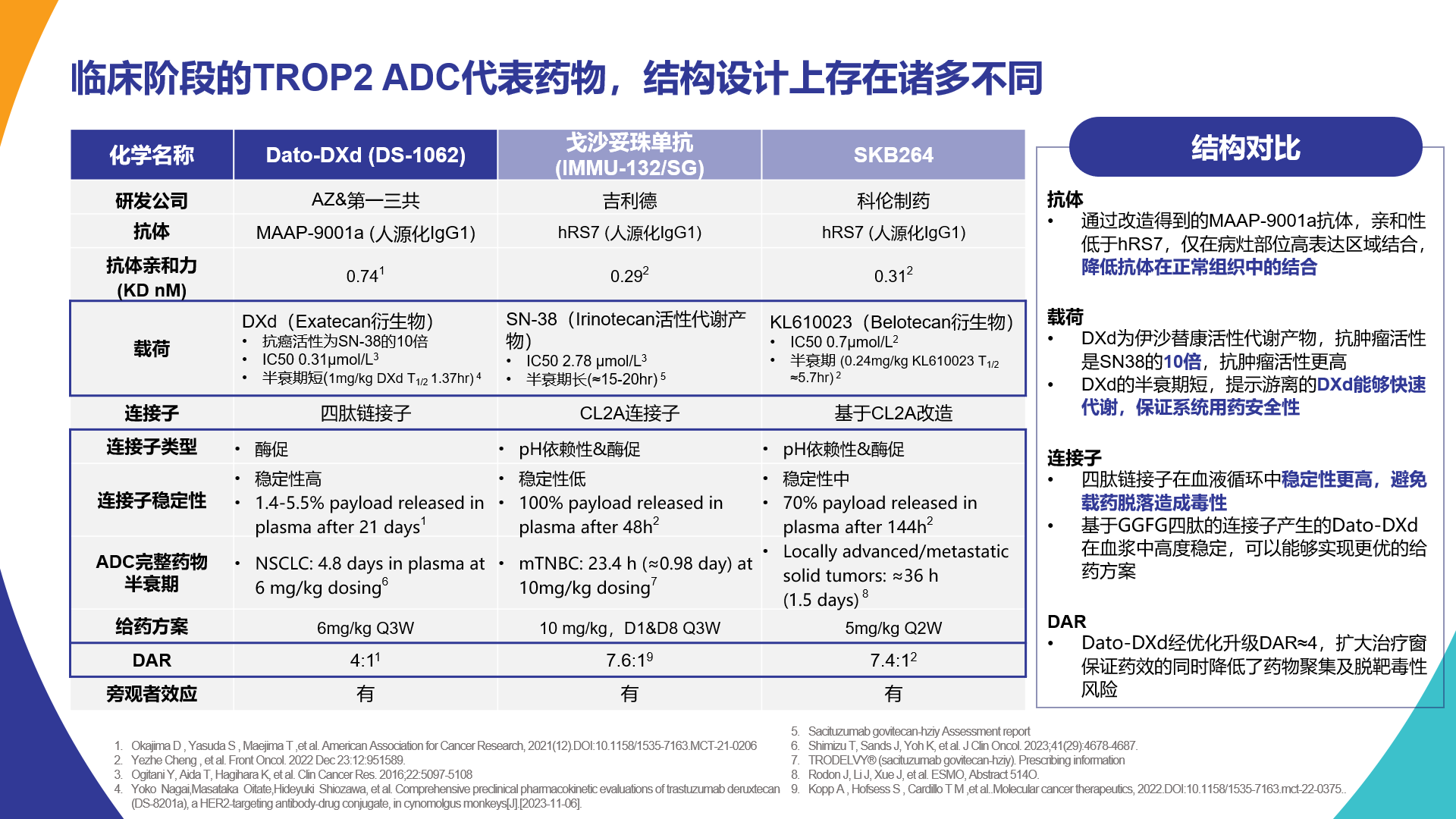
Dato-DXd的抗体具有高选择性,精准治疗的同时可保障用药更安全
抗体对于ADC药物与靶抗原之间的特异性结合至关重要,抗原抗体亲和力常数(KD)是抗原抗体结合反应的重要参数,KD值越低,亲和力越高。有研究者利用膜定位检测法发现,TROP2在皮肤和消化道等组织和器官中也都有一定表达[20]。因此考虑到低亲和力抗体可降低ADC药物与正常组织的结合,从而可降低药物在正常组织中的积蓄和毒性,而且较低的亲和力允许抗体更深的渗透到肿瘤细胞中。因此Dato-DXd的抗体MAAP-9001a在设计之初,通过改造减少了抗体亲和力,使得Dato-DXd仅与TROP2高表达肿瘤细胞结合,与正常组织结合减少,从而确保了Dato-DXd在精准、高效杀伤肿瘤细胞的同时不在正常细胞积蓄,保证了用药安全性[12]。而戈沙妥珠单抗和SKB264具有相同的人源化IgG1抗体——hRS7,其KD值仅约为0.3nM[13],具有较高的抗原结合亲和力,包括与正常组织细胞的结合。
Dato-DXd的载荷DXd具有更高的抗肿瘤活性
载荷是ADC药物发挥抗肿瘤作用的核心组成部分,其抗肿瘤活性和理化性质直接关系到ADC药物的临床疗效。Dato-DXd、戈沙妥珠单抗、SKB264的载荷分别为:DXd、SN38和KL610023,三者同为拓扑异构酶I抑制剂,其抗肿瘤活性远高于传统化疗药物。半数抑制浓度(IC50)是指诱导肿瘤细胞凋亡50%的载药浓度,因此ADC药物的理想选择是IC50值更低的载药。Dato-DXd的有效载荷DXd是伊沙替康活性代谢产物,体外实验显示, DXd、SN-38、KL610023的IC50值分别为0.31umol/L、2.78umol/L、0.7umol/L[13,14],可见DXd的抗肿瘤活性是SN38的近10倍,是KL610023的约2倍,这意味着DXd在干扰肿瘤细胞DNA复制和重组方面更有效,具有更高的抗肿瘤活性。
Dato-DXd的载荷DXd半衰期最短,能被快速清除,组织滞留及脱靶毒性风险低
除了临床疗效,ADC药物载荷的理化性质也直接关系到药物的安全性。临床前研究中,予以食蟹猴静脉注射DXd并评估动力学特征,结果发现游离DXd在静脉给药后被迅速清除,半衰期仅为1.37hr,而SN-38、KL610023的半衰期分别为20hr、5.7hr[13-15]。不同于整体药物半衰期,有效载荷半衰期短意味着在血液循环中可被快速清除,全身暴露及组织滞留风险低,脱靶毒性少,从而保证了药物安全性,这是游离DXd非常有优势的安全性特点之一。简言之,DXd半衰期最短,意味着游离DXd能够被快速代谢,从而可保证系统用药的安全性。
Dato-DXd的四肽连接子在血液循环中更稳定,延长整体药物半衰期,药效更稳定,给药更便利
Dato-DXd的连接子是基于GGFG的四肽连接子,这种独特的连接子在血浆中可保持高度稳定,并能被肿瘤细胞内上调表达的溶酶体选择性剪切,可精准的将细胞毒药物递送至肿瘤细胞内。体外释放研究显示,Dato-DXd在人体、猴、小鼠和大鼠血浆中很少释放,21天时的血浆中DXd释放率仅为1.4%-5.5%[12],这证明Dato-DXd连接子在血液循环中非常稳定,为药物提供了更好的药代动力学特征。另有研究发现,在食蟹猴中注射一次 Dato-DXd(6 mg/kg)后,血浆中Dato-DXd浓度和总抗体浓度无显著差异,且仅在早期时间点检测到较低水平的DXd释放,再次证明了游离载药半衰期短,整体Dato-DXd半衰期长的特点,这些特征为实现临床应用更优给药方案提供了基础和保障。戈沙妥珠单抗的连接子为pH依赖性、酶促的CL2A连接子。既往研究显示,将戈沙妥珠单抗与血浆共浴,48hr时血浆中载荷SN-38的释放率达到100%。SKB264的连接子基于CL2A改造而来,研究显示,将SKB264与血浆共浴,144hr时血浆中载荷KL610023的释放率达到70%[13]。
Dato-DXd药物抗体比(DAR)被优化至4,扩大治疗窗保证药效的同时减少药物聚集及脱靶毒性
DAR是指与每个抗体结合的平均药物数量,影响着ADC药物的安全性和有效性。由于TROP2广泛表达于如皮肤、肺、乳腺等正常组织器官,DAR较高也可能危害正常细胞,DAR值过高,药物清除率增加,可能引起药物聚集,从而增加药物毒性。Dato-DXd、戈沙妥珠单抗、SKB264三者的DAR分别为4、7.6、7.4,Dato-DXd在设计之初,其DAR值被优化为4,是经过合理优化后得到的最佳值,可最大化治疗窗并限制毒性[12,13,19] 。总之,针对TROP2靶点,Dato-DXd的DAR数值为4是最佳状态,可同时保证药物的安全性和有效性,达到了抗肿瘤活性和安全性的最佳平衡。
Dato-DXd精心的结构设计保障了药物安全性,≥3级TRAEs和血液学毒性最低
Dato-DXd的3级及以上治疗相关不良事件(TRAE)发生率和血液学毒性发生率最低。在相关III期研究和II期研究中,Dato-DXd的3级及以上TRAE发生率不超过30%,其他TROP2 ADC药物发生率约为67%。Dato-DXd的3级及以上中性粒细胞减少症发生率仅为1%,而其他TROP2 ADC药物发生率约超过28% [21-25](表2)。
表2 不同TROP2 ADC临床研究中的安全性结果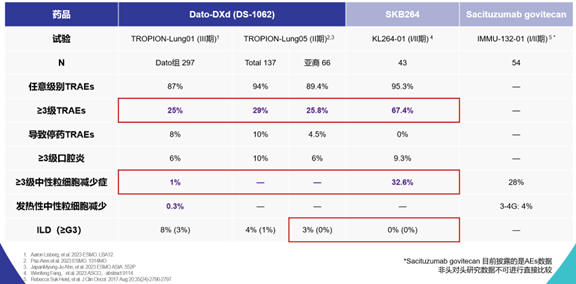
Dato-DXd已开启肺癌ADC治疗的新时代
Dato-DXd临床进展最快,布局最广,且Dato-DXd已率先公布了大型III期研究结果,开启了肺癌ADC药物治疗的新时代(表3)。TROPION-Lung01研究在2023 ESMO大会上重磅公布积极阳性PFS结果,该研究由陆舜教授作为中国的主要研究者。TROPION-Lung01是目前肺癌领域,ADC药物中首个且唯一报道阳性结果的大型III期临床研究,也是该领域首个且唯一针对经治非鳞状NSCLC患者全人群(ADC vs. 多西他赛)获得阳性结果的III期临床研究。
表3 TROP2 ADC相关临床研究进展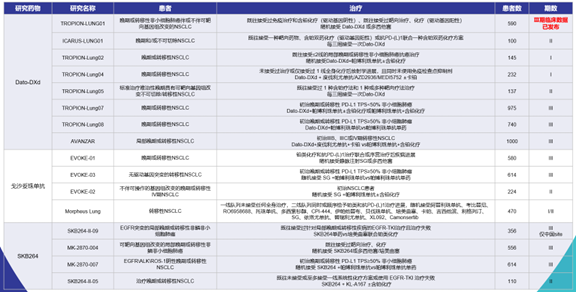
总语
TROP2在NSCLC中高表达,且肺腺癌中TROP2高表达与预后不良相关。ADC药物主要通过与抗原特异性结合、内化进入肿瘤细胞,通过溶酶体降解释放有效载荷,损伤肿瘤细胞DNA而发挥抗肿瘤作用。在同类TROP2 ADC药物中,Dato-DXd结构设计具有多重优势,展现出疗效和安全性最佳的潜质:
①Dato-DXd的具有高选择性,与正常组织结合减少。因此Dato-DXd在发挥更精准抗肿瘤治疗的同时可确保更安全;另外,Dato-DXd药物抗体比(DAR)被优化至4,最大化治疗窗保证药效的同时进一步保障了用药安全性。
②有效载荷DXd的抗肿瘤活性高,半衰期最短,在血液循环中,能被快速清除。组织滞留及脱靶毒性风险低,因此作为核心抗肿瘤作用的组份DXd展现出既高效又安全的优势;
③基于GGFG的四肽连接子在血液循环中高度稳定,延长了整体药物半衰期,使得药效更稳定,临床给药更便利。
总体而言,精心的结构设计保障了Dato-DXd更精准的抗肿瘤疗效,同时兼顾用药安全性、便捷性,为未来临床应用提供了强大的内核支持。
1. Hammood M, Craig AW, Leyton JV. Impact of Endocytosis Mechanisms for the Receptors Targeted by the Currently Approved Antibody-Drug Conjugates (ADCs)-A Necessity for Future ADC Research and Development. Pharmaceuticals (Basel). 2021 Jul 15;14(7):674. doi: 10.3390/ph14070674. PMID: 34358100; PMCID: PMC8308841.
2. Goldenberg DM, et al. Oncotarget. 2018;9:28989-29006.
3. Lenárt S, et al. Cancers (Basel). 2020;12:3328.
4. rerotola M, et al. Oncogene. 2013;32:222-233.
5. Inamura K, et al. Oncotarget. 2017;8:28725-28735.
6. Mito R, et al. Pathol Int. 2020;70:287-294
7. Okajima D, et al. Mol Cancer Ther. 2021;20:2329-2340.
8. Nakada T, et al. Chem Pharm Bull (Tokyo). 2019;67:173-185.
9. Ogitani Y, et al. Clin Cancer Res. 2016;22:5097-5108.
10. Shiose Y, et al. Biol Pharm Bull. 2007;30:2365-2370.
11. Ogitani Y, et al. Cancer Sci. 2016;107:1039-1046.
12. Okajima D , Yasuda S , Maejima T ,et al. American Association for Cancer Research, 2021(12).DOI:10.1158/1535-7163.MCT-21-0206
13. Yezhe Cheng , et al. Front Oncol. 2022 Dec 23:12:951589.
14. Yoko Nagai,Masataka Oitate,Hideyuki Shiozawa, et al. Comprehensive preclinical pharmacokinetic evaluations of trastuzumab deruxtecan (DS-8201a), a HER2-targeting antibody-drug conjugate, in cynomolgus monkeys[J].[2023-11-06].
15. Sacituzumab govitecan-hziy Assessment report
16. Shimizu T, Sands J, Yoh K, et al. J Clin Oncol. 2023;41(29):4678-4687.
17. TRODELVY® (sacituzumab govitecan-hziy). Prescribing information
18. Rodon J, Li J, Xue J, et al. ESMO, Abstract 514O.
19. Kopp A , Hofsess S , Cardillo T M ,et al..Molecular cancer therapeutics, 2022.DOI:10.1158/1535-7163 Liu X, et al. Pharmacol Ther . 2022 Nov;239:108296.
20. Stepan LP, Trueblood ES, Hale K, et al. Expression of Trop2 cell surface glycoprotein in normal and tumor tissues: potential implications as a cancer therapeutic target. J Histochem Cytochem, 2011, 59(7):701-710.
21. Aaron Lisberg, et al. 2023 ESMO. LBA12.
22. Paz-Ares et al. 2023 ESMO. 1314MO
23. JapanMyung-Ju Ahn, et al. 2023 ESMO ASIA. 552P
24. Wenfeng Fang,et al. 2023 ASCO,abstract 9114
25. Rebecca Suk Heist, et al. J Clin Oncol. 2017 Aug 20;35(24)-2790-2797.
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


