放射治疗(RT)是许多癌症标准治疗的重要组成部分,可改善包括白血病和中枢神经系统(CNS)肿瘤在内的儿童恶性肿瘤患者的临床预后[1]。然而,研究表明,放射线诱导高级别胶质瘤(radiation-induced high-grade gliomas,RIG)是儿童脑瘤患者放疗晚期难以治愈的并发症,且潜伏期不等[2-5]。RIG通常表现为侵袭性临床病程,伴有不良预后,且临床分子特征与儿童高级别胶质瘤患者存在显著差异,因此早期准确诊断(包括将RIG与原发肿瘤的复发区分开来)对于优化治疗计划至关重要[2,6-7]。
最近的研究表明,DNA甲基化谱是将中枢神经系统肿瘤分类为具有临床意义的实体的一种可靠且可重复的方法[8-11]。因此,利用DNA甲基化结合靶向测序、RNA-seq对RIG进行全面的分子表征,以检测可能预测或解释其在RT后形成的独特的(外)遗传特征,和/或可能作为诊断或治疗标记物。
研究结果
实验设计
研究共纳入32例放射线诱导高级别胶质瘤(RIG)患者,其中包括经放射治疗的23例髓母细胞瘤(MB)患者和9例急性淋巴细胞白血病(ALL)患者。利用DNA甲基化分析、RNA-seq和DNA测序分析RIG患者的分子特征。
如下图:MB-RIG肿瘤发生在小脑(20/ 23 vs.大脑半球3/23),而大脑半球是rt中剂量最高的部位。ALL-RIG肿瘤主要出现在大脑半球(7/ 9 vs. MB-RIG的3/23。p < 0.01;图1a),只有2例发生在后窝。性别比例略有向男性倾斜(男女比例:1.28:1)(图1b)。MB患者发生RIG的潜伏期为2 - 30年(n = 23,中位数:5年),ALL患者为3-17年(n = 9,中位数:8年;图1 c)。
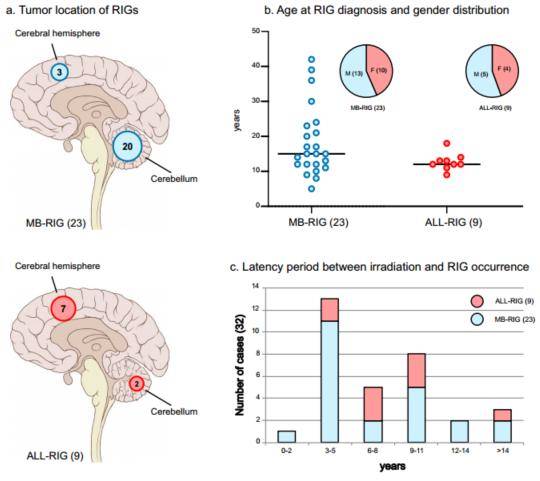
图1 临床患者特征
MB-RIG患者与ALL-RIG患者生存性分析
在有随访数据的16/23 MB-RIG和5/9 ALL-RIG患者中,观察到RIG患者的临床生存特征与H3K27M突变的胶质瘤患者类似,甚至更差。分析显示,13/16例 MB-RIG患者和4/5例 ALL-RIG患者中位OS分别为6个月和 8.5个月。
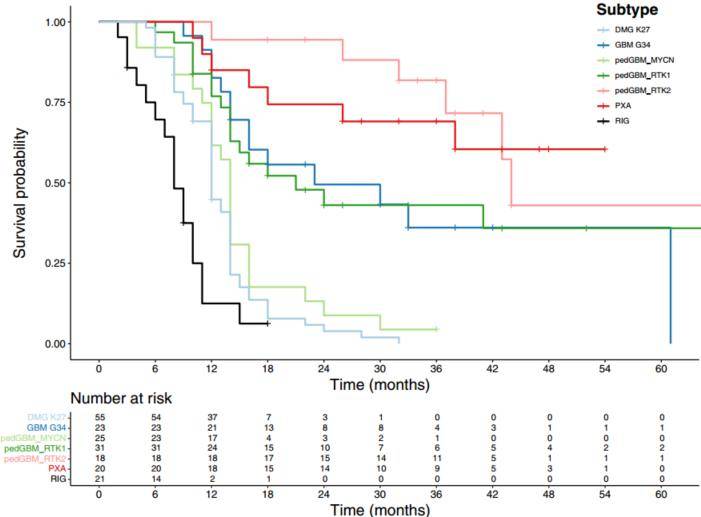
图2 ALL-RIG和MB-RIG患者的总生存率
辐射诱导的胶质瘤(RIG)的DNA甲基化分析
通过无监督聚类和t-SNE分析了MB-RIG和ALL-RIG的DNA甲基化模式,并与来自已知分子特征的儿童HGG亚组的120个参考样本进行了分析。两种RIG与pedGBM_RTK1肿瘤的甲基化模式非常相似(29/32,91%;图3);剩余2个MB-RIG和1个ALL-RIG显示的甲基化模式更类似于多形性黄色星形细胞瘤(PXA;图3)。综上,RIG 的DNA甲基化模式表明肿瘤之间具有高度的相似性(可能是共同的起源),并且与任何其他HGG DNA甲基化类别存在显著差异。
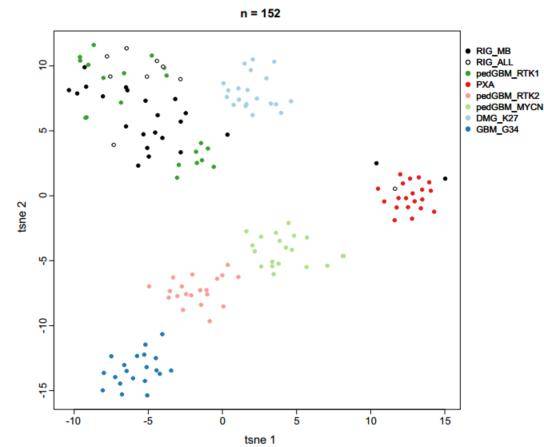
图3 对RIG患者进行甲基化分析
另外,对11个MB-RIG进行分子特征分群,发现它们代表了所有四个主要的MB亚群(MB- WNT: 1/11;MB-SHH: 3/11;MB -group3:2/11;MB -Group4:5/11)。发病率方面无显著差异。但根据t-SNE和拷贝数分析证实了原发性髓母细胞瘤和继发性RIG之间不同的生物学性质(图4a,b),且两对原发性髓母细胞瘤和RIG患者(MB/ RIG-28;MB/RIG-29)的苏木精和伊红组织学染色(图4c)显示出不同的形态学特征。
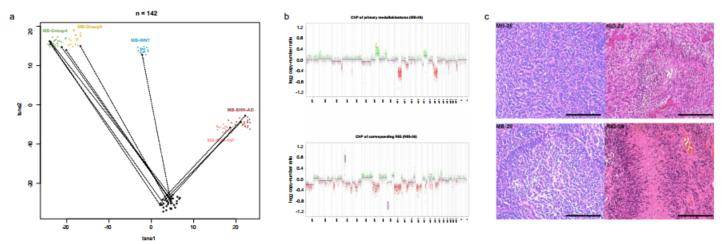
图4 原发性MB患者与MB-RIG患者的分子/组织病理特征比较
RIG患者表现出复发性PDGFRA扩增和CDKN2A/B缺失
PDGFRA扩增(6/9 ALL-RIG;11/23 MBRIG)和CDKN2A/B的缺失(4/9 ALL-RIG;17/23 MB-RIG)代表RIG中最常见的拷贝数改变(CNAs), 其中2/8 ALL-RIG和8/23 MB-RIG患者同时表现PDGFRA扩增和CDKN2A/B缺失(图5)。此外,RIG队列中PDGFRA扩增的总频率(17/ 32,55%)高于未选择的pedHGG队列。MET扩增(9/32,28%;以前也与儿童GBMs34的MET融合有关)和CDK4(5/ 32,16 %)在RIG的队列中较为常见。其他更广泛的染色体CNAs包括染色体臂1q (16/ 32,50%), 1p缺失(19/ 32,59%),6q缺失(18/ 32,56%),13q缺失(23/ 32,72%)和14q缺失(16/ 32,45%)(图5)。在染色体拷贝数分析方面,与非RIG的pedGBM-RTK1肿瘤相比,RIG患者基因组显示出更大的范围和更多的染色体断点(图6)。

图5 RIG患者基因组景观
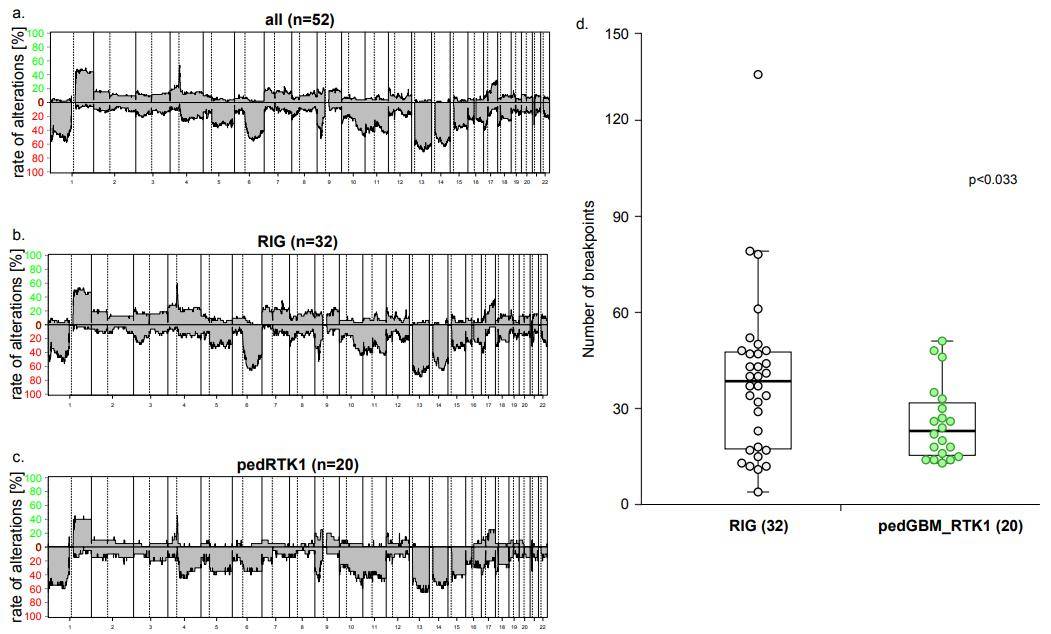
图6 RIG肿瘤与非RIG的 pedGBM_RTK1肿瘤染色体拷贝数分析
RIG患者基因组图谱
对RIG样本的一部分进行了RNA测序(n = 9)、基因面板测序(n = 5)和全外显子组测序(n = 13)。RIG在H3组蛋白、IDH1/2、BRAF或TERT启动子区域的基因中都没有体细胞热点突变。18个测试样本中有4个(22%)表现出TP53基因的体细胞突变。其他体细胞突变包括CBL、PDGFRA、NTRK2、EGFR、RAF1、ATRX和BCOR;表1)。1例患者(RIG-25)携带TP53种系剪接位点突变。
RNA测序数据分析(n = 9)显示相关基因融合包括PTPRZ1:MET (RIG-11, RIG-5),CAPZA2:MET (RIG-09),FYCO1:RAF1(RIG-08)和GFAP1:NTRK2 (RIG-13)(图7)。此外,PXA亚组的三个肿瘤中的两个中检测到FYCO1:RAF1和GKAP1:NTRK2融合(图3)。预测这两种重排都会导致激酶结构域的组成性激活。通过n端调控结构域(RAF1)或本构二聚化(NTRK2)的缺失。通过复杂的结构重排,PRPRZ1:MET融合蛋白包含一个由高活性PTPRZ1启动子驱动的几乎全长的MET蛋白。所有MET融合的病例(RIG-09, RIG-11, RIG-25)在DNA甲基化阵列的拷贝数谱上都显示了MET的扩增。虽然所有四种导致MAPK/ERK通路异常激活的基因重排在高级别胶质瘤中都有报道,但在RIGs34-36中没有发现。
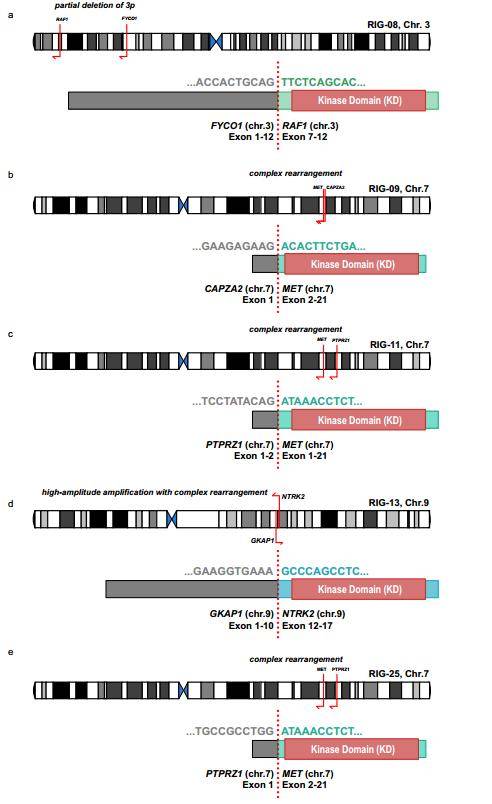
图7 基因重排导致异常的MAPK/ERK通路信号
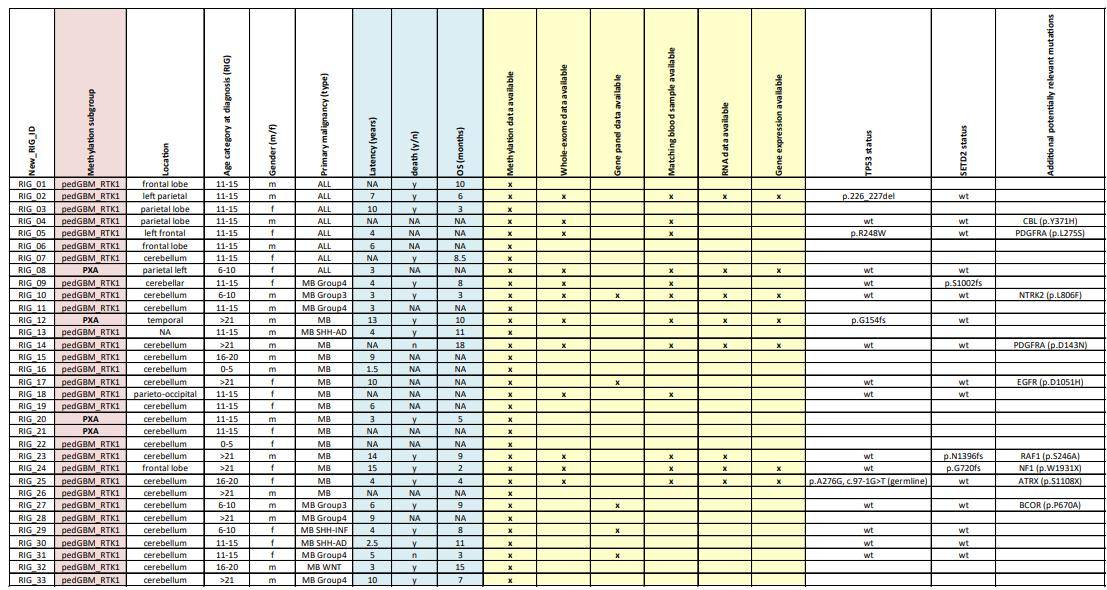
表1 RIG肿瘤的基因组图谱分析
小结
研究结果表明,RIG是一种侵袭性的、相对同质的中枢神经系统肿瘤,预后极差。在没有体细胞H3/IDH热点突变的情况下,表现PDGFRA复发性扩增和CDKN2A/B缺失。此外,一小部分RIG具有更类似PXA亚组的分子特征,在RAF1和NTRK2中存在潜在的药物靶点,使得在更大的队列中进行研究具备可行性。此外,本研究还揭示了散发性HGG的pedGBM-RTK1组与RIG患者在起源上的相似性,这对于进一步了解这些继发性肿瘤发生的机制十分重要。
围绕患者临床需求,阔然基因秉承“精准医疗践行者”的使命,推出成人/儿童患者群体的胶质瘤分子分型套餐和分型用药套餐,通过指南推荐基因和潜在靶点检测,全面为患者提供精准诊疗方案!
[1] Taylor RE, Bailey CC, Robinson K, et al. International Society of Paediatric Oncology; United Kingdom Children's Cancer Study Group. Results of a randomized study of preradiation chemotherapy versus radiotherapy alone for nonmetastatic medulloblastoma: The International Society of Paediatric Oncology/United Kingdom Children's Cancer Study Group PNET-3 Study. J Clin Oncol. 2003 Apr 15;21(8):1581-91.
[2] Elsamadicy AA, Babu R, Kirkpatrick JP, Adamson DC. Radiation-induced malignant gliomas: a current review. World Neurosurg. 2015 Apr;83(4):530-42.
[3] Hamasaki, K., Nakamura, H., Ueda, Y., et al. Radiationinduced glioblastoma occurring 35 years after radiation therapy for medulloblastoma: case report. Brain Tumor Pathol. 27, 39–43 (2010).
[4] Madden JR, Addo-Yobo SO, Donson AM, et al. Radiation-induced glioblastoma multiforme in children treated for medulloblastoma with characteristics of both medulloblastoma and glioblastoma multiforme. J Pediatr Hematol Oncol. 2010 Oct;32(7):e272-8.
[5] Ng I, Tan CL, Yeo TT, Vellayappan B. Rapidly Fatal Radiation-induced Glioblastoma. Cureus. 2017 Jun 11;9(6):e1336.
[6] Donson AM, Erwin NS, Kleinschmidt-DeMasters BK, et al. Unique molecular characteristics of radiation-induced glioblastoma. J Neuropathol Exp Neurol. 2007 Aug;66(8):740-9.
[7] Northcott PA, Pfister SM, Jones DT. Next-generation (epi)genetic drivers of childhood brain tumours and the outlook for targeted therapies. Lancet Oncol. 2015 Jun;16(6):e293-302.
[8] Capper D, Jones DTW, Sill M, et al. DNA methylation-based classification of central nervous system tumours. Nature. 2018 Mar 22;555(7697):469-474.
[9] Hovestadt V, Jones DT, Picelli S, et al. Decoding the regulatory landscape of medulloblastoma using DNA methylation sequencing. Nature. 2014 Jun 26;510(7506):537-41.
[10] Pajtler KW, Witt H, Sill M, et al. Molecular Classification of Ependymal Tumors across All CNS Compartments, Histopathological Grades, and Age Groups. Cancer Cell. 2015 May 11;27(5):728-43.
[11] Sturm D, Orr BA, Toprak UH, et al. New Brain Tumor Entities Emerge from Molecular Classification of CNS-PNETs. Cell. 2016 Feb 25;164(5):1060-1072.

排版编辑:xiaodong












 苏公网安备 32059002004080号
苏公网安备 32059002004080号


