神经内分泌瘤(NEN)是一类具有高度异质性的少见肿瘤,其中胃、肠、胰腺NET占到约70%,治疗手段以外科手术为主[1]。然而对于已发生转移的NEN,由于其复杂性和异质性,系统治疗方案较为复杂,需对肿瘤部位、功能状态、分化情况等进行综合分析。本期病例分享带来一例分化良好的胃神经内分泌瘤(NET),伴肝转移,通过接受生长抑素类似物(SSA)长效奥曲肽微球成功抑制激素相关症状,结合肝动脉栓塞(TAE)获得症状改善与生存获益。
青岛大学附属医院肿瘤科 副主任医师
专业方向:神经内分泌肿瘤、 消化道肿瘤
进修学习:2021-10至2022-5复旦肿瘤医院跟随陈洁教授学习神经内分泌肿瘤专病
社会兼职:
中国抗癌协会神经内分泌肿瘤专委会委员
中国中医药信息学会常务理事
山东省医师协会神经内分泌专业委员会委员
山东省第一届肿瘤精准治疗专业委员会委员
青岛抗癌协会肿瘤综合治疗专业委员会常务委员
青岛市医学会精准医学分会委员兼秘书
基本信息
患者,女,50岁。
既往体健,无肿瘤家族史。
2023-2 主诉“间断餐后颜面及双手潮红3年,肝占位2年余”就诊。
2023-2-24 上腹部增强CT示胃大弯侧多发占位,考虑肿瘤性病变。
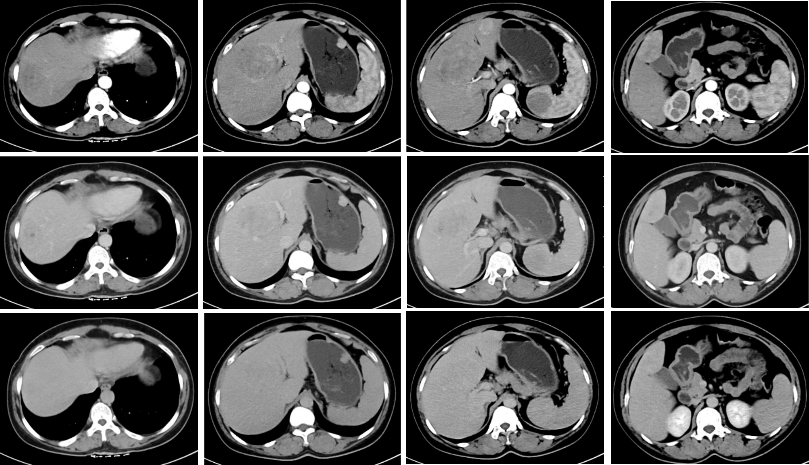
图1. 2023-2-24 上腹部增强CT
2023-3-1 上腹部增强MR示肝脏、脾脏、胃多发占位性病变,考虑恶性肿瘤性病变,转移瘤可能。
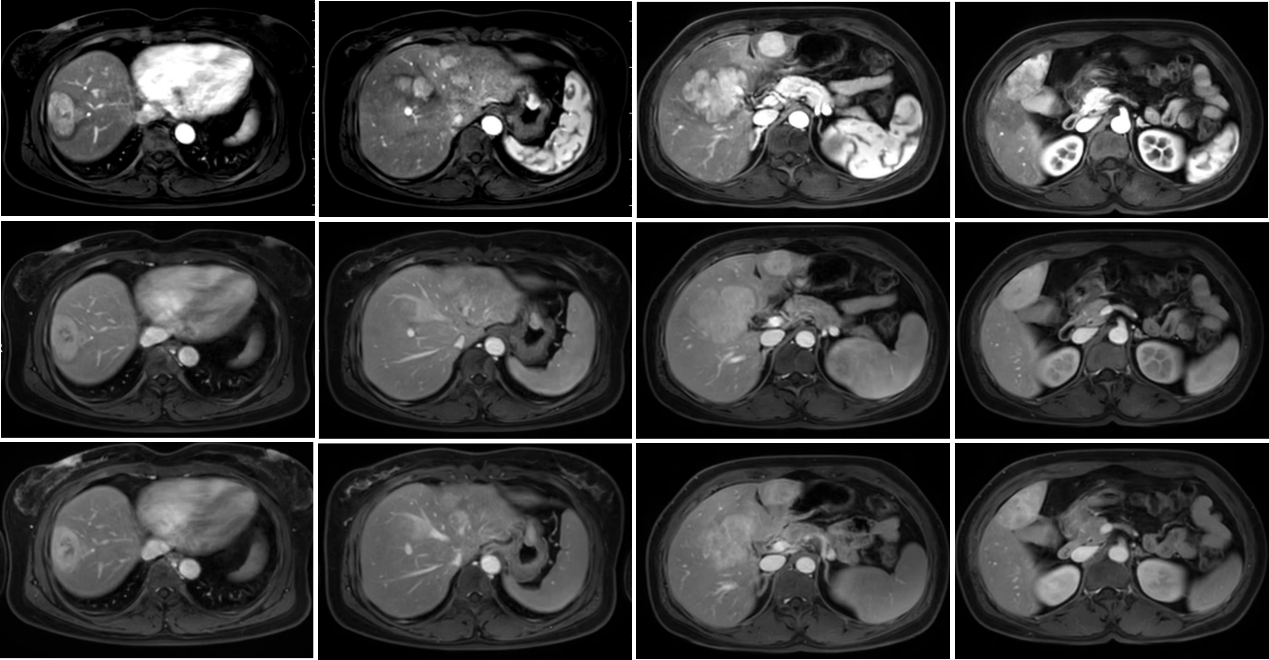
图2. 2023-3-1 上腹部增强MR
2023-3-9 行胃镜检查,示慢性萎缩性胃炎,胃体多发0.5-2.5cm的息肉样隆起肿物。
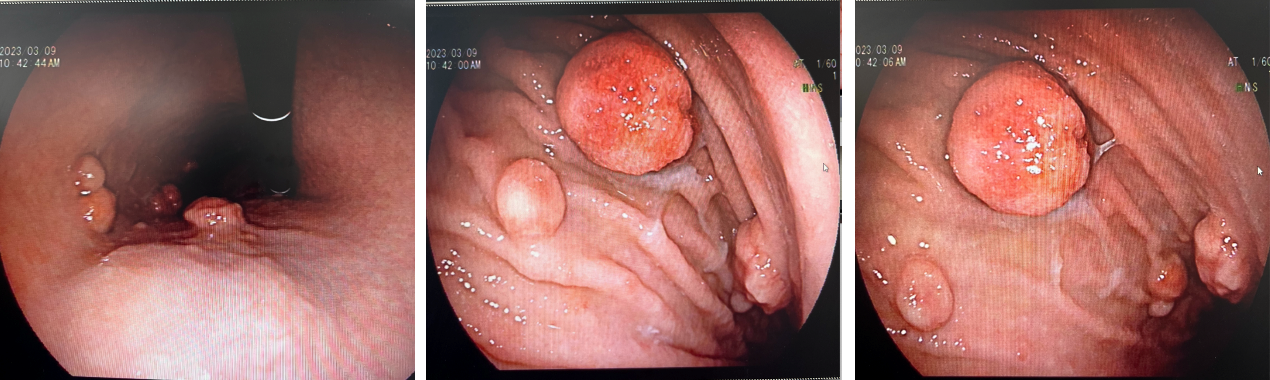
图3. 2023-3-9 胃镜
胃部病变活检示:
(胃体1、胃体2活检)粘膜组织慢性炎,粘膜内见呈梁状、巢团状、腺管状排列的异型细胞巢,结合免疫组化结果,符合神经内分泌瘤(NET),G2级。
免疫组化:CK(+)、Syn(+)、CgA(+)、CD56(局灶弱+)、Ki67(热点区约3%)、SSTR2(+)、CEA(-)、Arginase-l(-)
肝部病变活检示:
神经内分泌瘤,G1级,未见核分裂象,考虑转移性。穿刺组织太少,分级程度仅供参考。
免疫组化:CK(+)、CAM5.2(+)、CgA(+)、Syn(+)、SSTR2(+)、CD56(-)、Ki67(小于1%+)
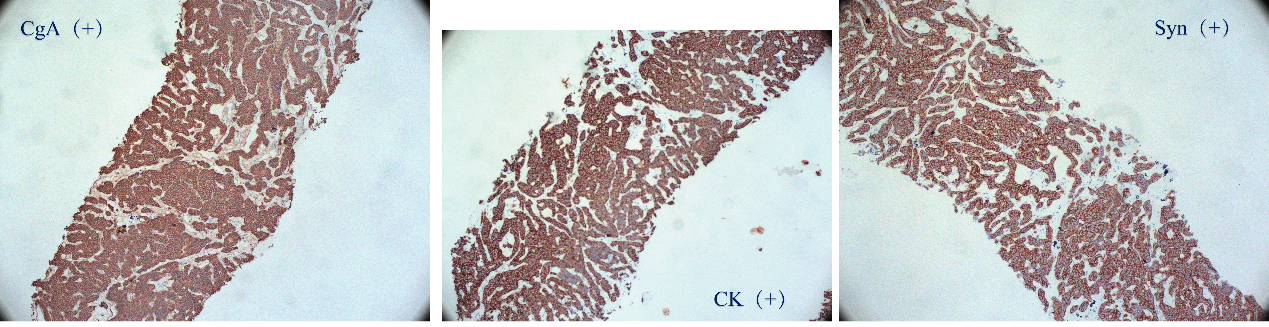
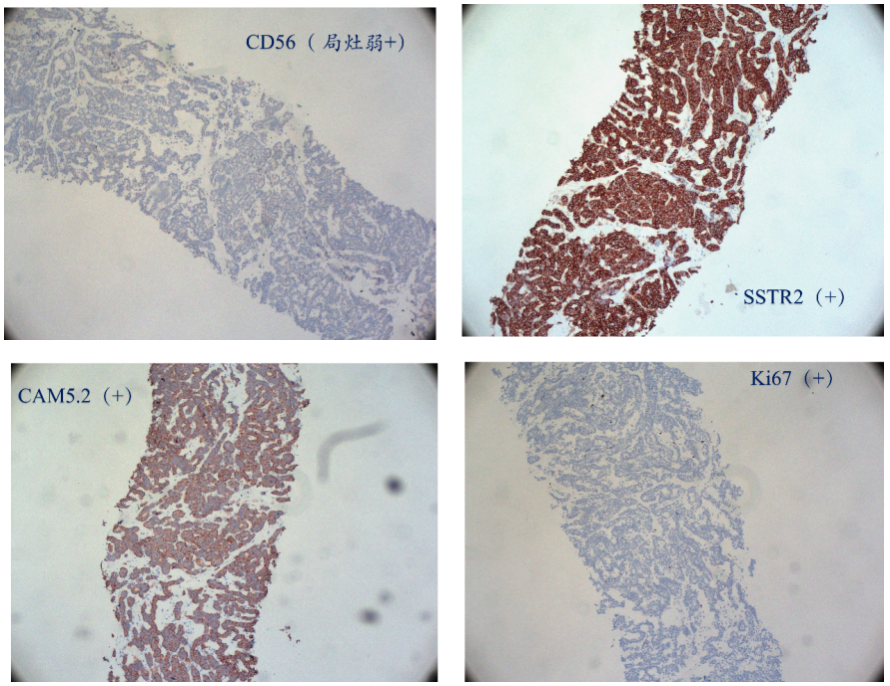
图4. 病理结果
2023-3-13 行18F-FDG PET/CT示胃壁多发结节并无FDG代谢相对增高,肝脏多发稍低密度肿块并FDG代谢减低,脾脏稍低密度肿块并FDG代谢轻度增高;左侧锁骨上区及右侧心膈角区小淋巴结并无FDG代谢增高。
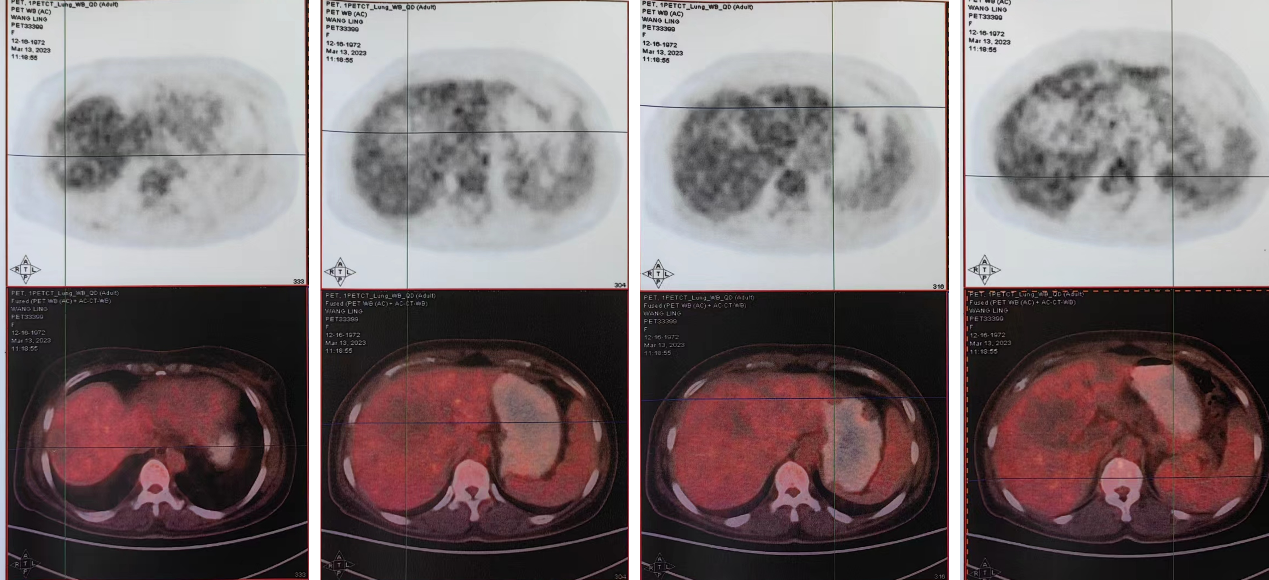
图5. 2023-3-13 8F-FDG PET/CT
2023-3-14 行18F-奥曲肽PET/CT,示胃壁多发结节并奥曲肽代谢增高,肝脏多发稍低密度影并奥曲肽代谢增高,符合胃多发神经内分泌肿瘤(G2级)并肝脏多发转移;脾脏稍低密度肿块并奥曲肽代谢增高、但低于脾脏生理性摄取,考虑脾脏原发肿瘤(血管瘤可能性大)。
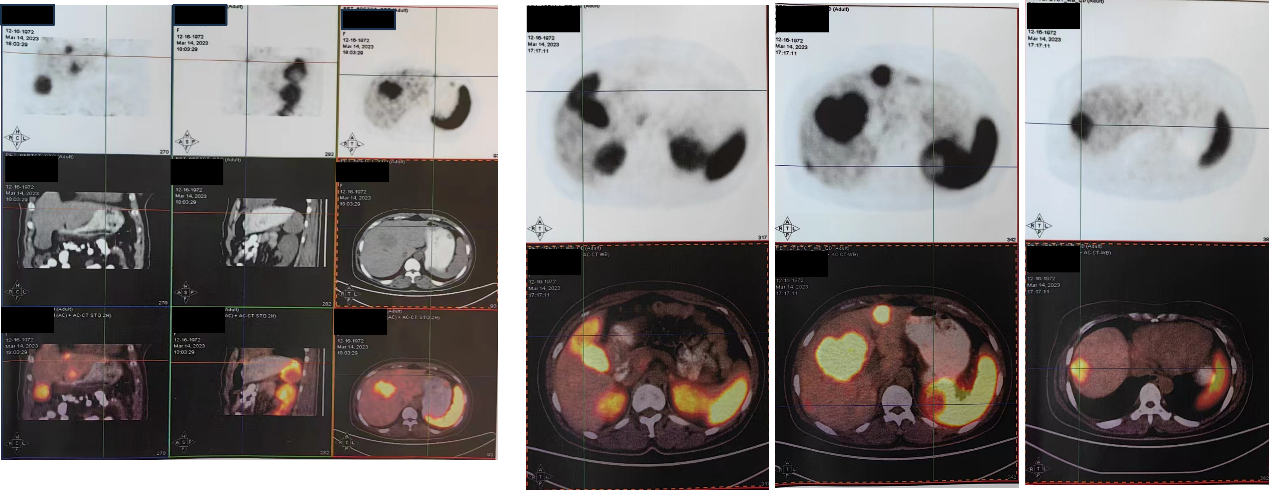
图6. 2023-3-14 18F-奥曲肽PET/CT
2023-3-20 完善其他检查,示人嗜铬粒蛋白A >800ng/mL,胃泌素(GAS) 173.00pg/mL,抗胃壁细胞抗体IgG(阳性+),抗内因子抗体IgG(阴性-),5-羟色胺 124.
结合检查结果,诊断:功能性1型胃NET(G2级)肝转移(G1级) IV期
MDT会诊后,考虑全身长效奥曲肽治疗,局部肝动脉栓塞术控制肝内病灶
2023-3-30 行奥曲肽微球 30mg im q4w
2023-3-31 行第1次TAE治疗,肝动脉多发肿瘤染色
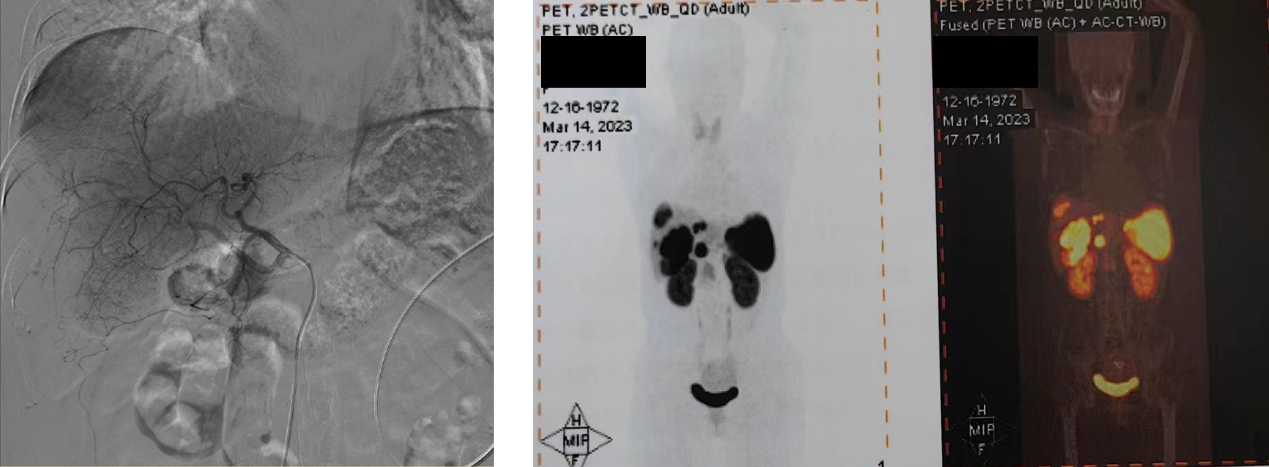
图7.2023-3-30 行第1次TAE
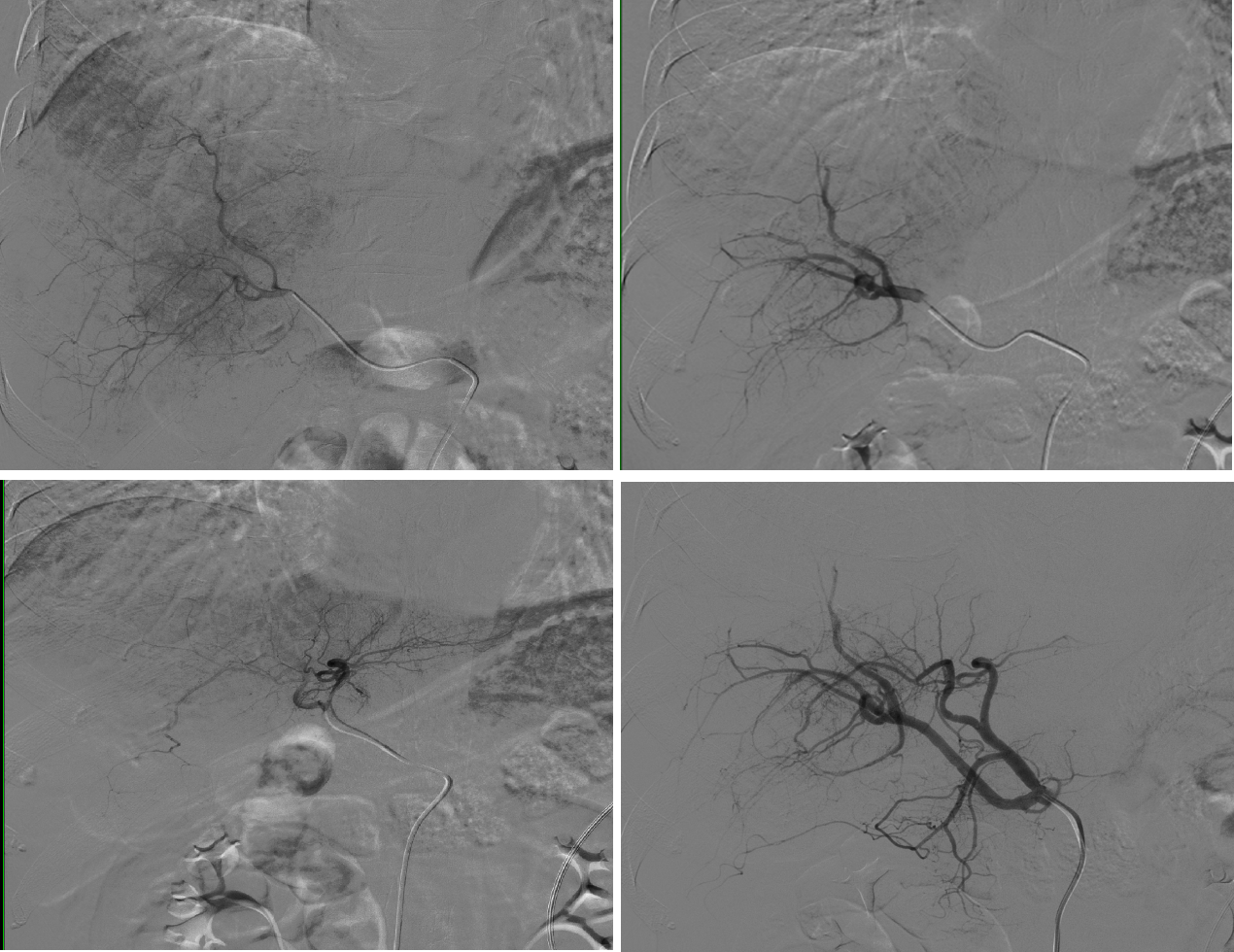
图8. 第1次TAE应用40-120um栓塞微粒球(上)与100-300um栓塞微粒球(下)
2023-4-7 进食活动后未再见面色潮红
复查结果如下:
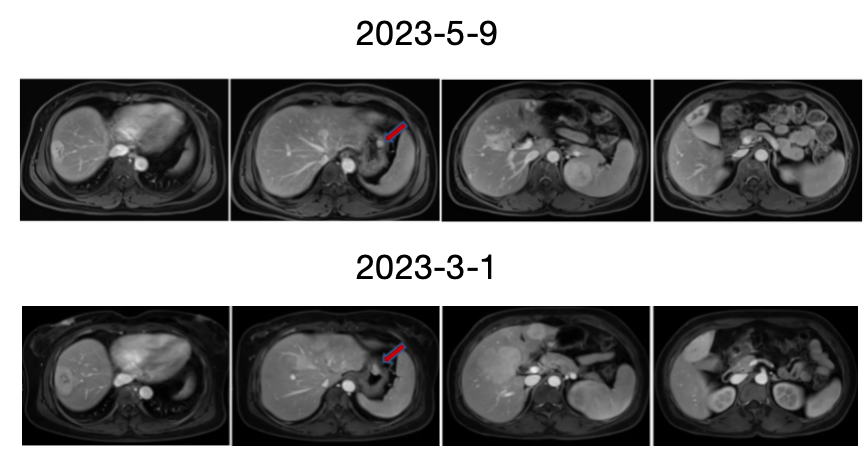
图9. 2023-5-9复查对比2023-3-1
2023-5-12 行第2次TAE治疗
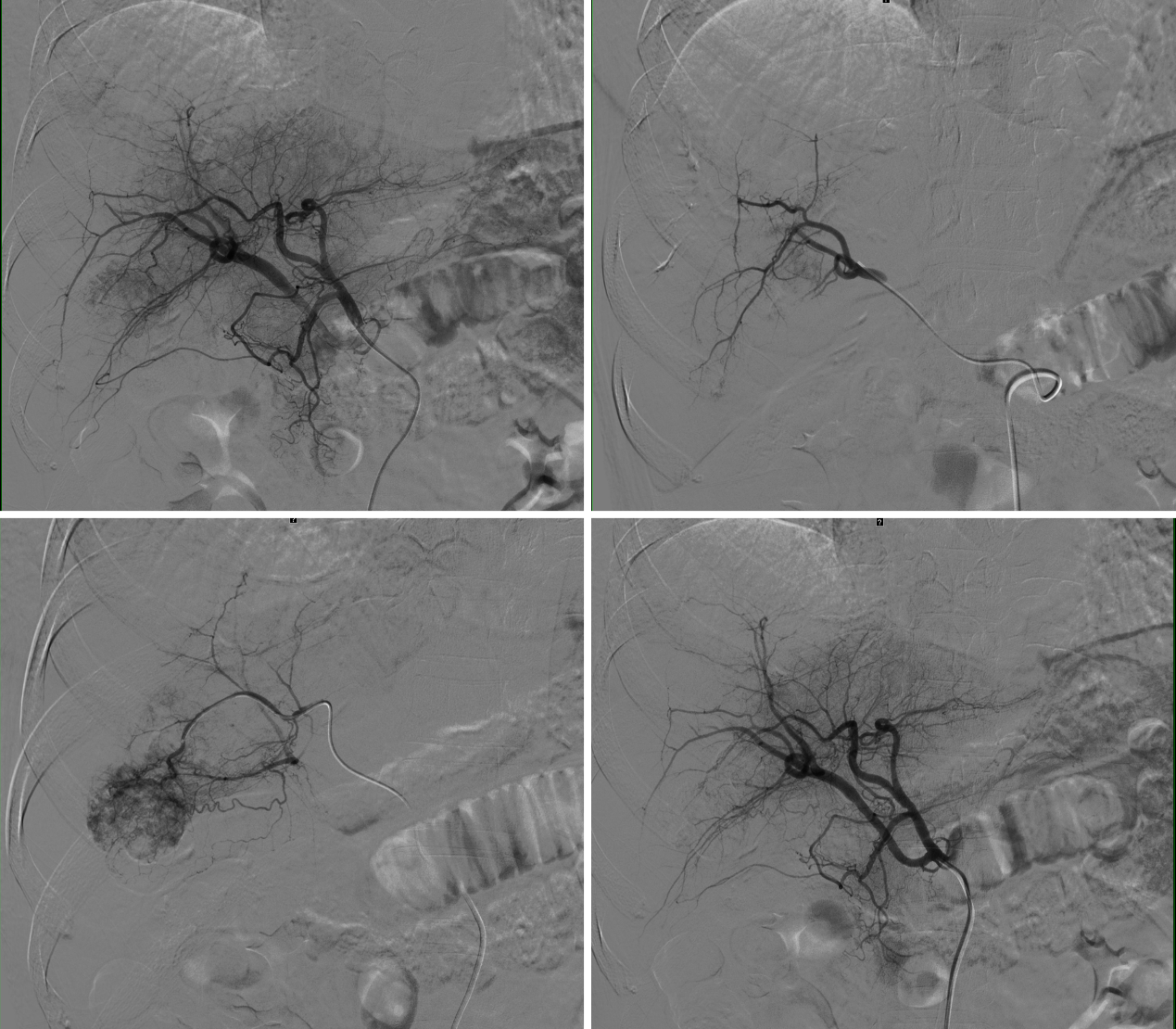
图10. 第2次TAE应用40-120um栓塞微粒
2023-6-1 长效奥曲肽+2次TAE治疗后,胃镜活检病理示:(胃体隆起)慢性非萎缩性胃炎,中度炎症,粘膜固有层及粘膜肌散在分布细胞巢,周围胃黏膜萎缩,可见神经内分泌细胞线性及微结节状增生,结合免疫组化结果符合神经内分泌肿瘤,未查见明确核分裂像,结合Ki-67指数倾向神经内分泌瘤(G1),活检组织少且局限。 免疫组化结果:CKpan(+),Syn(+),CgA(+),CD56(-),SSTR2(2+),INSM1(+),ATRX(+),p53(散在+),Rb(+),Ki-67(+,约2%)。
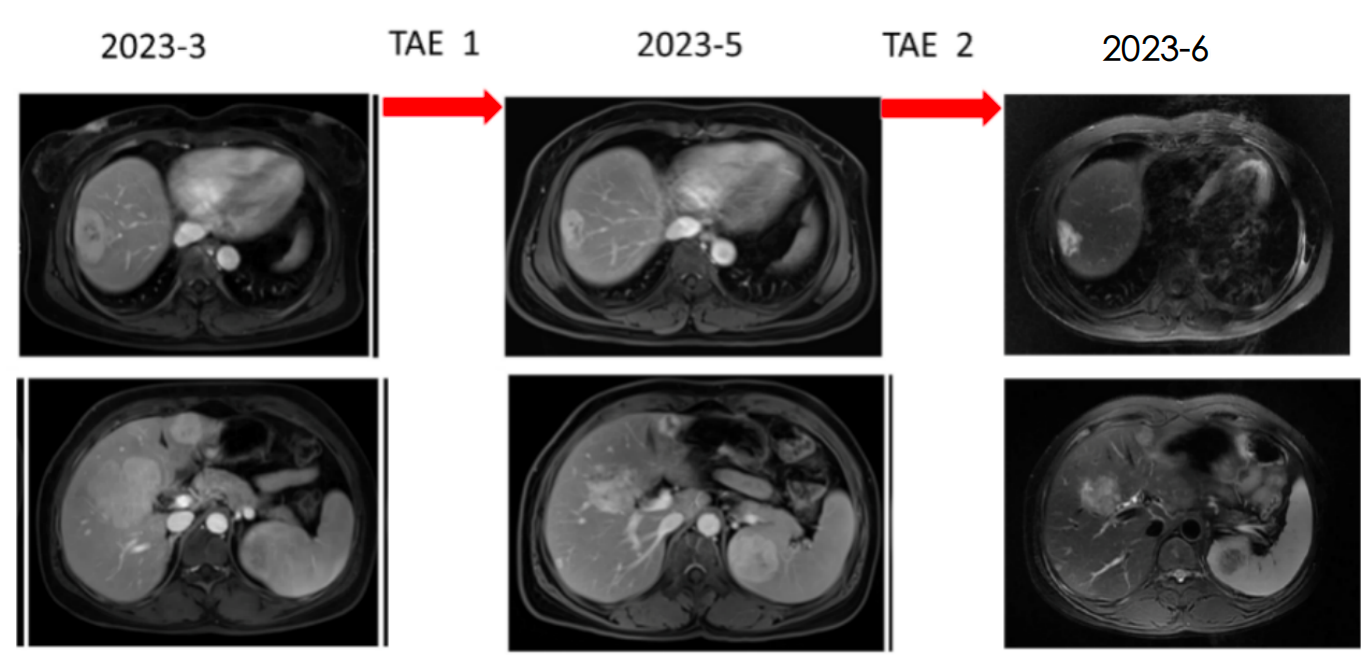
图11. 两次TAE前后对比
2023-8-9 行第3次TAE治疗,后持续奥曲肽微球 30mg im q4w,定期复查。
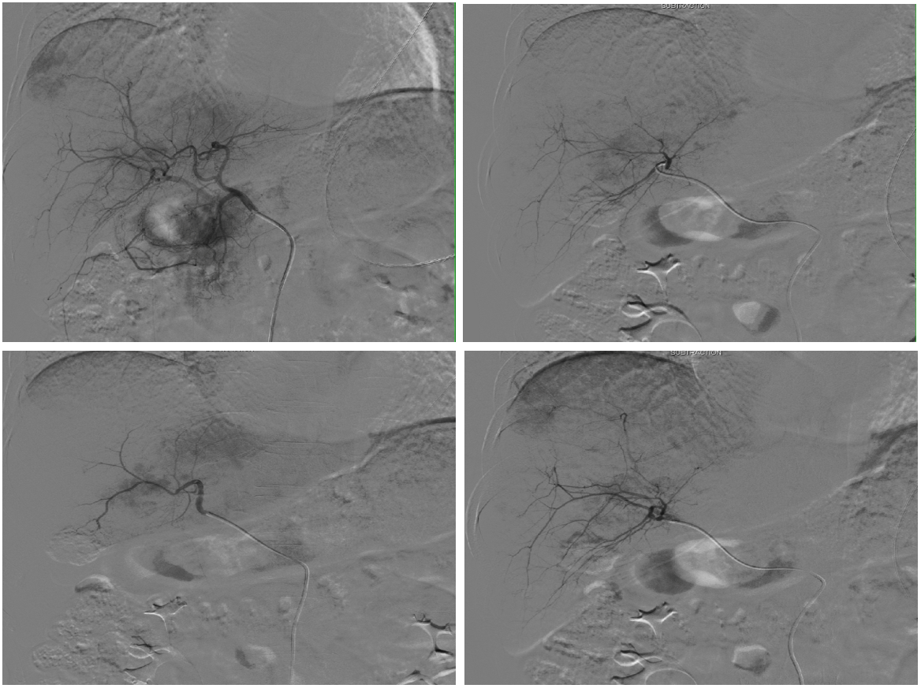
图12. 第2次TAE应用40-120um栓塞微粒
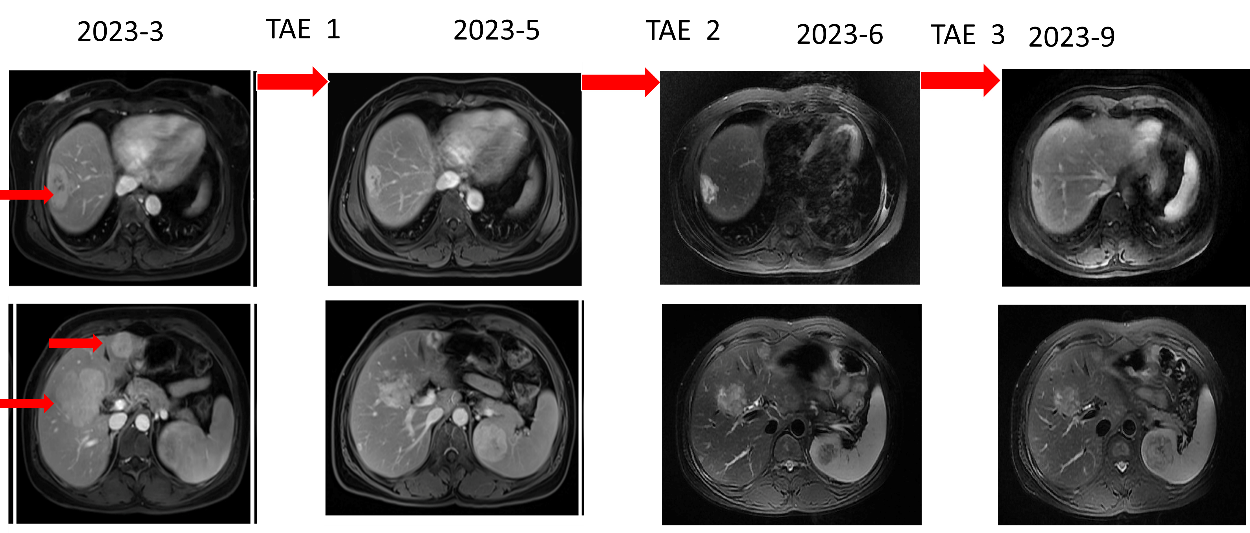
图13. 三次TAE前后对比
病例小结
该患者为1型胃NET中少见的G2级,并肝转移G1级,肝转移灶较原发灶恶性程度更高。经全身奥曲肽微球与局部TAE治疗后,复查病灶持续缩小。
病例点评
医学博士,主任医师,硕士研究生导师
青岛大学附属医院消化肿瘤诊治中心副主任
中国临床肿瘤学会理事
中国抗癌协会神经内分泌肿瘤专业委员会常委
中国医促会消化肿瘤综合诊疗学分会常委
中国临床肿瘤学会胃肠间质瘤专家委员会委员
中国临床肿瘤学会神经内分泌肿瘤专家委员会委员
中国临床肿瘤学会智慧医疗、患者教育专家委员会委员
山东省医师协会神经内分泌肿瘤专业委员副主任委员
山东省疼痛医学会化疗专业委员会副主任委员
山东省研究型医院协会肿瘤精准治疗分会副主任委员
山东省医师协会肿瘤精准医疗分会常委
山东省抗癌协会生物治疗分会常委
山东省抗癌协会消化道肿瘤专委会常委
山东免疫学会肿瘤分子标志物与靶向治疗专业委员会常委
青岛市医学会精准医学分会主任委员
NET可起源于全身各处,以肺、胃、肠、胰最为常见。胃神经内分泌瘤的临床分型是决定治疗和判断预后的重要因素。I型胃神经内分泌肿瘤患者高胃泌素血症伴胃酸缺乏,主要病因是自身免疫性萎缩性胃炎,胃壁细胞破坏和胃酸缺乏或低下,负反馈引起胃窦 G 细胞增生,此型多见。病理分级绝大多数为G1级,I型胃NET出现远处转移几率低,约1-3%。5年生存率100%。II型胃神经内分泌肿瘤特点是患者高胃泌素血症伴胃酸过多,病因为十二指肠或胰腺部位胃泌素瘤,肿瘤性分泌引起的高胃泌素血症,该型继发于胃泌素瘤。II型非常罕见。III型胃神经内分泌瘤是胃泌素非依赖性的肿瘤,无相关背景疾病,胃内肿瘤多为单发病灶。
功能性NET可分泌5-羟色胺等血管活性激素而导致患者出现突发性或持续性头面部、躯干部皮肤潮红,本病例患者餐后颜面及双手潮红为功能性胃NET典型症状。I型胃神经内分泌肿瘤常见于女性,多为非功能性,无特殊临床症状,往往由于消化不良,缺铁性贫血被发现。I型胃神经内分泌肿瘤胃镜检查发现胃部多发、小的、息肉样病灶,内镜下切除治疗联合随访最为常用。对于最大病灶<1 cm 的患者,ENETS 推荐定期胃镜随访及切除。但部分专家建议内镜下病灶尽量切除。对于最大病灶≥1 cm 的患者,先行超声内镜检查,评估肿瘤侵犯深度,根据评估情况选择内镜下切除或外科手术。当肿瘤较大,侵及肌层或有淋巴结转移时,需行外科手术。因胃内复发常见,因此内镜下无论是切除所有可见病灶还是选择性切除较大病灶,均需定期(6~12 个月)复查胃镜,如发现大的病灶再次予以切除。针对反复复发的I型患者,可使用生长抑素类似物。生长抑素类似物因具有抑制胃泌素和抑制肿瘤增殖的双重作用,可选择性地用于多发性、小病灶、无法切除和反复复发的病例,可使肿瘤退缩、减少复发,但并不推荐用于所有早期患者。Netazepide是一种用于I型胃神经内分泌肿瘤的新型靶向治疗药物,可与胃泌素/胆囊收缩素2受体结合,减少肿瘤数量、最大直径及循环血液CgA,治疗应持续进行,因停药后可复发,但仍需前瞻性研究加以验证 。I型神经内分泌肿瘤患者多数伴有消化不良的症状,可给予中药治疗,不仅可以改善症状,还有减少肿瘤复发。神经内分泌肿瘤肝转移常见,能手术切除者手术治疗。国内外指南一致推荐,无法通过手术切除的肿瘤可行介入治疗。介入治疗是神经内分泌肿瘤肝转移重要的治疗手段,推荐使用小粒径空白微球。对于无法手术切除的肿瘤可以通过SSA等生物制剂、靶向药物、介入治疗,控制肝转移病变发展,达到长期生存。
生长抑素类似物与天然生长抑素相似,除可控制激素分泌引起的各种临床症状外,还可结合生长抑素受体发挥抗肿瘤增殖作用。PROMID研究中[2],长效奥曲肽对比安慰剂可有效延长中肠NETs患者的中位至进展时间(TTP)(14.3个月 vs. 6.0个月,P<0.001),显示了对于分化良好的转移性NETs的TTP改善。在一项单中心回顾性研究中,对682例分化良好的晚期GEP-NET患者分析后显示,SSA单药治疗是晚期胃肠胰腺神经内分泌肿瘤常用的一线治疗方案[3]。此外,类似的SSA也在另一项CLARINET研究中显示对比安慰剂的无进展生存期(PFS)改善[4]。本病例患者接受长效奥曲肽微球治疗后,临床症状便迅速得到缓解,验证了SSA在NET症状改善中的显著疗效。此外结合TAE局部治疗,肝转移瘤明显缩小,病情稳定后考虑在MDT指导下考虑外科手术。
[1] Fraenkel M, et al. Incidence of gastroenteropancreatic neuroendocrine tumours: a systematic review of the literature[J]. Endocr Relat Cancer, 2014, 21(3):R153-R163.
[2] Rinka A, et al. Placebo-controlled, double-blind,prospective,randomized study on the effect of octreotide LAR in che control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol, 2009,27(28):4656-4663.
[3] Jalbert JJ, et al. Treatment patterns and health resource use among patients with metastatic gas troenteropancreatic neuroendocrine tumors treated at a tertiary referral center[J]. Oncologist, 2020, 25(4): 1-7.
[4] Pavel M, et al. ENETS consensus guidelines update for the management of distant metastatic disease of intestinal, pancreatic, bronchial neuroendocrine neoplasms (NEN) and NEN of unknown primary site[J]. Neuroendocrinology, 2016, 103(2): 172-185.
排版编辑:肿瘤资讯-HK











 苏公网安备32059002004080号
苏公网安备32059002004080号


