来源:肿瘤资讯
肝内胆管癌(ICC)患者预后通常较差,近年来发病率一直在上升,几乎没有治疗选择[1]。吉西他滨联合顺铂是晚期胆管癌的一线标准治疗方案,但是疗效有限,中位OS约11.7个月,5年生存率<5%[1, 2]。随着基因组学研究的不断发展,IDH1、FGFR2、BRAF和HER2等逐渐成为ICC患者有希望的治疗靶点[1, 3-5]。
约20%的ICC患者携带FGFR2融合、点突变或缺失性变异,多个选择性小分子FGFR1–3激酶抑制剂已在临床试验中呈现出一定有效性,其中, FDA已批准了FGFR抑制剂(FGFRi)培米替尼(Pemigatinib)和Infiglatinib用于经过标准治疗的FGFR2融合阳性(FGFR2+)ICC患者[6, 7],尽管大多数患者有临床获益(疾病控制率高于80%),然而患者客观缓解率不足50%,部分患者会在6-12月内发生耐药和肿瘤进展[6-8]。
因此,临床上需要制定新的治疗策略,以提高FGFR2+ICC患者初始反应的程度和持续时间,并克服不同的获得性耐药模式。近期,《Cancer Discovery》(IF=39.397)杂志报道了一项研究,利用一系列患者来源的ICC细胞系和患者源性异种移植(PDX)模型来揭示限制FGFR2+ICC中FGFRi疗效的分子机制,并强调了FGFR2和EGFR双重抑制的治疗潜力[9]。
1、FGFR2+ICC患者模型中FGFRi作用机制
研究人员建立了一套FGFR2融合阳性的ICC细胞系,以及患者源性的PDXs,以检测FGFR抑制剂的疗效。在泛FGFR抑制剂 Infigratinib治疗高度敏感的ICC13-7时,细胞增殖受损,细胞周期S期减少,停止用药后细胞增殖迅速恢复,提示FGFR 抑制可引起可逆性生长停滞,而不是诱导衰老或细胞死亡。当Infigratinib 处理4小时后,MEK/ERK活性和mTORC1 活性被消除,在48小时后,mTORC2/AKT通路基本无反应。
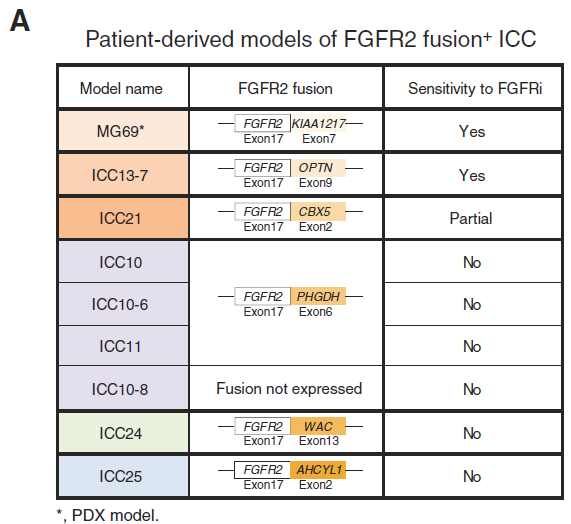
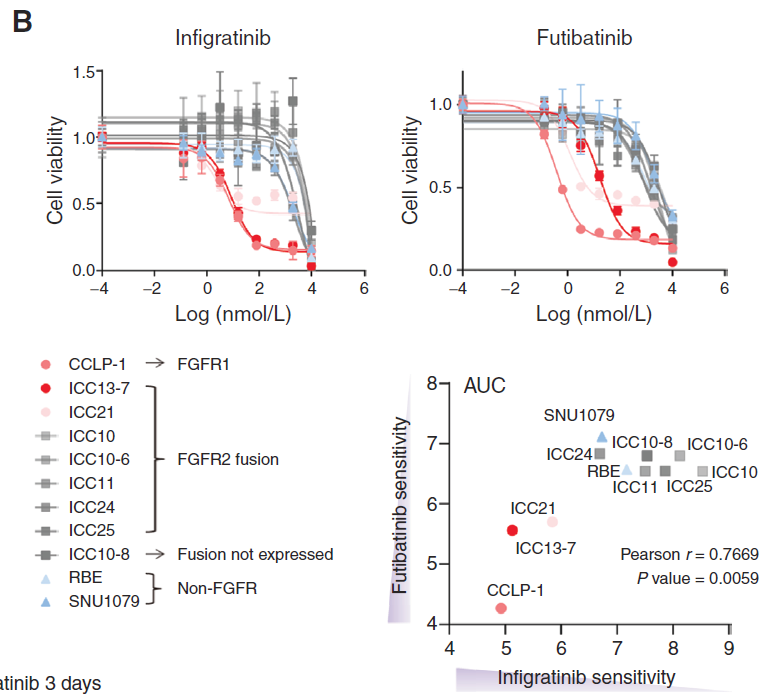
2、高通量药物筛选提示EGFR和FGFR双抑制的潜在增强效果
利用高通量药物筛选平台检测已批准的药物和新研发的化合物分子(共计111个),来识别可以增强FGFRi的靶向小分子化合物。基于分层聚类分析,发现4种野生型EGFR/ERBB家族受体酪氨酸激酶抑制剂(Afatinib、Gefitinib、Lapatinib和EKB-569)在所有FGFR2+ICC中都可以显著增强FGFRi的治疗效果,提示EGFR和FGFR双抑制的潜在增强效果。
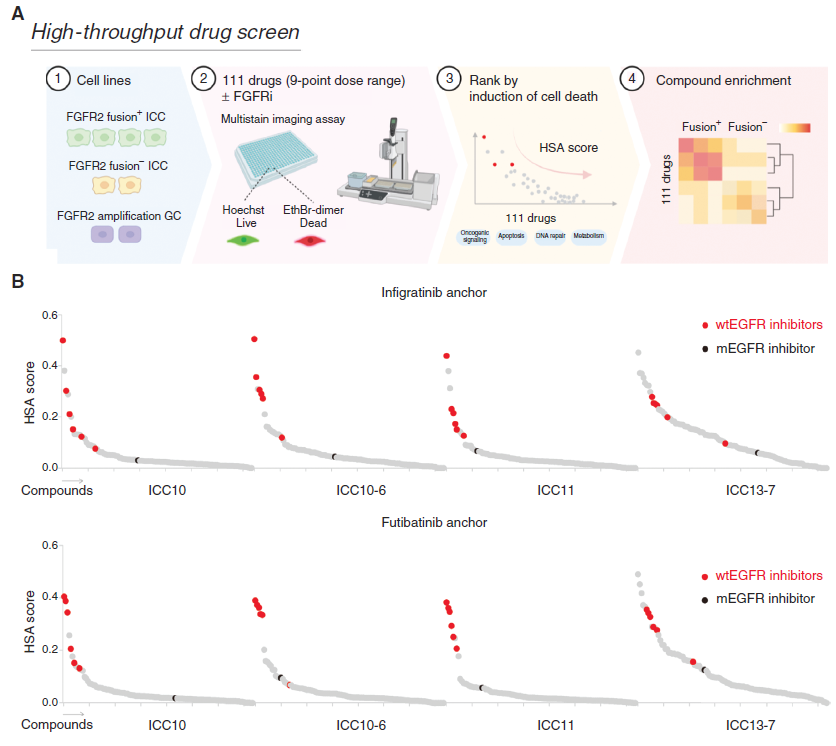
3、FGFR和EGFR双抑制的体内疗效评估
利用细胞系异种移植模型和PDXs模型,将小鼠随机分为联合组、单药组和对照组。结果表明,Infigratinib单药组响应相对敏感,而Afatinib单药组则没有显著变化。在Infigratinib/Afatinib联合治疗组,肿瘤显著缩小,并且停止治疗2周后,肿瘤依然对恢复联合治疗相对敏感。后续的进一步研究表明,联合治疗肿瘤中Ki67增殖基本消除,信号转导通路分析表明,联合治疗可导致MEK/ERK/mTOR活性更持久的关闭相比于单药治疗。

4、全文总结
利用高通量药物筛选平台、生化分析和体内小鼠模型等研究,揭示FGFR 抑制主要通过引起可逆性生长停滞,而不是诱导衰老或细胞死亡发挥疗效。此外,EGFR/ERBB 抑制剂联合治疗可增强FGFRi抑制作用,克服MEK/ERK和mTOR信号的反弹激活,并诱导细胞凋亡,这些临床前研究数据支持FGFR/EGFR双抑制的治疗策略,值得进一步深入探索,提升FGFRi的临床治疗效果。
约20%的ICC患者携带FGFR2变异,其中,FGFR2融合是最有希望的治疗靶点,目前FDA已先后批准培米替尼和Infiglatinib用于经过标准治疗的FGFR2融合阳性(FGFR2+)ICC患者[6, 7]。对于胆管癌尤其是肝内胆管癌患者,可以通过基因检测明确肿瘤驱动基因,筛选FGFR2融合的胆管癌患者,更加明确靶向药物的潜在获益,辅助临床医生制定更有效的治疗方案。
[1].Valle JW, Lamarca A, Goyal L, Barriuso J, Zhu AX. New horizons for precision medicine in biliary tract cancers. Cancer Discov 2017;7:943–62.
[2].Valle J, Wasan H, Palmer DH, Cunningham D, Anthoney A, Maraveyas A, et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010;362:1273–81.
[3].Wu Y-M, Su F, Kalyana-Sundaram S, Khazanov N, Ateeq B, Cao X, et al. Identification of targetable FGFR gene fusions in diverse cancers. Cancer Discov 2013;3:636–47.
[4].Arai Y, Totoki Y, Hosoda F, Shirota T, Hama N, Nakamura H, et al. Fibroblast growth factor receptor 2 tyrosine kinase fusions define a unique molecular subtype of cholangiocarcinoma. Hepatology 2014;59:1427–34.
[5].Nakamura H, Arai Y, Totoki Y, Shirota T, Elzawahry A, Kato M, et al. Genomic spectra of biliary tract cancer. Nat Genet 2015;47:1003–10.
[6].Abou-Alfa GK, Sahai V, Hollebecque A, Vaccaro G, Melisi D, Al-Rajabi R, et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol 2020;21:671–84.
[7].Javle M, Lowery M, Shroff RT, Weiss KH, Springfeld C, Borad MJ, et al. Phase II study of BGJ398 in patients with FGFR-altered advanced cholangiocarcinoma. J Clin Oncol 2018;36:276–82.
[8].Goyal L, Saha SK, Liu LY, Siravegna G, Leshchiner I, Ahronian LG, et al. Polyclonal secondary FGFR2 mutations drive acquired resistance to FGFR inhibition in patients with FGFR2 fusion–positive cholangiocarcinoma. Cancer Discov 2017;7:252–63.
[9].Wu Q, Zhen Y, Shi L, et al. EGFR Inhibition Potentiates FGFR Inhibitor Therapy and Overcomes Resistance in FGFR2 Fusion-Positive Cholangiocarcinoma [published online ahead of print, 2022 Apr 14]. Cancer Discov. 2022;OF1-OF18.















 苏公网安备32059002004080号
苏公网安备32059002004080号


