胆道肿瘤(BTC)是一组发生于胆道系统的恶性肿瘤,约占所有消化系肿瘤的3%,侵袭力强,5年存活率低于5%,大部分患者发现时已为晚期,失去手术机会[1]。转移性胆道肿瘤患者的全身治疗通常需要吉西他滨联合铂类作为一线治疗,然而当一线治疗进展后,除了积极的症状控制之外,其他治疗选择非常有限[1]。有文章报道,二线化疗方案的平均缓解率为7.7%,且具有明显的毒性和不显著的生存优势[2, 3]。
胆道肿瘤在临床和遗传方面具有高度的异质性,基因和分子图谱展示了潜在的靶向分子变异,包括HER2基因的改变[1]。在胆囊癌、肝外胆管癌、壶腹部肿瘤和肝内胆管癌患者中,分别有19%、17%、13%和5%的患者携带HER2基因扩增或过表达[4]。
以HER2为核心靶点的治疗方案,如帕妥珠单抗联合曲妥珠单抗,改善了一些其他肿瘤患者的预后,如乳腺癌、胃癌和胃食道癌等[5-7]。在一些关于HER2靶向治疗胆道肿瘤的一些小型临床试验、回顾性研究和病例报告中,该联合方案呈现出一定的治疗活性[8-9]。在MyPathway Ⅱa期临床研究中,HER2扩增、过表达或两者兼具的转移性胆道癌患者使用双重抗HER2方案(帕妥珠单抗联合曲妥珠单抗),呈现出较好的治疗疗效和耐受性[10]。
Mypathway是一项非随机、多中心、开放标签、Ⅱa期、多重篮式临床试验,主要用于评估美国食品药品监督管理局(FDA)批准的治疗具有潜在可操作分子改变的非适应症肿瘤的活性。此次研究中,对携带HER2扩增、过表达并同时接受双重抗HER2方案(帕妥珠单抗联合曲妥珠单抗)的转移性胆道癌患者进行了分析[10]。
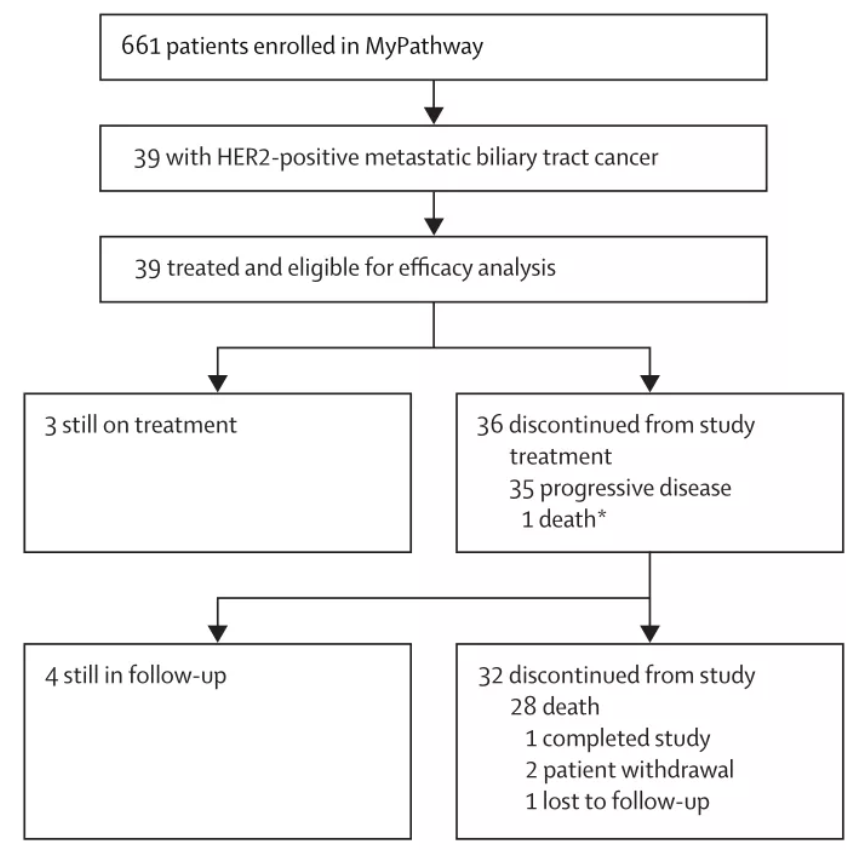
共纳入39例既往接受过治疗的HER2阳性(扩增或过表达)的转移性胆道癌患者,并同时接受双重抗HER2方案(帕妥珠单抗联合曲妥珠单抗,简称“双妥”方案)的治疗,中位随访时间为8.1月。结果表明,9例患者达到部分缓解(PR),客观缓解率(ORR)为23%,11例患者达到疾病稳定(SD)且生存时间超过4个月,整体上接受“双妥”治疗方案的胆道肿瘤患者有20例获得了疾病控制,比例达到51%。
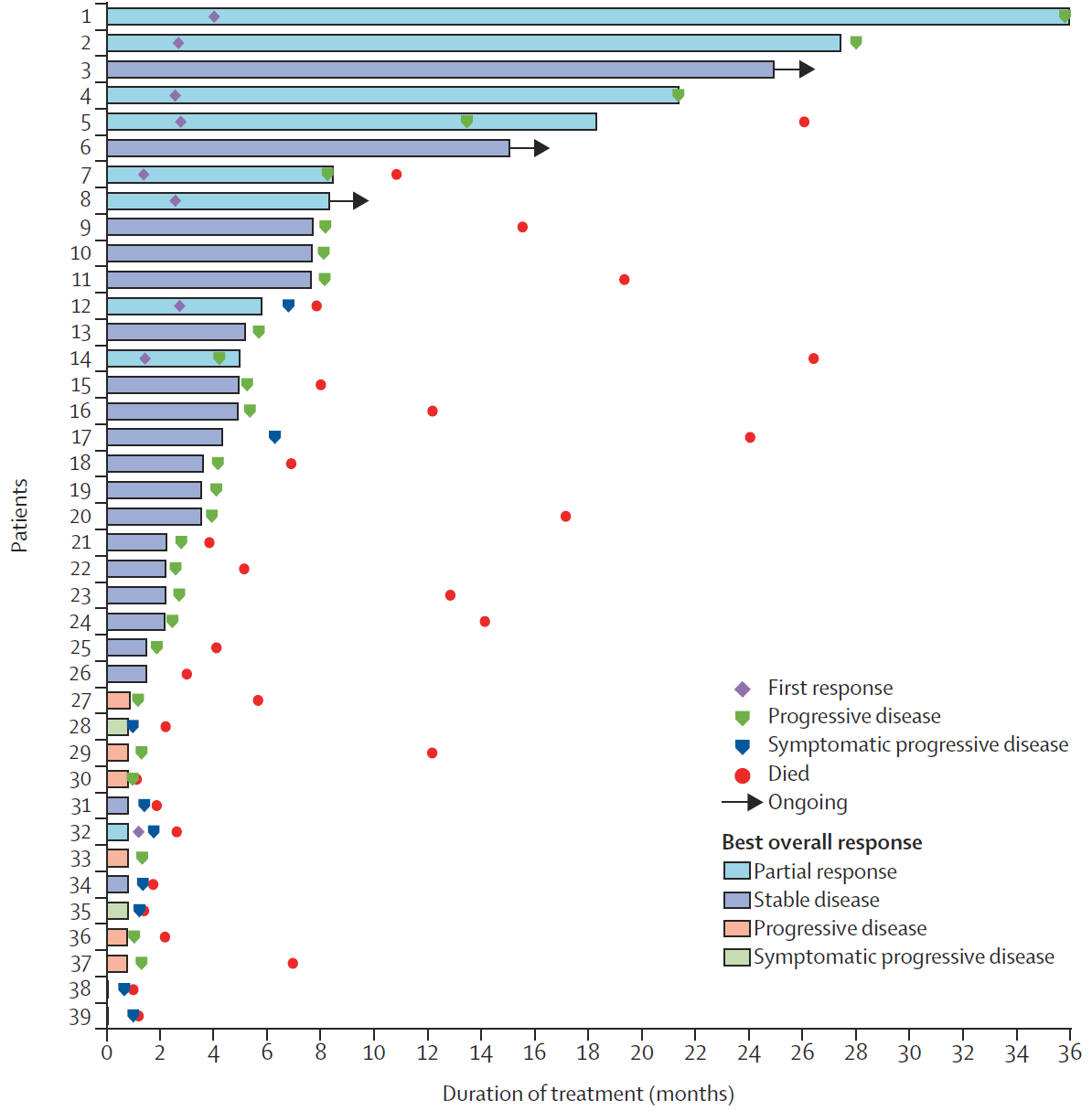
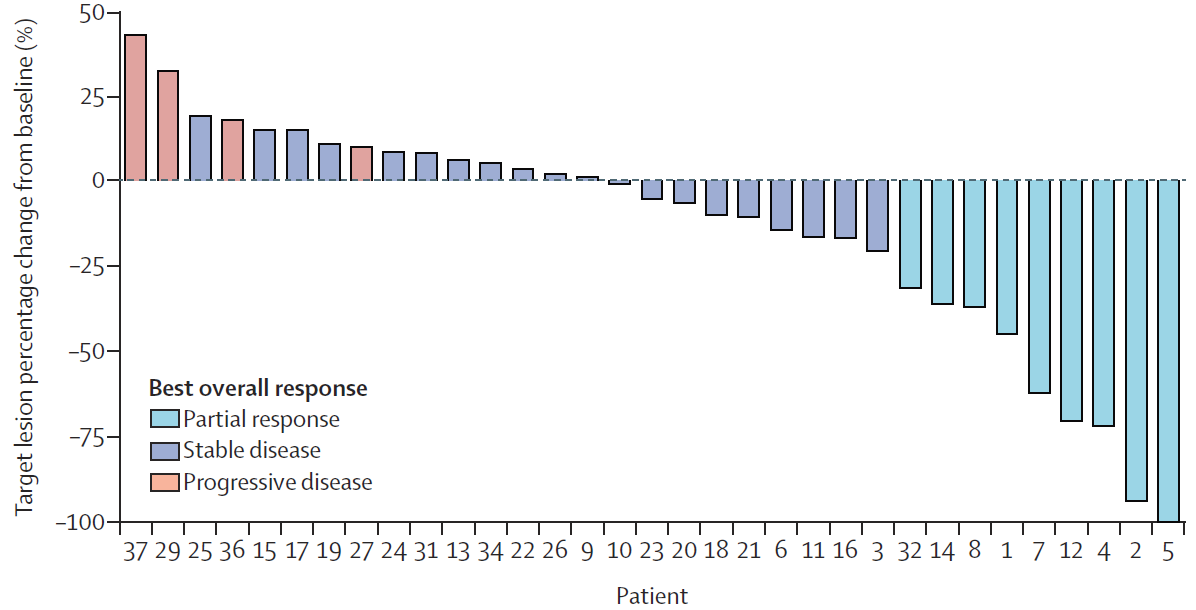
截止至2020年3月,共有36例(92%)患者发生疾病进展,并有29例(74%)死亡,患者1年的总生存率约为50%。在不同肿瘤原发位置的亚组分析中(肝内胆管、肝外胆管、胆囊癌、壶腹部和其他),各个亚组患者的无进展生存(PFS)和总生存(OS)没有呈现显著性差异。整体上,所有患者中位PFS和中位OS分别为4个月和10.9个月。
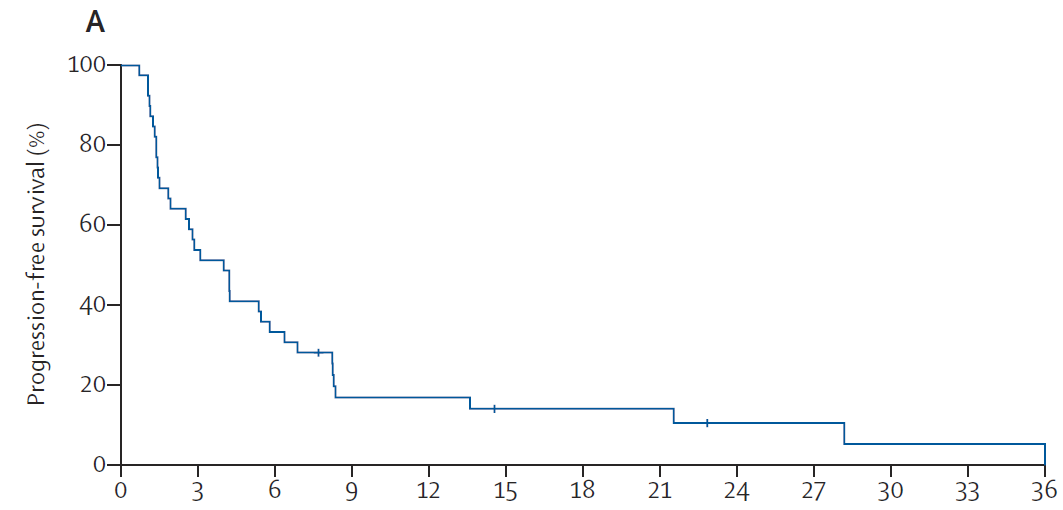
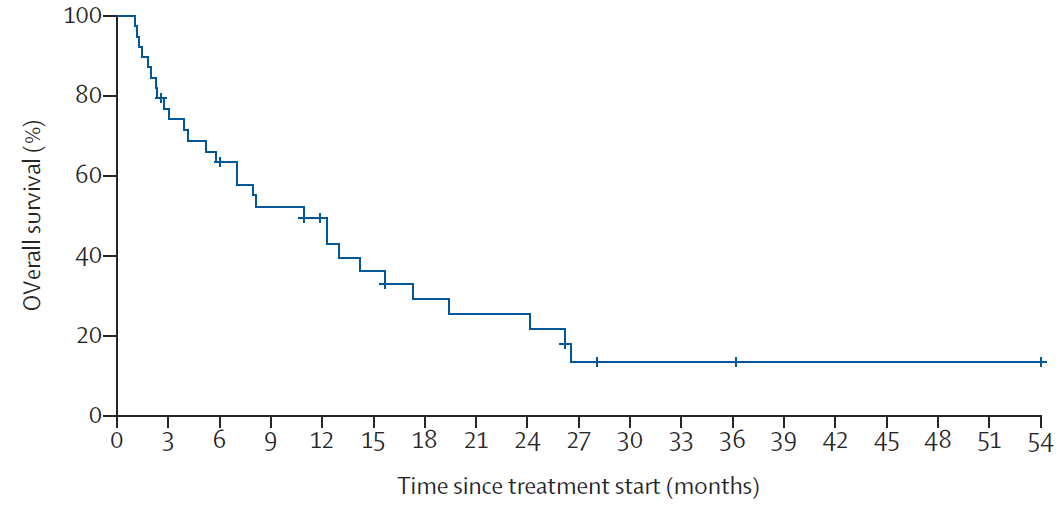
此次Mypathway研究证实,针对既往接受过治疗的HER2阳性(扩增或过表达)的转移性胆道癌患者,双重抗HER2方案(帕妥珠单抗联合曲妥珠单抗)呈现出较好的治疗疗效和耐受性,更大型的随机对照临床试验有望进一步开展,为胆道肿瘤患者的后线治疗提供更多的潜在获益。
[1].Valle JW , Lamarca A, Goyal L, Barriuso J, Zhu AX. New horizons for precision medicine in biliary tract cancers. Cancer Discov 2017; 7: 943–62.
[2].Lamarca A, Hubner RA, David Ryder W , Valle JW . Second-line chemotherapy in advanced biliary cancer: a systematic review. Ann Oncol 2014; 25: 2328–38.
[3].Lamarca A, Palmer DH, Wasan HS, et al. Second-line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open-label, randomised, controlled trial. Lancet Oncol 202; published online March 30.
[4].Hechtman JF, Liu W , Sadowska J, et al. Sequencing of 279 cancer genes in ampullary carcinoma reveals trends relating to histologic subtypes and frequent amplification and overexpression of ERBB2 (HER2). Mod Pathol 2015; 28: 1123-29.
[5].Swain SM, Baselga J, Kim SB, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015; 372: 724–34.
[6].von Minckwitz G, Procter M, de Azambuja E, et al. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer. N Engl J Med 2017; 377: 122–31.
[7].Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376: 687–97 .
[8].Hyman DM, Piha-Paul SA, Won H, et al. HER kinase inhibition in patients with HER2- and HER3-mutant cancers. Nature 2018; 554: 189–94.
[9].Mondaca S, Razavi P, Xu C, et al. Genomic characterization of ERBB2-driven biliary cancer and a case of response to ado-trastuzumab emtansine. JCO Precis Oncol 2019; 3: PO.19.00223
[10].Javle M, Borad MJ, Azad NS, et al. Pertuzumab and trastuzumab for HER2-positive, metastatic biliary tract cancer (MyPathway): a multicentre, open-label, phase 2a, multiple basket study. Lancet Oncol. 2021;22(9):1290-1300.
















 苏公网安备32059002004080号
苏公网安备32059002004080号


