ALK TKI作为携带ALK融合非小细胞肺癌(NSCLC)患者的标准治疗方案,极大的提高了患者的远期生存,ALK也因此被称为“黄金突变”。近年来,在ALK TKI的临床应用市场中,持续涌现出新的ALK TKI抑制剂,将一个又一个“精兵猛将”输送到ALK融合突变的战场上,为了更长的临床获益发起一波又一波的猛攻。但是在靶向治疗代代升级,不断提高药物疗效,覆盖更广泛的耐药靶点,降低潜在毒副反应的同时,是否在ALK融合NSCLC的治疗领域,可以通过1+1获得大于2的临床获益?【肿瘤资讯】特邀东部战区总医院呼吸内科宋勇教授,带我们纵览ALK TKI的迭代升级之路。

东部战区总医院呼吸与危重症医学科主任
肺癌中心主任
南京大学呼吸病学研究所所长
专业技术三级
中央军委保健委员会会诊专家
南京大学、南方医科大学、第二军医大学、南京医科大学博士研究生导师
解放军医学会呼吸内科专业委员会副主任委员
中华医学会呼吸分会全国委员(中华医学会呼吸分会肺癌学组委员)
江苏省医学会呼吸病分会副主任委员兼肺癌学组组长
南京医学会呼吸分会主任委员
中国临床肿瘤协会(CSCO)理事、中国抗癌协会肺癌专业委员会常委
《Translational Lung Cancer Research》杂志(PubMed、SCI收录)主编
《中华医学杂志》编委
《医学研究生学报》副主编等国内外学术期刊编委等
耐药永远是靶向治疗难以回避的瓶颈。克唑替尼耐药的群体中,约37%归因于ALK继发性耐药。因此,后续药物的开发方向,都试图在提高药物效力的同时,可以克服相关激酶区域突变导致的耐药,从而打破一代药物的瓶颈。塞瑞替尼是第二代ALK抑制剂,2014年仅凭借亮眼的Ⅰ期临床数据,美国食品药品监督管理局(FDA)就批准了塞瑞替尼的上市。接踵而来的阿来替尼,布加替尼,与塞瑞替尼共同组成第二代ALK TKI治疗阵营。在二线治疗取得显著临床疗效的同时,临床证据表明,二代抑制剂用于初治ALK+的患者群体同样获得了优于一代克唑替尼的临床获益。随后,第三代劳拉替尼的问世,在ALK TKI克服耐药、提高疗效的升级之路上,向前又迈进了一步。目前,FDA/EMA批准用于ALK+一线的药物包括克唑替尼、塞瑞替尼、阿来替尼,二代药物布加替尼以及三代劳拉替尼主要批准用于二线及以后。
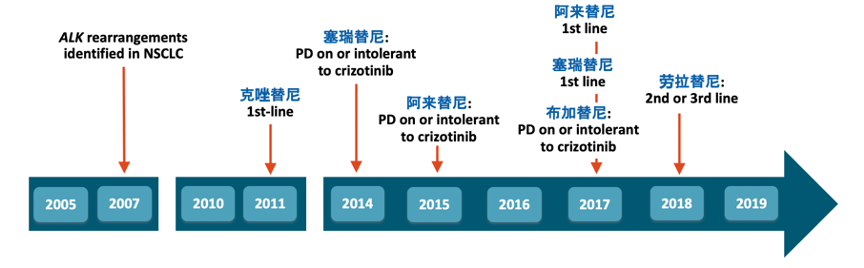
图1 ALK TKI的升级之路
ALK TKI迭代升级中二代疗效的显著提升
二代阵营在一线治疗ALK+肺癌的临床获益方面,显现出了一代无法匹及的优势。对比克唑替尼10.9个月的中位无进展生存时间(mPFS)(图表2),塞瑞替尼及阿来替尼在此基础上翻了一倍,在独立评审委员会评估的ASCEND-4研究亚洲亚组中,塞瑞替尼的mPFS达到了26.3个月,阿来替尼也在其研究中达到了25.7个月。一项来自于台湾的真实世界研究数据表明,塞瑞替尼用药组的mPFS长达45个月。

图2 ALK TKI一线治疗数据汇总
而在既往接受克唑替尼进展后给予二代ALK抑制剂治疗的患者中,塞瑞替尼的mPFS在5.4~9.8个月,而阿来替尼后线治疗可以获得7.1~8.3个月的mPFS获益[1]。后续升级的ALK TKI药物在药效及克服耐药等方面,对比一代克唑替尼的都展现出其独特的治疗优势(图3)。

图3 ALK TKI一线耐药治疗后的疗效对比
此外,值得注意的是,在药物设计方面的升级之外,给药方式剂量等的调整,同样可以带来疗效及毒副反应方面的优化。在Ⅰ期临床试验ASCEND-1研究中确定的750mg空腹给药方案的基础上,后续ASCEND-4以及ASCEND-5分别在一线及后线验证了塞瑞替尼的疗效,但相关胃肠毒性毒副反应发生率较高。而随后ASCEND-8研究,尝试应用450mg随餐服药方式后,中位随访14.3个月后经第三方独立评审机构评估的mPFS仍未达到。同时安全性分析表明,450mg随餐组相比750mg空腹组,胃肠道AE发生率明显下降,严重程度明显更低,主要为1级,极少发生3/4级。塞瑞替尼450mg随餐剂量调整在保证疗效的基础上,大幅降低了毒副反应,实现了给药方案的优化升级(图4)。
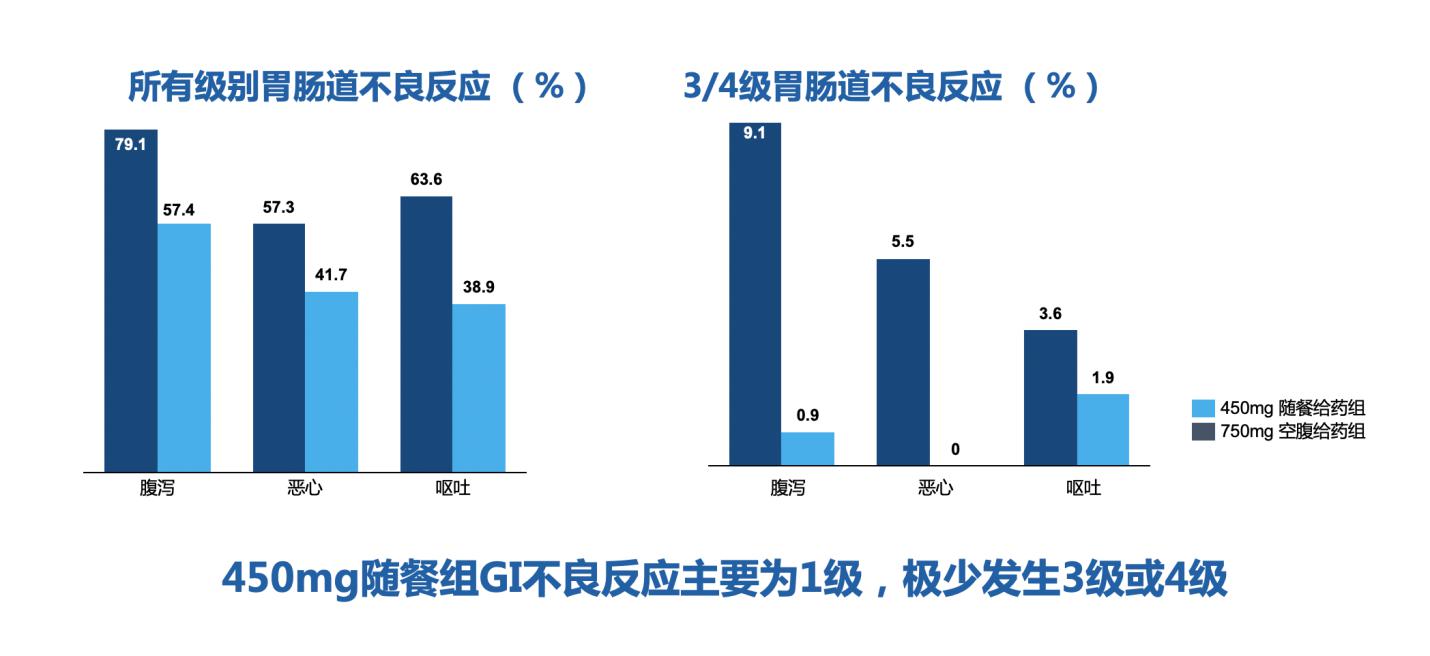
图4 塞瑞替尼不同服药方案的毒副反应对比
迭代升级大背景下,探索联合发展之路
目前,包括EGFR抑制剂和ALK抑制剂在内的肺癌领域的核心靶点药物都在全力推进新一代药物的研发和升级,力求覆盖更广泛的耐药靶点,拥有更强的药物效力,更理想的颅内有效浓度。但我们同时应该认识到,肿瘤本身存在的进化特征及异质性,决定了单一靶点或药物无法最终扭转这场与肿瘤博弈的胜局。而多靶点,化疗联合,免疫治疗联合则为这场战役提供了更多的策略选择。
方向1:研究显示ALK抑制剂能够在进展后与化疗联合持续抑制肿瘤进展
ALK抑制剂进展后如果患者对该药物耐受性良好,是否马上换另外一个TKI,是临床医生面临的另外一个问题。一项回顾性分析,共纳入58例患者ALK阳性晚期NSCLC患者,在塞瑞替尼进展后,分别给予铂类/培美曲塞和PP+TKI治疗,结果表明,使用铂类/培美曲塞联合ALK抑制剂治疗的患者,mPFS更长(mPFS=6.8m vs 3.2m,HR=0.33,P=0.025)[2](图5)。综上,可见化疗联合ALK TKI可以为进展后患者提供可行的治疗选择,进一步延长生存获益。
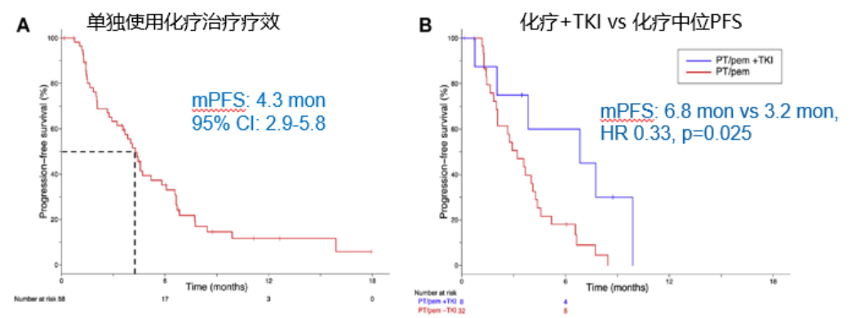
图5 ALK TKI联合化疗有效提高mPFS获益
方向2:ALK联合放疗的可行性
晚期肺癌患者群体中往往合并脑转移。而脑转移在系统治疗方案中,一直是非常棘手的临床问题。于是,系统靶向治疗联合放疗就经常被拿来讨论应用于脑转移患者群体的科学性和可行性。一项研究纳入了ALK阳性同时合并颅内转移(非脑膜转移)的NSCLC患者。克唑替尼联合局部放射治疗(主要为立体定向放疗)的mPFS达到9.0个月。另外一项回顾性研究表明,ALK TKI联合立体定向放疗或全脑放疗治疗的ALK+NSCLC患者,在发生脑转移后依然获得了49.5个月的中位总生存时间[3,4]。此外,一项正在进行的Ⅱ期研究(NCT02513667)拟研究塞瑞替尼联合放疗用于ALK+NSCLC一线或后线治疗中的疗效。
方向3:和靶向药物联合
和MEK抑制剂联合
MAPK通路与NSCLC的发病机理密切相关,而其中MEK是RTK和ALK下游的、共同的关键环节。研究表明,RAS/RAF/MEK/ERK途径是ALK肿瘤细胞存活所必需的关键下游途径,一篇于2015年发表在Nature Medicine的研究表明,KRAS拷贝数增加或MEK异常活化,与ALK抑制剂的耐药相关。研究利用携带ALK-EML4融合基因的肺腺癌模型,证明了ALK+肿瘤细胞存活依赖由GTPase RAS丝裂原激活的蛋白激酶(MAPK)途径(图6)。功能学实验表明,ALK与MEK抑制剂联合可以有效增强初始应答的强度和持续时间。该研究证明RAS-MAPK依赖性为EML4-ALK肺腺癌的生物学特征。该研究也为ALK和MEK联合治疗用于预防耐药,提高疗效提供了理论依据[5]。
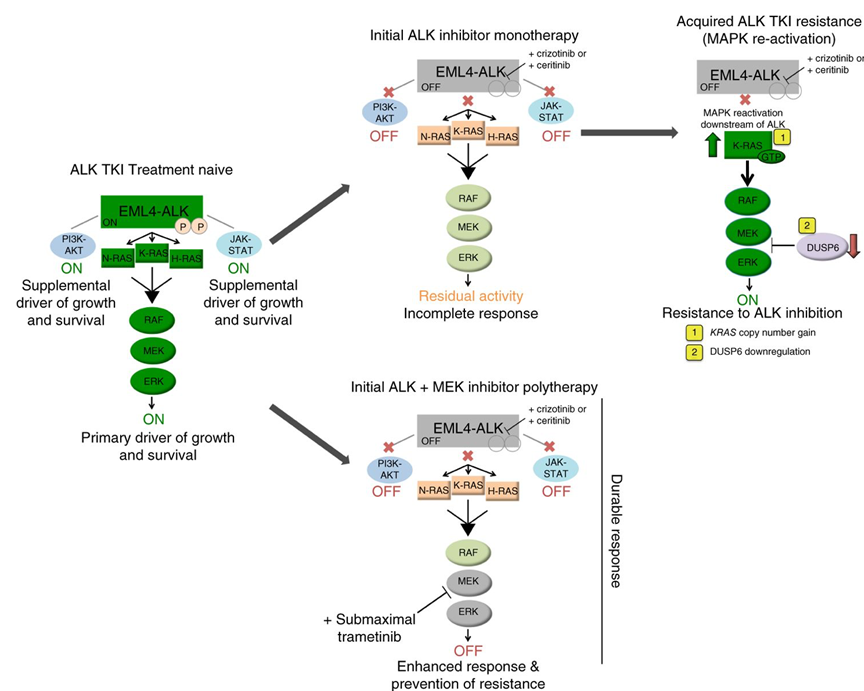
图6 ALK+ MEKi联合治疗提高疗效预防耐药的相关机制
随后另外一项基于PDX模型的临床前研究,给我们带来了更多证据。该研究表明,MEK抑制剂AZD6244与塞瑞替尼联合,在耐药的PDX模型中,具有明显的抗肿瘤增殖作用。提示MEKi可以增敏ALK TKI对ALK+耐药株的杀伤作用[6]。这些证据都提示了一种联合策略的可行性,ALK抑制剂与MEK抑制剂联合,是否可以克服耐药提高疗效,还需更多的临床证据。
和c-MET抑制剂联合
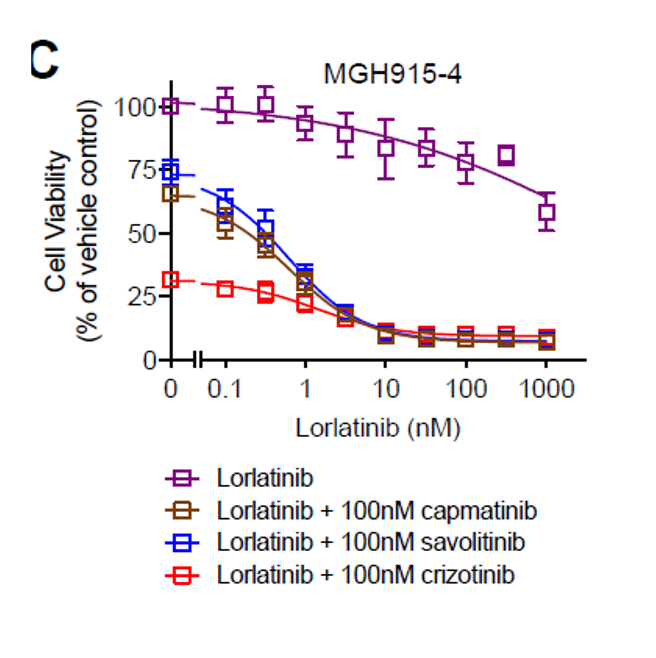
图7 体外实验表明ALK TKI与MET抑制剂具有协同抑制肿瘤的作用
有报道提示,MET激酶结构域重排,可以通过诱导ALK旁路异常激活,从而使得ALK+患者对塞瑞替尼耐药[7]。同时,越来越多的研究表明,MET的异常突变类型,包含MET 14外显子跳跃突变和MET融合均会导致二代或三代ALK TKI耐药,且在ALK TKI耐药的相关机制组成中,仅次于ALK本身继发改变所致的相关耐药。基于此,学者们提出塞瑞替尼等ALK TKI与MET激酶抑制剂存在联合协同作用的可能性,可以通过联合作用提高疗效克服耐药[7,8](图7)。而临床试验初步结果支持了该假设,体外实验显示,ST7-MET 融合导致二代或三代ALK TKI耐药,可以通过ALK TKI联合MET抑制剂克服,联合治疗方案可以显著抑制耐药株的增殖[9]。
其他靶点
当前,其他部分联合治疗策略中,有研究在ALK阳性的NSCLC患者中,尝试联合应用阿来替尼与贝伐珠单抗,用于治疗伴有颅内转移病灶的患者。这种联合策略的主要依据是,贝伐珠单抗的应用可以改善药物在颅内肿瘤的有效治疗浓度,从而间接提高ALK TKI的肿瘤杀伤作用[10]。此外,有研究表明,EGFR旁路途径的异常激活,可能是克唑替尼耐药的一种机制。但是,目前尚缺少临床证据。而临床前数据表明,EGFR TKI联合ALK TKI可以在EGFR异常激活的细胞系中,克服相关机制诱发的ALK TKI耐药,而该研究结果也为EGFR TKI联合ALK TKI用于相关临床场景提供了潜在的可能性[11]。
方向4:和免疫治疗联合
免疫检查点抑制剂的问世,在改变肿瘤治疗格局的同时,也为肿瘤治疗的选择提供了更多可能,目前对于基因突变阴性的肺癌患者,有诸多基于抗PD-1/L1的治疗联合方案和药物。既往有研究表明,PD-L1在肿瘤中的表达与ALK-EML4融合正相关,同时,经过阿来替尼处理或SiRNA干扰ALK后,PD-L1的表达下调。提示,ALK通路可能与PD-L1的表达调控相关[12]。IMpower150研究中[13],纳入131例有EGFR敏感突变(n=91)或ALK重排(n=40)的患者。在EGFR敏感突变亚组分析中,阿替利珠单抗联合贝伐珠单抗加化疗可显著改善PFS,但是没有报道ALK阳性亚组的结果。那么在ALK+ NSCLC患者群体中,ALK TKI与免疫治疗是否有联合协同作用呢?
一项Ⅰb期临床试验探讨了塞瑞替尼与纳武利尤单抗在ALK+NSCLC患者中的疗效及安全性。疗效方面,在既往未接受过ALK TKI治疗的患者中,塞瑞替尼450mg随餐+纳武利尤单抗 3mg/kg的6例患者中,客观缓解率有83.3%;在既往接受过ALK治疗的患者中,客观缓解率为50%(图8)。特别是在亚组分析中,PD-L1高表达组显示出更好的疗效[14]。
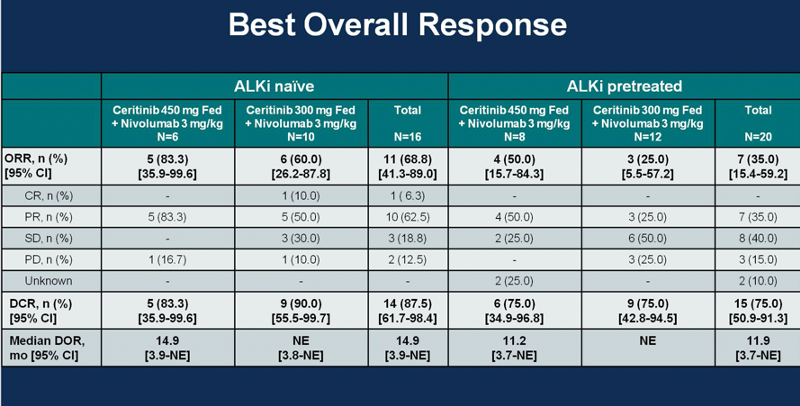
图8 塞瑞替尼联合纳武利尤单抗方案的疗效
在安全性方面,联合治疗方案显著增加了不良反应的发生概率,其中以皮疹为主。提示该联合治疗方案,需谨慎相关不良反应对疗效的影响。一项针对ALK+NSCLC患者研究中(NCT0257408),克唑替尼联合纳武利尤单抗治疗由于较强的肝毒性而提前终止[15,16]。后续研究尚需探讨最适合的用药剂量。
另外目前正在开展的免疫治疗和ALK抑制剂联合应用的相关临床试验包括:克唑替尼联合纳武利尤单抗或伊匹木单抗(NCT01998126);阿来替尼联合阿替利珠单抗(NCT02013219);以及劳拉替尼与Avelumab(NCT02584634)。
小结
ALK TKI作为携带ALK融合NSCLC患者的准治疗方案,极大的提高了患者的远期生存。为了解决耐药,提高疗效,后续不断涌现出的新一代ALK TKI较克唑替尼,均有极大的提高和改善。寻求进一步的疗效获益是我们永远不变的主题。联合治疗的新策略,是非常值得探讨的问题,其他靶向药物以及免疫治疗的相关联合方案,都值得拭目以待。
1. Novello, S. et al. Alectinib versus chemotherapy in crizotinib-pretreated anaplastic lymphoma kinase (ALK)-positive non-small-cell lung cancer: results from the phase III ALUR study. Ann Oncol 29, 1409–1416 (2018).
2. Lin, J. J. et al. Efficacy of Platinum/Pemetrexed Combination Chemotherapy in ALK-Positive NSCLC Refractory to Second-Generation ALK Inhibitors. J Thorac Oncol 15, 258–265 (2020).
3. Johung, K. L. et al. Extended survival and prognostic factors for patients with ALK-rearranged non–small-cell lung cancer and brain metastasis. JCO 34, 123 (2016).
4. Dai, Y. et al. Oncogene addiction and radiation oncology: effect of radiotherapy with photons and carbon ions in ALK-EML4 translocated NSCLC. Radiation Oncology 13, 1 (2018).
5. Hrustanovic, G. et al. RAS-MAPK dependence underlies a rational polytherapy strategy in EML4-ALK–positive lung cancer. Nature Medicine 21, 1038–1047 (2015).
6. Crystal, A. S. et al. Patient-derived models of acquired resistance can identify effective drug combinations for cancer. Science 346, 1480–1486 (2014).
7. Plenker, D. et al. Structural Alterations of MET Trigger Response to MET Kinase Inhibition in Lung Adenocarcinoma Patients. Clin Cancer Res 24, 1337–1343 (2018).
8. Lara, M. S. et al. Preclinical Evaluation of MET Inhibitor INC-280 With or Without the Epidermal Growth Factor Receptor Inhibitor Erlotinib in Non-Small-Cell Lung Cancer. Clinical Lung Cancer 18, 281–285 (2017).
9. Dagogo-Jack, I. et al. MET Alterations are a Recurring and Actionable Resistance Mechanism in ALK-Positive Lung Cancer. Clin Cancer Res (2020). doi:10.1158/1078-0432.CCR-19-3906
10. Martinengo, C. et al. ALK-Dependent Control of Hypoxia-Inducible Factors Mediates Tumor Growth and Metastasis. Cancer Research 74, 6094–6106 (2014).
11. Miyawaki, M. et al. Overcoming EGFR Bypass Signal-Induced Acquired Resistance to ALK Tyrosine Kinase Inhibitors in ALK-Translocated Lung Cancer. Mol Cancer Res 15, 106–114 (2017).
12. Ota, K. et al. Induction of PD-L1 Expression by the EML4-ALK Oncoprotein and Downstream Signaling Pathways in Non-Small Cell Lung Cancer. Clin Cancer Res 21, 4014–4021 (2015).
13. Socinski, M. A. et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC. N Engl J Med 378, 2288–2301 (2018).
14. Enriqueta Felip, M. D. et al. Ceritinib plus nivolumab in patients with advanced ALK-rearranged non-small-cell lung cancer: results of an open-label, multicenter, phase 1B study. Journal of Thoracic Oncology 1–37 (2019). doi:10.1016/j.jtho.2019.10.006
15. Felip, E. et al. Ceritinib plus nivolumab (NIVO) in patients (pts) with anaplastic lymphoma kinase positive (ALK+) advanced non-small cell lung cancer (NSCLC). (2017).
16. Felip, E. et al. Ceritinib plus Nivolumab in Patients with Advanced ALK-Rearranged Non–Small Cell Lung Cancer: Results of an Open-Label, Multicenter, Phase 1B Study. Journal of Thoracic Oncology 15, 392–403 (2020).
MCC号ZYK2201859有效期2023-01-12,资料过期,视同作废。
前期回顾:
【医诺学院】刘晓晴教授点评:Less is more! 塞瑞替尼剂量调整的前世今生
排版编辑:Mice














 苏公网安备32059002004080号
苏公网安备32059002004080号


