原发性肝癌,主要类型为肝细胞癌(HCC),是全球常见病,在我国尤其高发,严重威胁人类生命健康,广受重视。2019年,HCC免疫治疗的临床研究可谓“雾里看花,扑朔迷离”。先是在美国临床肿瘤学会(ASCO)年会上公布CHECKMATE 459 和KEYNOTE-240Ⅲ期验证性临床研究,即单用免疫检查点抑制剂纳武利尤单抗一线或帕博利珠单抗二线治疗晚期HCC的最终结果,均为失败;后来又分别在欧洲肿瘤内科学会(ESMO)大会和ESMO-亚洲会议上,公布了帕博利珠单抗联合抗血管生成药物仑伐替尼的KEYNOTE-524/Study 116开放标签单臂Ⅰb期临床研究,阿替利珠单抗联合贝伐珠单抗一线治疗HCC的IMbrave-150 III期研究结果,还有在中国临床肿瘤学会(CSCO)年会上公布了卡瑞利珠单抗二线治疗HCC大样本的Ⅱ期临床研究数据,全为阳性。这些研究的结果,真正是“大起大落,喜忧参半”。尽管如此,继免疫治疗在局部晚期和转移性非小细胞肺癌等的治疗中大放异彩之后,我们再次看到基于PD-1/PD-L1单抗的系统治疗已经成为攻克“癌中之王”的一把利器,必将为2020年全球和中国肝癌治疗的临床实践带来巨大的变革。

解放军东部战区总医院全军肿瘤中心主任
中国临床肿瘤学会(CSCO)副理事长
北京希思科临床肿瘤学研究基金会理事长
国家卫健委肝癌专家组组长
中国抗癌协会癌症康复与姑息治疗专委会主任委员
全军医科委理事兼肿瘤专委会副主任委员
2020年初,CSCO副理事长兼肝癌专家委员会主任委员、解放军东部战区总医院全军肿瘤中心秦叔逵教授在“大默无限 - 默沙东肿瘤高峰论坛”上,就2019年免疫治疗HCC重要研究的进展进行了上述点评,深入浅出地阐述了有关研究结果对于2020年及未来的HCC临床实践的重要意义。记者记录了部分内容,在此发表以飨读者。
PD -1单抗单药治疗HCC的临床研究结果带来了什么启示?
秦叔逵教授: CHECKMATE 040和KEYNOTE-224两项研究,开启了免疫检查点抑制剂治疗HCC的新时代。
2017年9月23日美国FDA依据CHECKMATE 040研究结果,有条件地批准了纳武利尤单抗二线治疗晚期HCC。时隔1年多,2018年11月9日,又依据KEYNOTE-224研究结果,有条件地批准了帕博利珠单抗二线治疗晚期HCC。而后,在2019年两项确证性Ⅲ期临床研究CHECKMATE 459和KEYNOTE-240研究结果相继公布。
KEYNOTE-240研究是评估帕博利珠单抗联合最佳支持治疗(BSC)二线治疗经索拉非尼治疗失败进展的晚期HCC的有效性和安全性。参考先前的KEYNOTE-224单臂研究结果,业界曾经普遍认为KEYNOTE-240研究毫无疑问必将获得成功,但结果大跌眼镜,居然是一个阴性结果。实际上,帕博利珠单抗已显示了总生存(OS)获益,中位OS达到13.9个月,比安慰剂对照组延长了3.3个月,可是这种差异没有达到预设的统计学显著性。究其原因,主要是由于轻敌大意,试验设计上存在明显的缺陷。
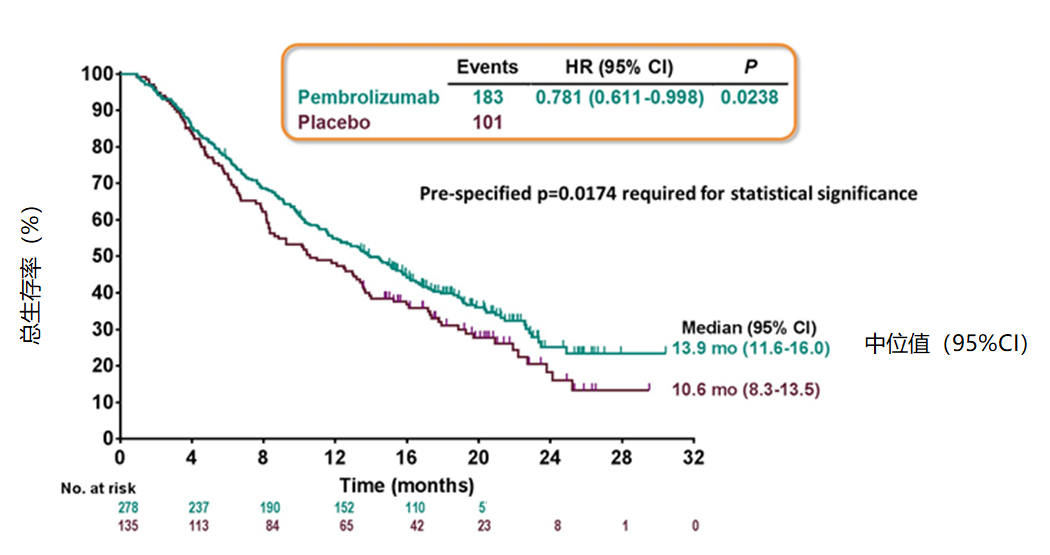
2019年ASCO大会公布的KEYNOTE-240研究中的OS曲线图
比如,首先是该研究的设计者并不了解肝癌的特殊性,统计学设计上有瑕疵。KEYNOTE-240研究完全是生搬硬套肺癌的临床试验模式,设立了OS和无进展生存期(PFS)双主要终点,分散α值且分配不当,还进行了2次中期分析,白白消耗了一些α值;其次,研究设计者盲目自信,对两组可能的差异和阳性结果期望值过高,为了加快研究进程和省钱,样本量区区仅有403例;再者,没有考虑到已经问世的多个创新型抗肿瘤药物可用于治疗HCC,也没有考虑到受试者后续还可能接受其他PD-1/PD-L1单抗,或者参与其他的临床研究;没有去设法控制和预设敏感性分析,并且事先与FDA有效沟通,等等。这些因素都对主要终点数据产生干扰,不利影响很大。
CHECKMATE 459则是一项纳武利尤单抗与索拉非尼一线治疗肝癌头对头比较的Ⅲ期研究,也没有获得预期的结果。同样,初期想当然地设立了OS和总的客观有效率(ORR)为双主要终点,直到中期分析时才去纠正,可惜为时已晚,白白消耗了一点α值;也没有充分考虑到已有多个抗肿瘤创新药问世可用于治疗HCC,更没有考虑到受试者一线治疗进展后可能接受其他PD-1/PD-L1单抗进行二、三线治疗,或参与其他的临床研究,没有预设的敏感性分析等,结果就差了那么一点(预设的HR为0.84,结果是0.85),真可谓“差之毫厘,失之千里”。
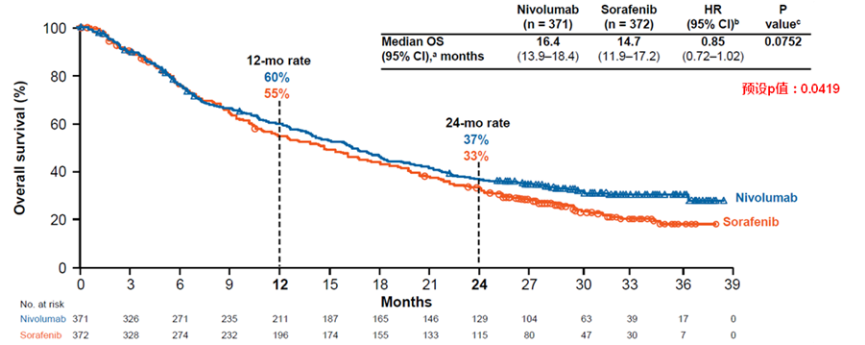
2019年ESMO大会公布的Checkmate 459研究中的OS曲线图
此外,在这两项国际多中心研究中,非病毒感染相关的肝癌患者都超过40%以上,这也是这两个研究没有成功的一个重要原因。
总体而言,这两项研究的设计者对于肝癌诊断、治疗和研究的复杂性都认识不足,缺乏相应的经验,在设计上过于激进和草率,没有认真听取临床专家的意见,因此,只能是折戟沉沙。但全面评估和仔细分析,采用PD-1单抗免疫治疗HCC还是具有重要的临床价值的。
目前,常常有肝癌患者前来询问是否还能使用PD-1单抗进行治疗?我们的回答是虽然上述两项Ⅲ期研究没有达到预期的结果,但是可以看到,PD-1单抗治疗可以明显地提高客观有效率,并且有生存获益的趋势,只是由于该研究设计上有问题、期望值过高以及后续治疗的干扰等,才造成如此的阴性结果;结合新的研究进展和临床经验,不必因噎废食,还是可以酌情考虑采取PD-1/PD-L1单抗为主的联合治疗。
我国HCC患者与欧美人群存在许多不同,在我国进行肝癌临床研究的设计和实施时,是否需要根据国情“量体裁衣”?
秦叔逵教授:亚洲的肝癌,特别是中国的肝癌,与欧美国家的肝癌存在着许多的差异,包括发病病因、流行病学特点、分子生物学行为、临床表现和分期、治疗策略与方法,特别是预后的不同,即所谓的高度的异质性。比如,在我国,不能做手术或者介入等局部治疗的晚期HCC患者,如果仅仅采取支持对症治疗,自然的生存期平均只有3~4个月,而在欧美,则在9~11个月之久。还有,我国的HCC大多数都是乙型肝炎病毒感染引起的;而欧美的HCC过去多与丙型肝炎感染有关,现今则与非病毒感染因素(包括酒精性肝病和非酒精性肝病)密切相关,而后一类晚期HCC患者对于免疫治疗不敏感,疗效比较差。
因此,我国的肝癌研究和治疗不能照搬照抄国外的那一套,必须结合国情,病情和药物遗传学等进行改良。比如,在日常诊疗和临床研究时,都要高度重视基础肝病(包括病毒性肝炎、肝硬化、肝功能异常和相关并发症),进行有效的全程管控。 而在设计临床研究时,也不能照抄欧美的方案。在以亚洲(主要是中国)HCC患者为主的KEYNOTE-394 Ⅲ期临床研究设计时,我们就充分地考虑了国情、疾病和人种等方面的差异,积极吸取既往研究的经验和教训,与KEYNOTE-240研究具有许多的不同。比如,我们只设立了OS作为单个主要终点,而没有设立PFS或者ORR作为共同主要终点。这是因为在肝癌过去的研究中,PFS和ORR,并不像在肺癌、乳腺癌研究中那样与OS获益密切相关,只有在PFS风险因子(HR值)降到0.60以下的时候,HCC的中位PFS才与中位OS具有较好的相关性;而ORR,虽然可以有所提高,但有的时候不能转化为生存获益。所以在KEYNOTE-394研究当中,我们更加重视OS的延长。由于中国的肝癌比较复杂,不但要考虑积极治疗肿瘤,还要考虑管理基础肝病,还要考虑到它们之间的相互影响,所以需要对研究中所设立的具有统计学意义的阀值有一个正确合理的认识,并且要很好地去控制其他相关因素。
此外,还要充分考虑到患者的治疗依从性问题。在欧美国家,医患之间的信任度较高,患者能够较好地遵守医嘱,所以在后续治疗当中,患者也会很好地参考医生的意见,不去使用没有适应证的药物,而许多中国患者则有病急乱投医的倾向,或者喜欢自作主张。在经过一线或二线治疗进展后,患者往往会自行选择用一些其他药物,包括中草药、抗肿瘤靶向药物和免疫治疗药物,或者去参加其他临床试验。虽然我们能够理解患者这种迫切求生的愿望,但是这些对于后续研究结果及其分析干扰也是非常大的,必须事先考虑周全,想好如何应对。所以,在KEYNOTE-394的研究设计上,我们规避了KEYNOTE-240研究中的多项缺点,期待获得一个阳性结果。总之,在中国设计和开展肝癌临床研究时,一方面要向西方国家学者认真学习,包括肝癌、肺癌、黑色素瘤和淋巴瘤等其他瘤种,采取免疫治疗获得的成功经验和失败的教训,同时,必须也要充分考虑到中国的国情以及肝癌的复杂性等,创新设计,加强质控。
KEYNOTE-394研究正在进行,其结果对于PD-1单抗二线治疗HCC意义重大,当前的进展如何?
秦叔逵教授:如前所述,KEYNOTE-394研究是二线治疗HCC的亚太区国际多中心Ⅲ期研究,特别以中国患者入组为主,在设计主要研究终点时,没有像KEYNOTE-240研究那样采用双终点,只设了OS一个作为终点。另外,在KEYNOTE-240研究时,预设具有统计学意义的OS值是比较激进的,风险比(HR)是0.65,也就是要使死亡的风险降低35%;而在KEYNOTE-394研究中HR值提高到0.70,同时,样本量扩大到了454例。另外一个重要的调整是对全程肝炎病毒的防范和控制非常重视,特别加强了抗病毒、保肝、利胆的治疗。另外,对照组患者(采用最佳支持治疗和安慰剂)在出现进展后可能会选择其他的后续治疗,必然会对研究结果带来明显的影响;因此预设了敏感性分析,并且提前与药监部门进行了充分的沟通。
KEYNOTE-394研究已于2019年11月底顺利完成全部病例入组,估计在2020年的第二季度会获得结果数据。由于在研究设计上做了合理调整和严格实施全程管理,对于研究结果我是很有信心的,可以拭目以待。
KEYNOTE-524、IMbrave-150以及卡瑞利珠单抗研究的成功是否意味着PD-1/PD-L1单抗联合抗血管生成药物一线治疗将成为未来HCC系统治疗的“主力军”?
秦叔逵教授:是的。免疫药物联合其他系统治疗药物,包括抗血管生成药业已成为肺癌、恶性黑色素瘤以及肾细胞癌等恶性肿瘤治疗的重要策略,而且在HCC的治疗上已经崭露头角,取得了成功。多项免疫联合治疗方案已经获得美国FDA、欧洲EMA和我国NMPA等药监部门的批准,正在积极开展临床试验;而依据IMbrave-150研究数据,有关申办方已经向多国提出新适应证上市申请。
抗肿瘤血管生成治疗其实与免疫的微环境密切相关,比如,大分子抗肿瘤血管生成药物贝伐珠单抗可以显著改善肿瘤的微环境,便于PD-1/PD-L1单抗充分发挥作用;而PD-1/PD-L1单抗也有助于抗肿瘤血管生成,可以与贝伐珠单抗相辅相成,发挥增效协同作用。
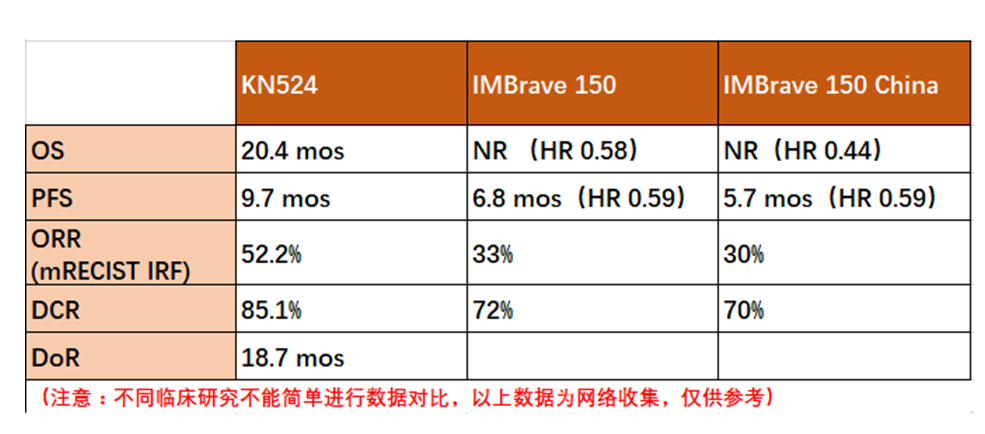 KEYNOTE-524研究是帕博利珠单抗联合仑伐替尼一线治疗晚期HCC的ⅠB期研究,结果显示ORR达到44.8%,疾病控制率(DCR)高达93.3%,同时,PFS为9.7个月,中位OS长达20.4个月。
KEYNOTE-524研究是帕博利珠单抗联合仑伐替尼一线治疗晚期HCC的ⅠB期研究,结果显示ORR达到44.8%,疾病控制率(DCR)高达93.3%,同时,PFS为9.7个月,中位OS长达20.4个月。
以仑伐替尼为代表的靶向治疗一线治疗HCC已经取得成功。2007年索拉非尼上市后的10年间,多个HCC治疗的靶向药物的研发都接踵失败,直到2017年以后,仑伐替尼头对头对比索拉非尼的大型(954例)Ⅲ期临床研究(REFLECT)才取得了成功:主要终点中位OS上,仑伐替尼非劣效于索拉非尼(仑伐替尼组比索拉非尼组延长了1个月,但统计学上没有达到明显差异),而次要终点上,无论是ORR、DCR、TTP和PFS,仑伐替尼均优于索拉非尼。另外,对于中国亚组和乙肝病毒相关HCC,仑伐替尼的优势更为明显。
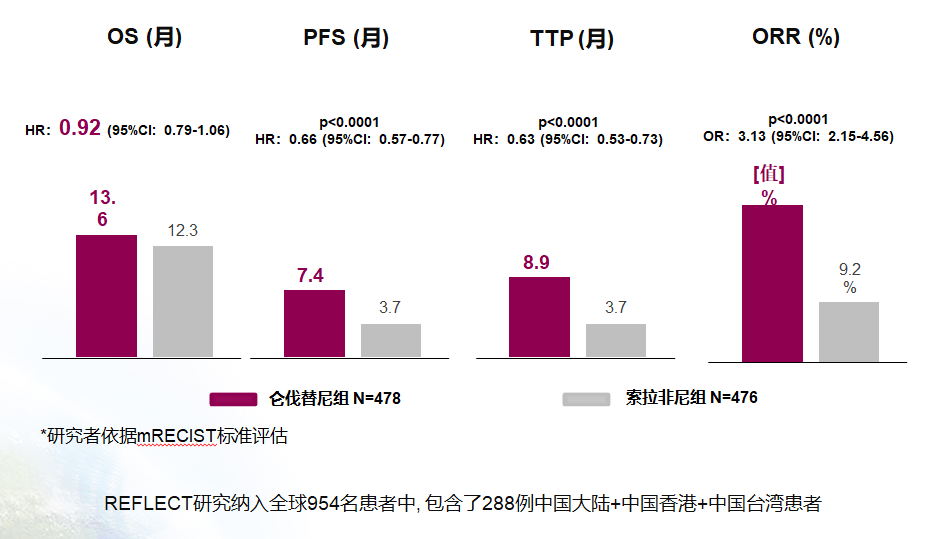
REFELECT Ⅲ期临床研究结果的总人群的有关数据
IMbrave-150研究和KEYNOTE-524研究的成功,给我们带来了莫大的惊喜和启发。现在,我们正在紧锣密鼓地开展帕博利珠单抗联合仑伐替尼的Ⅲ期临床研究(LEAP-002),预期在2020年上半年就能结束全球的入组,参与该研究的中国团队对该研究的设计和实施做出了重要贡献,希望该研究能够获得预期的成功。
虽然免疫检查点抑制剂治疗有较好的疗效,但是除了霍奇金淋巴瘤的客观缓解率较高以外,治疗多数肿瘤的客观有效率也就在20%~30%之间,换言之,对于70%~80%的患者,其疗效还不尽人意。所以光靠免疫单药治疗还不够,我们必须提倡“联合,精准,优化”三大策略。其实,不只有我们医生这么想,患者和家属也非常关注免疫联合治疗的进步。现在,许多患者和家属的文化水平和卫生知识水平比较高,对于肝癌这样一个难治的疾病,通过高度发达的资讯都能够及时了解到最新的研究进展,因此,患者和家属常常主动要求使用PD-1/PD-L1单抗的同时,联合仑伐替尼、贝伐珠单抗、阿帕替尼或者含奥沙利铂的系统化疗。一般情况下,如果患者经济许可,体质状况和肝肾功能好,没有禁忌证,我们也会考虑和同意采取免疫联合治疗的,但是必须强调患者的充分知情同意和自愿应用,因为联合治疗方案现在还没有获得国家药监局的批准;当然,还要求用药过程中严密观察、随访患者,及时防治不良反应。
临床医生应如何合理看待患者要求的“超适应证”使用免疫联合抗肿瘤靶向或抗血管生成药物?
秦叔逵教授:鲁迅先生曾经说过:“世上本没有路,走的人多了,便成了路。”科学总是要不断积极探索,不可以守株待兔。我国有自己的特殊情况,不能生搬硬套国外的制度,而且适应证也总是从非适应证发展而来,也总有个研究的过程。比如,帕博利珠单抗,已经在15个瘤种获批了22个适应证,但在我国只有在黑色素瘤和肺癌两个瘤种上获批了4个适应证,其它适应证的获批肯定需要一个比较长的过程。
当然,在临床实践中选用药物,首先必须考虑以我们国家NMPA批准的适应证作为依据。但是,往往有些适应证由于种种原因在我国还没有获得批准,此时就要个案处理。首先,可以参考国际上,特别是美国FDA、欧盟EMA还有日本厚生省这三大药政部门批准的适应证,因为这三个部门的标准是比较严格的。我国已加入人用药品注册技术要求国际协调会议(ICH)[1],从某种意义上讲,我们也应该去主动认可或者参考已经加入ICH的发达国家药监部门批准的适应证。其次,临床决策时还应该遵循权威的临床实践指南、规范和专家共识。比如说,国家卫健委新发布的《原发性肝癌诊疗规范(2019年版)》和中国临床肿瘤学会(CSCO)制定的《原发性肝癌诊疗指南》推荐了帕博利珠单抗和纳武利尤单抗作为HCC二线治疗药物。
参考上述依据而选择临床治疗药物,严格意义上讲,并不是真正的“超适应证用药”。 另外,一些大型高质量的临床研究的成功,其结果和数据,也具有重要的参考意义。但是,在临床实践中,需要把这些情况与患者及家属进行很好的沟通和说明解释,让他们拥有充分的知情权和选择权,权衡利弊,同时要做好观察、随访工作。免疫治疗肿瘤的同时,会带来一些免疫相关的不良反应(irAE),主要是由于免疫过度激活造成的,并且与化疗和靶向治疗药物明显不同,需要有效、及时地防范。了解和处理好各种irAE是我们医师的职责所在。
综上所述,毫无疑问,以免疫检查点抑制剂为代表的新型免疫治疗恶性肿瘤已经和正在带来一个前所未有的革命性巨变,或将主导未来肝癌的系统治疗。因此,肿瘤专科医师应该主动学习、掌握有关先进知识,在临床实践中让免疫治疗能够充分、适当地发挥重要作用,让肝癌患者尽早获得基于免疫治疗及其联合方案带来的生存“红利”。在中国肝癌高发难治,我们肿瘤医师更应该积极努力,加强诊断、治疗和研究,为攻克这一顽疾,为全球抗癌事业的进步做出重要贡献。
[1] ICH:全称国际人用药品注册技术协调会,1990年启动,1991年召开第一届会议,至今已召开五届。该会议由欧盟、美国及日本发起,由三方成员国的药品管理当局以及制药企业管理机构等共同组成。此外,世界卫生组织的各成员国、加拿大和瑞典作为观察员的身份参加会议,遵循ICH GCP,以便这些国家和地区的卫生管理当局能够最终相互接受各自临床资料,用于人用药品的注册。2018年6月7日,在日本神户举行的ICH大会上,中国国家药品监督管理局加入,并且当选为ICH管理委员会成员。
















 苏公网安备32059002004080号
苏公网安备32059002004080号


