黑色素瘤文献月评项目秉承传递最新医学进展的理念,以专业视角多维度关注领域最新进展。继第一期获得业内高度评价后,项目第二期与大家如期而见,本期汇总了2020年2月发表的热点高水平研究,聚焦BRAF/MEK抑制剂与免疫微环境间的分子机制研究、黑色素瘤同一患者基因突变异质性等内容,特别邀请到吉林省肿瘤医院肾癌黑色素瘤内科张雪莹教授为我们带来深入解读。
点评嘉宾

吉林省肿瘤医院 肾癌黑色素瘤内科
专业:肾癌、膀胱癌、前列腺癌等泌尿肿瘤内科治疗,恶性黑色素瘤的综合治疗
学术兼职:
CSCO尿路上皮癌专家委员会委员
CSCO恶性黑色素瘤专家委员会委员
吉林省中医药学会肿瘤专业委员会常委
吉林省抗癌协会泌尿生殖肿瘤专业委员会委员
中国抗癌协会介入治疗青委会委员
目录
1. Mutant BRAF and MEK Inhibitors Regulate the Tumor Immune Microenvironment via Pyroptosis.
• BRAF和MEK抑制剂通过炎症反应机制调节肿瘤免疫微环境
• IF: 26.370
2. Clinicopathological Features, Staging, and Current Approaches to Treatment in High-Risk Resectable Melanoma.
• 高危可切除黑色素瘤的临床病理特征、分期及治疗方法
• IF: 10.211
3. TERT, BRAF, and NRAS mutational heterogeneity between paired primary and metastatic melanoma tumors.
• 同一患者黑色素瘤原发灶和转移灶中TERT、BRAF和NRAS基因突变的异质性分析
• IF: 6.290
4. Intermittent Versus Continuous Dosing of MAPK Inhibitors in the Treatment of BRAF-Mutated Melanoma.
• MAPK抑制剂的间断与连续剂量方案在BRAF突变黑色素瘤中的疗效对比
• IF: 3.138
5. BRAF-mutant Transcriptional Subtypes Predict Outcome of Combined BRAF, MEK, and EGFR Blockade with Dabrafenib, Trametinib, and Panitumumab in Patients with Colorectal Cancer.
• BRAF突变的转录亚型可预测BRAF/MEK/EGFR三联疗法在结直肠癌的疗效
• IF: 8.911
1. BRAF和MEK抑制剂通过炎症反应机制调节肿瘤免疫微环境
BRAF 抑制剂联合MEK 抑制剂(BRAFi+MEKi)已获得美国FDA批准,用于BRAF V600E/K突变的黑色素瘤。 BRAF抑制剂联合MEK抑制剂可以导致肿瘤细胞的凋亡,同时,可以改变肿瘤的免疫微环境;然而,对于细胞凋亡和免疫微环境改变的联系,目前还并不清楚。
研究发现,BRAF抑制剂联合MEK抑制剂通过一种免疫相关机制引发了肿瘤的临床持续缓解。BRAF抑制剂和MEK抑制剂联合治疗促进了成孔蛋白E(GSDME)的裂解,释放高迁移率族蛋白1(HMGB1),这是一种炎症相关细胞凋亡的标记物。如果黑色素瘤细胞中缺乏GSDME,则没有HMGB1释放,当使用BRAF抑制剂联合MEK抑制剂治疗时,肿瘤相关T细胞和巨噬细胞浸润就会减少;同时,在终止药物治疗后,这些肿瘤细胞再生长的可能性也大大增加。重要的是,当BRAF抑制剂联合MEK抑制剂治疗发生耐药时,肿瘤组织内缺乏炎症反应标记物,T细胞浸润也会减少,但是对于化疗介导的炎症反应敏感。这些数据支持BRAF抑制剂联合MEK抑制剂诱发炎症,产生了抗肿瘤免疫反应。同时,揭示了治疗耐药患者的新策略。
临床意义:靶向药物和免疫检查点药物已经大大提高了黑色素瘤患者的治疗效果;但是,对于这两种机制之间的相互作用还并不清楚。文章描述了靶向药物调节免疫反应导致细胞凋亡的一种分子机制,并为靶向药物耐药患者的后续治疗提供了治疗思路。
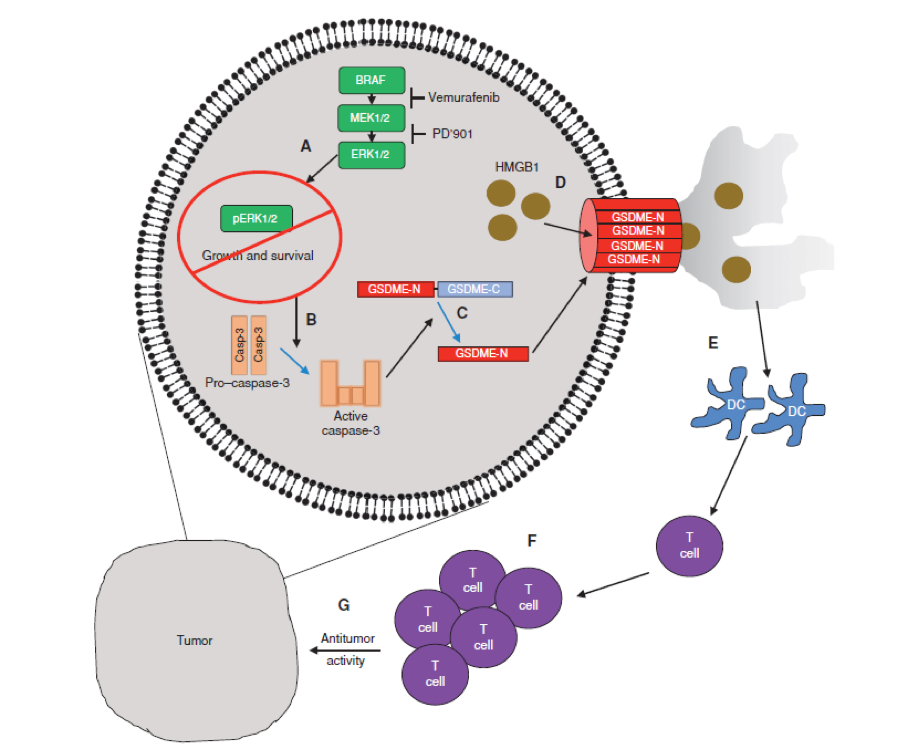
图1. BRAF抑制剂联合MEK抑制剂诱发炎症反应机制
2. 高危可切除黑色素瘤的临床病理特征、分期及治疗方法
在过去的几十年中,美国黑色素瘤的发病率不断上升。 预后很大程度上取决于疾病分期,I期患者5年黑色素瘤生存率高达99%,而IV期(远处转移)患者不到10%。 幸运的是,在过去5到10年中,随着靶向和免疫抑制剂疗法获批,高危可切除黑色素瘤患者的治疗取得了显著进展。 此外,最近的临床试验结果证实了前哨淋巴结活检的重要性,区域淋巴结管理也在不断完善。 最后,在2018年1月1日实施的第八版AJCC癌症分期手册中对黑色素瘤分期进行了修订。 在这里,该文章讨论导致局部和远处复发及预后差相关的变化和临床病理特征,也讨论了转移性和辅助治疗背景下黑色素瘤治疗的意义,以及新辅助治疗的未来方向。
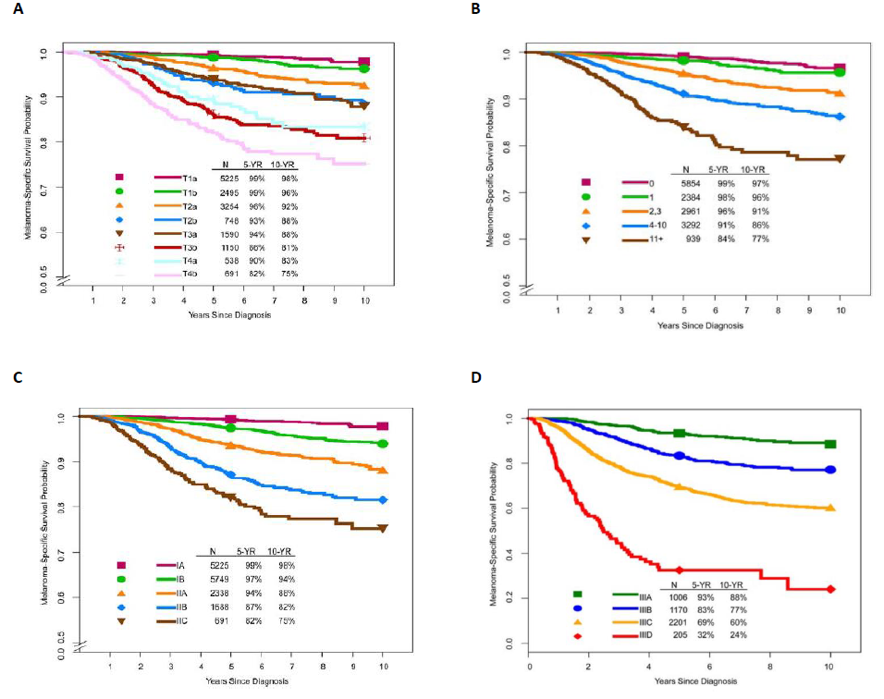
图2. 基于第八版AJCC的国际黑色素瘤数据库生存率;(A):基于T分期的Stage I和II的黑色素瘤10年生存率,(B):基于有丝分裂率的Stage I和II的黑色素瘤10年生存率,(C):Stage I和II的的黑色素瘤10年生存率,(D):Stage III的的黑色素瘤10年生存率
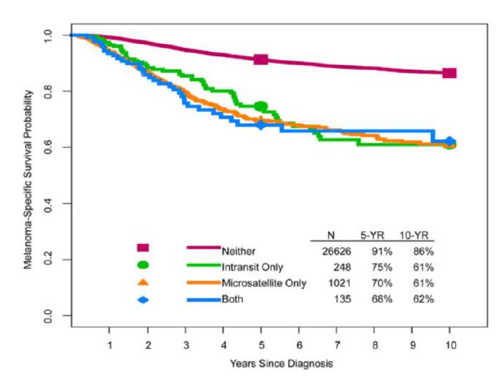
图3. 基于第八版AJCC的国际黑色素瘤数据库生存率数据,分析移行和卫星转移情况的黑色素瘤10年生存率
3. 同一患者黑色素瘤原发灶和转移灶中TERT、BRAF和NRAS基因突变的异质性分析
突变异质性可导致实体瘤的治疗耐药。在黑色素瘤中,肿瘤间和肿瘤内异质性的发生频率尚存在争议。该研究使用多个平台对常见驱动基因和伴随基因突变进行分析,评估了个体黑色素瘤患者的基因突变异质性。
该研究共分析了60例黑色素瘤患者的原发灶和转移灶,以及39例患者的多个转移灶(因原发灶无法获得)。运用多重SNP分型技术(multiplex SNaPshot assays)、Sanger测序、突变特异性PCR技术(MS-PCR)或液滴数字PCR(ddPCR)来检测是否存在BRAFV600、NRASQ61和TERT-124C>T和 TERT-146C>T突变。
结果检测到了BRAF(39%)、NRAS(21%)和/或TERT(78%)基因的突变。13例患者中检测到了不一致的TERT突变肿瘤病灶;其中7例患者的单一肿瘤病灶中同时有不同等位基因频率的TERT-124C>T 和TERT-146C>T 两种突变。2例病人同时有BRAF突变和 NRAS突变:其中1例在不同的病灶中,另1例在同一个病灶中同时有两种突变。 1例原发性BRAF突变黑色素患者至少有一个转移病灶不携带BRAF突变。 总的来说,该研究在18/99(18%)的患者中发现了突变异质性。
这些结果表明,一些原发性黑色素瘤可能由具有不同突变特征的亚克隆组成。这种异质性可能与治疗反应和生存结局有关。
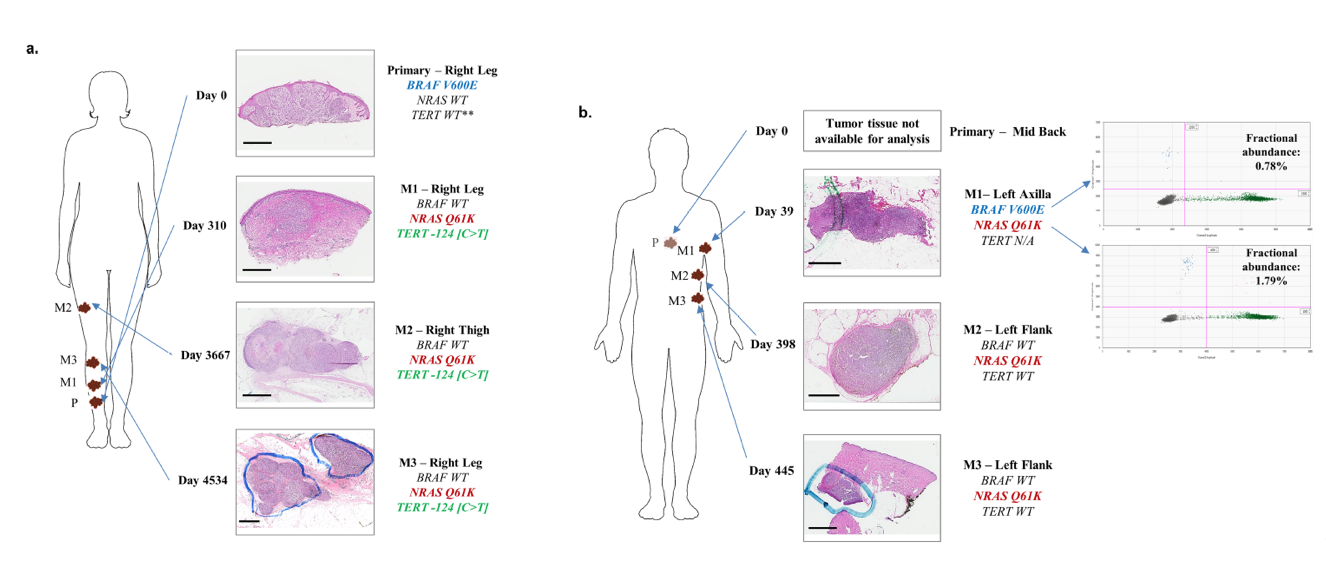
图4. (a)编号为06-001的患者确诊时为BRAFV600E突变/NRAS野生型/TERT野生型原发肿瘤,在原发灶切除后310天发现有BRAF野生型/NRASQ61K/TERT-124C>T突变型卫星转移灶(M1);(b)编号为06-075的患者的三个转移灶中带有两种不同的基因型。M1: BRAFV600E突变/NRASQ61K突变/TERT野生型, M2和M3: BRAF野生型/NRASQ61K突变/TERT野生型
4. MAPK抑制剂的间断与连续剂量方案在BRAF突变黑色素瘤中的疗效对比
BRAF和MEK抑制剂(BRAFi/MEKi)的出现为黑色素瘤治疗取得了重大进展。然而,靶向耐药机制限制了患者获益持续时间,在接受BRAFi±MEKi治疗的患者中,接近20%的患者实现完全缓解。在这项研究中,该研究评估了BRAF/MEK抑制剂间断与连续给药方案在对BRAF抑制剂轻度敏感型黑色素瘤模型中的影响。研究将BRAFi与三种不同MEKi联用,进行体内连续或间断给药、异种移植黑色素瘤模型和体外患者源异种移植(PDX)组织培养药物应答试验(HDRAs)。为了进一步研究治疗的潜在分子机制,还评估了生物标志物的药效学参数。
在单药或双药方案中均观察到,连续和间歇给药方案对肿瘤生长的影响是相同的,生物标志物表达没有显著差异。抗肿瘤作用主要是通过调节细胞周期和凋亡介质的表达而实现。此外,体外研究表明连续和间断给药方案无显著差异。临床前和药效学结果与上述结果基本一致,BRAFi/MEKi单药和联用情况下,间歇和连续给药疗效基本一致。
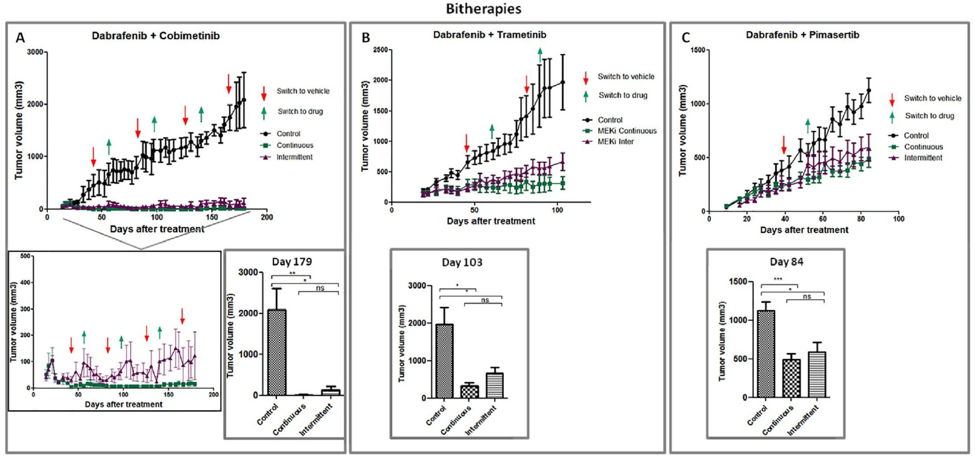
图5. BRAFi+MEKi 双药方案连续与间断给药在BRAF突变SKMEL28异种移植模型的抗肿瘤效果。SKMEL28异种移植裸鼠接受连续或间断方案体内试验,达拉非尼(100 mg/kg ,1日1次口服) 联合(A):考比替尼(5 mg/kg, 1日1次口服),(B): 曲美替尼(3 mg/kg, 1日1次口服),(C)pimasertib (20 mg/kg, 1日1次口服);间断给药方案为用药4周后停药2周为一周期,反复循环。
5. BRAF突变的转录亚型可预测BRAF/MEK/EGFR三联疗法在结直肠癌的疗效
目的: BRAF V600E突变(BM)的结直肠癌(CRC)主要包括两种转录亚型,BM1和BM2(BM1的特征是KRAS/AKT通路激活,上皮- 间充质转化(EMT)介导的侵袭、转移和化疗抵抗,免疫反应增强;BM2的特征是细胞周期检查点的下调;BM1的预后差于BM2)。然而,基因突变位点的转录亚型和免疫学背景对靶向治疗的疗效是否有影响尚未可知。本研究旨在探索BM亚型以及这些亚型的独特生物学特征是否对CRC患者接受BRAF / MEK / EGFR三联疗法的疗效存在影响。
实验设计:纳入所有参加达拉非尼,曲美替尼,帕尼单抗三联治疗的II期临床试验的BM CRC患者,并获得其基线和治疗第15天的新鲜活检肿瘤组织。使用RNA测序(RNA-seq)确定肿瘤组织的BM亚型,细胞周期和免疫基因标记表达,采用Cox比例风险模型确定这些观察指标与无进展生存期(PFS)的相关性。
结果:与BM2亚型患者相比,BM1亚型患者的确证反应率(RR),中位PFS和总生存(OS)更高。评估免疫印迹的情况发现,BM1亚型具有更高的免疫反应性,而细胞周期信号在BM2亚型中则更高。包含BM亚型,免疫和细胞周期信号的PFS多元模型结果显示,BM亚型对PFS具有显著的独立影响作用,且这种作用不受免疫状态差异和细胞周期基因印迹表达差异的影响。
结论:BM亚型与达拉非尼,曲美替尼,帕尼单抗联合治疗的结局显著相关,并且可以作为突变位点之外的独立预测生物标志物。对转录亚型的评估应作为未来精准治疗决策的参考指标。
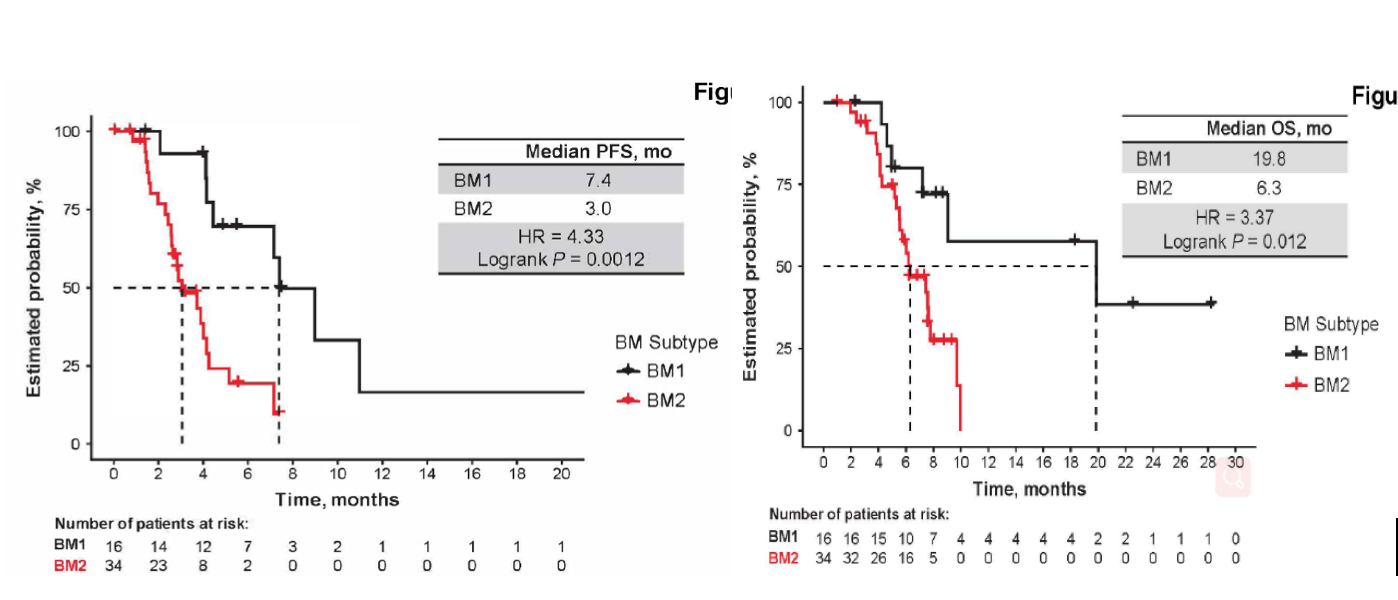
图6. 接受BRAF / MEK / EGFR抑制剂治疗的BM1亚型的患者,与PFS和OS升高相关。 (左) 接受D + T + P治疗的BM1(n = 16)和BM2(n = 34)患者的PFS。(右) 接受D + T + P治疗的BM1(n = 16)和BM2(n = 34)患者的OS
*达拉非尼和曲美替尼治疗结直肠癌适应症尚未获批
排版编辑:Vicky
[1]. Cancer Discov. 2020 Feb; 10(2): 254-269.
[2]. J Natl Cancer Inst. 2020 Feb 15. pii: djaa012. doi: 10.1093/jnci/djaa012. [Epub ahead of print]
[3]. J Invest Dermatol. 2020 Feb 19. pii: S0022-202X(20)30159-7. doi: 10.1016/j.jid.2020.01.027. [Epub ahead of print]
[4]. Transl Oncol. 2020 Feb; 13(2): 275-286.
[5]. Clin Cancer Res. 2020 Feb 11. pii: clincanres.3579.2019. doi: 10.1158/1078-0432.CCR-19-3579. [Epub ahead of print]
精彩回顾:
黑色素瘤文献月评 | 第一期 BRAF突变转移性黑色素瘤的最佳治疗方案决策















 苏公网安备32059002004080号
苏公网安备32059002004080号


