2019年9月27日至10月1日,2019年欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那举行,该会议是欧洲最负盛名和最具影响力的肿瘤学会议,会议期间大量肿瘤临床治疗相关的研究结果公布,为推动肿瘤诊疗发挥巨大作用。本次大会上,采用多基因检测探寻患者的潜在治疗靶点或靶向治疗的耐药机制仍然是研究热点。在泛肿瘤领域,多项研究采用Foundation Medicine Inc.(FMI)开发的全面基因组检测(CGP检测)平台,探索靶向耐药机制、明确基因突变特征和寻找潜在治疗靶点,全面助力泛瘤种个体化治疗。
(一)明确靶向治疗耐药机制,为进一步治疗指引方向
1878PD:BRAF驱动肿瘤临床获得性耐药分析
BRAF基因变异在多种肿瘤中存在,目前已经在黑色素瘤和NSCLC患者中获批了BRAF/MEK靶向治疗。这一研究对222952例患者的FFPE标本或cfDNA标本进行FoundationOneCDx或FoundationOne Liquid检测。共154例BRAF V600E突变(64%)或其他BRAF活化突变(36%)的患者有配对标本(要求间隔时间>60天)进行检测:其中NSCLC占20%、黑色素瘤19%、结直肠癌15%、骨髓瘤8.4%、胶质瘤7.1%、其他30%。
总体而言,在接受BRAF/MEK抑制剂治疗后耐药的BRAF突变患者中,51%(79/154) 的患者检测到一个或以上获得性耐药变异,包括40%的cfDNA标本和53%的组织标本,见下图。在接受BRAF/MEK靶向治疗后(主要为黑色素瘤),16%的患者检测到既往已经报道过的获得性耐药变异,包括:KRAS突变、NRAS扩增、其他BRAF突变、MEK1突变、PIK3CA突变、PTEN突变、CCND1扩增和MET扩增,且原发肿瘤类型、活检部位、原发BRAF变异类型、至进展时间对上述改变并无影响。其他56例患者检测到其他获得性耐药突变,如STK11,NF1。

图1. BRAF驱动型患者配对标本分析检测到的获得性变异
第一次和第二次活检标本的平均TMB为4.0 vs 5.2 Mut/Mb(p=0.23)。12% 的患者(9个组织,9 个cfDNA),二次活检标本未检测到BRAF变异。大多数获得性耐药机制(MET扩增, KRAS突变,BRAF二次突变)在不同类型肿瘤中分布相似,但PIK3CA和PTEN变异在脑标本中更常见,在结直肠癌中不可见,NRAS突变在黑色素瘤中也不可见。对获得性耐药机制进行检测,可以进一步指导患者后续对应的有效治疗,研究同时报道了一些患者的治疗情况,如分别有1例携带BRAF V600E的结直肠癌、NSCLC和黑色素瘤,接受dabrafenib+trametinib治疗后,检测到MET扩增;1例BRAF V600E突变的骨髓瘤患者,接受dabrafenib+trametinib治疗后,检测到MEK C121S。
小结:通过FoundationOneCDx或FoundationOne Liquid对BRAF驱动的不同类型肿瘤的组织和血液样本进行检测,可探索这类难治肿瘤的耐药机制,今后应该开展泛肿瘤的临床研究,采用联合治疗方案对BRAF/MEK靶向治疗耐药的患者寻找最佳治疗策略。
(二)少见类型实体肿瘤中TMB-H预后作用探索
1877PD:基于真实世界数据,探索高肿瘤突变负荷(TMB-H)在少见类型实体肿瘤中的现状和预后影响
这一研究利用纳入真实世界队列数据中的10种类型(KEYNOTE-158研究中的肿瘤类型)晚期肿瘤患者,分析TMB-H的发生率以及其与临床结局的相关性。这是一项回顾性观察性研究,入组患者来自Flatiron Health-Foundation Medicine(FMI)临床基因数据库,符合以下实体瘤类型:肛门癌、胆管癌、神经内分泌肿瘤,子宫内膜癌、宫颈癌、阴道癌、小细胞肺癌、胸膜间皮瘤、甲状腺癌和唾液腺癌。共2589例患者纳入主要分析,其中胆管癌(27%)、子宫内膜癌(23%)和SCLC(12%)是3种主要肿瘤。患者的平均年龄为64岁,65%的患者为女性。所有患者均接受了FMI开发的检测FoundationOneCDx,且为非MSI-H型。
采用≥10Mut/Mb作为TMB的cut-off值,12.8%的患者为TMB-H型。TMB-H的患者比例在SCLC中最高(39.8%),其次为神经内分泌癌(29.3%)和宫颈癌(14.9%),在胸膜间皮瘤(1.2%)、甲状腺癌(2.7%)和胆管癌(3.8%)中最低,见下图。不同类型肿瘤患者的TMB差别很大,整个队列总体人群的中位TMB为2.6Mut/Mb,从1.7(胸膜间皮瘤、唾液腺癌、甲状腺癌)到8.7(SCLC)Mut/Mb不等。采用≥13Mut/Mb作为TMB的cut-off值,9.2%的患者为TMB-H型。
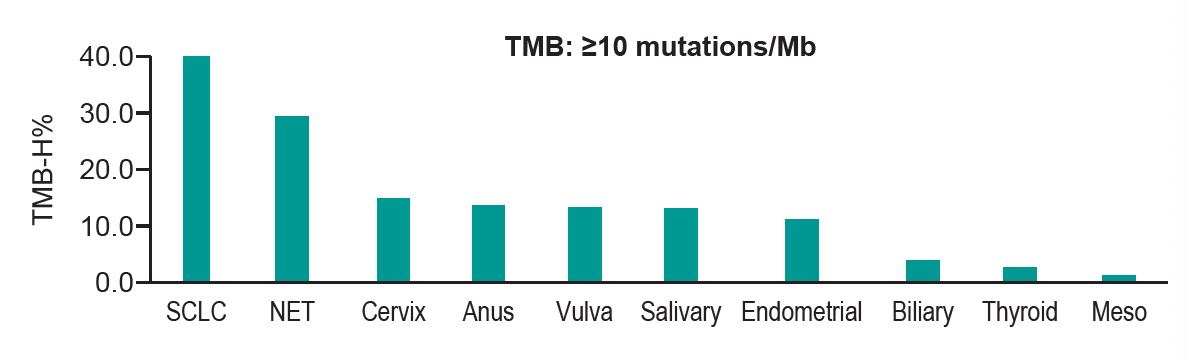
图2. 不同类型肿瘤患者的TMB-H型患者比例
OS分析显示,TMB-H型患者的OS与非TMB-H型患者相似,HR 0.94(95%CI:0.77-1.13);采用TMB ≥13Mut/Mb作为cutoff值,两组患者矫正HR为0.84(95%CI:0.67-1.05)。
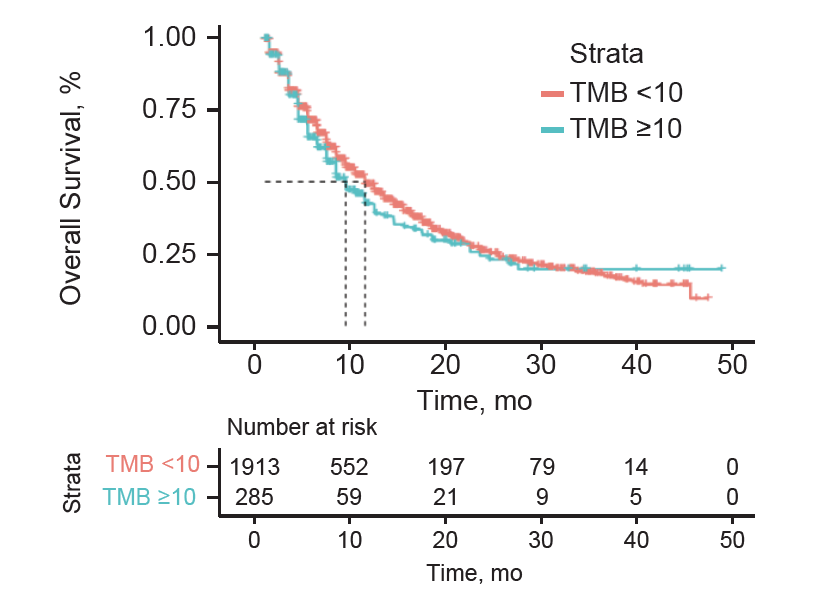
图3. TMB高和非TMB高组患者的OS对比
小结:这一研究基于真实世界数据,探究TMB在少见类型实体肿瘤中的水平,以≥10Mut/Mb作为cut-off值,TMB-H型患者比例为12.8%。研究同时探索了少见类型实体肿瘤中高突变负荷的预后作用,初步结果显示,未经免疫治疗患者,肿瘤突变负荷高或低对总生存无显著影响。后续需要进一步探索TMB的预后价值在不同类型肿瘤中是否一致,以及采用不同的cut-off值,TMB的预后价值是否一致。
(三)多线治疗耐药后的转移性实体瘤,基因检测指导下的个体化精准治疗
1885P:基因指导下的个体化精准治疗为状态较差的转移性实体瘤带来新希望:一项单中心前瞻性观察性真实世界研究,这项研究由天津医科大学第二医院肿瘤科王海涛教授团队完成
近年来,分子检测指导下的个体化精准治疗已经在多种复发耐药的肿瘤中观察到显著疗效。然而截至目前,在状态较差的晚期复发耐药的实体瘤患者中,很少有评估采用NGS检测可靶向基因变异并指导患者进行相应治疗的前瞻性研究。这是一项前瞻性、观察性、单中心研究,纳入了既往接受过多线治疗后耐药的、PS评分状态较差(ECOG PS ≥3分)的患者。患者接受FMI开发的FoundationOneCDx检测,检测结果有分子肿瘤协作组分析和讨论,并给出相应治疗推荐,评估治疗的疗效。研究的主要终点为ORR,次要终点为DCR、PFS、OS和安全性。
从2018年10月至2019年4月,共入组48例患者,包括卵巢癌、前列腺癌、胃癌、肝癌。对所有患者的转移灶标本进行FoundationOneCDx检测,分子检测成功率为93.8%,分子肿瘤协作组根据检测结果对其中28例(62.2%)患者推荐了相应治疗。推荐的治疗方式包括:单药靶向治疗(60.7%)、免疫检查点抑制剂(25%)、联合靶向治疗(14.3%)。28例推荐治疗的患者中,22例(78.6%)接受了相应治疗,其中8例(36.4%)取得CR(n=1)或PR(n=7),此外,16例(72.7%)接受了off-label治疗。AE主要表现为1-2度,如疲劳、高血压和皮肤反应。
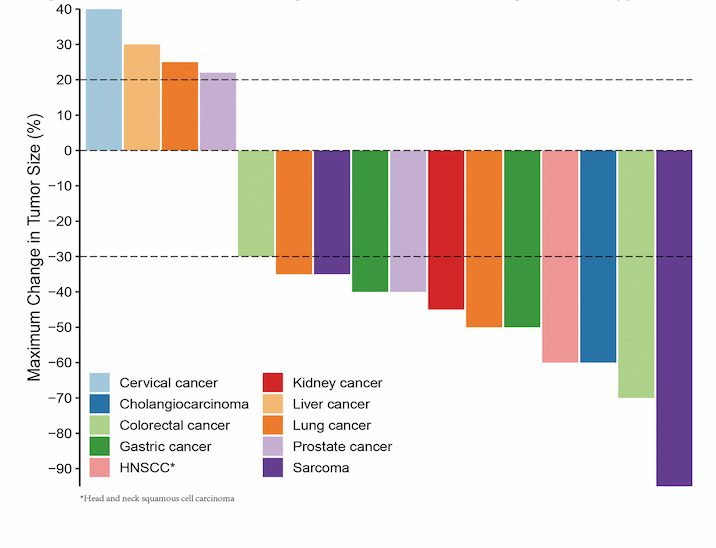
图4. 根据肿瘤类型显示肿瘤的最佳疗效
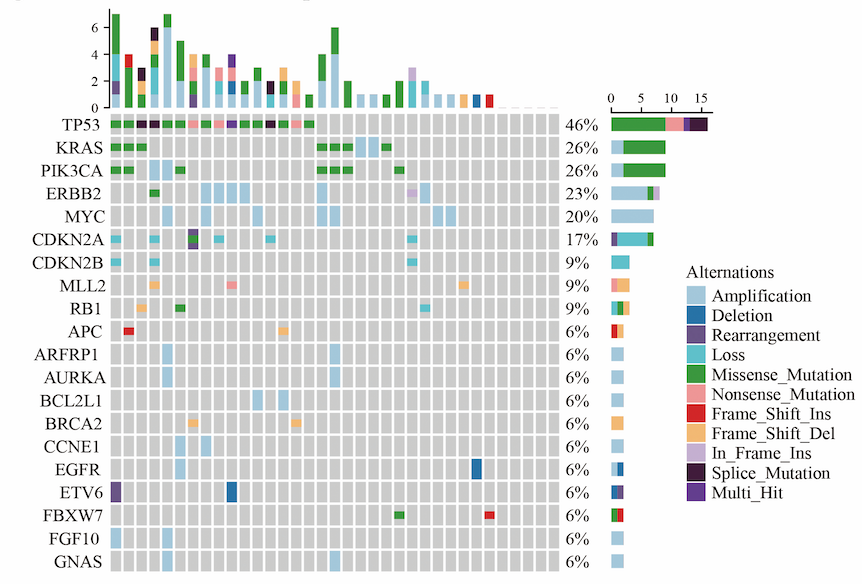
图5. 所检测样本Top 20基因变异
研究同时报道了2例接受FoundationOneCDx检测后寻找到潜在治疗靶点并接受靶向治疗到患者:病例1为48岁男性,肉瘤。患者既往已经接受过多线化疗,疾病进展后进行FoundationOne CDx检测,发现患者携带TP53(p.G245D)错义突变。患者接受阿帕替尼联合奥拉帕利治疗,2个月后,CT复发显示肿瘤较之前缩小,见下图。根据RECIST v1.1表现评价,患者取得PR。
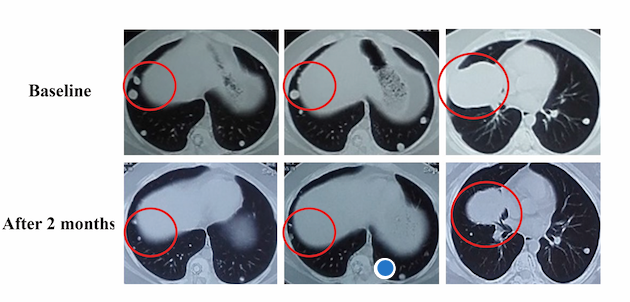
图6. 患者接受阿帕替尼联合奥拉帕利治疗2个月前后影像学对比
病例2为30岁男性,诊断为组织细胞性淋巴瘤。对治疗组织进行FoundationOneCDx检测后发现MAP2K1(即MEK1)突变。患者接受曲美替尼2mg/天治疗。一个月后,PET-CT复查显示肝脏转移灶和右胫骨转移灶明显缩小,且代谢活性降低。根据mRECISTv1.1标准评价,患者取得PR。
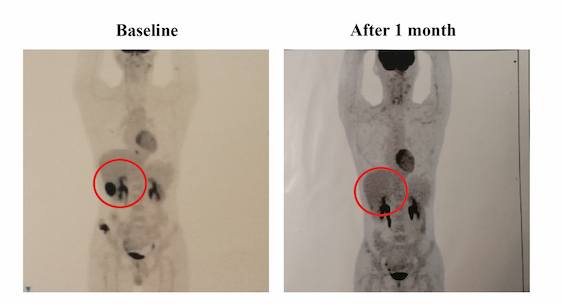
图7. 患者接受曲美替尼治疗1个月前后影像学对比
小结:对于少部分患者,即使处于临床上极具挑战的情境下,基因指导下的个体化精准治疗还是有效的。通过分子肿瘤专家组讨论以及基于证据的可靶向基因变异评估工具可以有效的改善基因指导下精准治疗的疗效。
总结
上述几项研究均采用FMI开发的FoundationOneCDx或FoundationOne Liquid检测平台,对靶向耐药的患者以及一些少见类型实体肿瘤或多线治疗耐药后、状态较差的肿瘤进行检测,可以明确靶向耐药机制、寻找潜在的治疗靶点,助力个体化精准治疗。

医学博士 博士生导师 主任医师
天津医科大学第二医院肿瘤科主任、放疗科主任
美国临床肿瘤学会会员
中国临床肿瘤学会(CSCO)理事
中国抗癌协会肿瘤精准治疗专业委员会委员
中国民族医药学会精准医学分会副会长
天津市医师协会临床精医疗专业委员会副主任委员
天津市中西医结合学会循证医学专业委员会副主任委员
中华医学会天津分会肿瘤学会委员
天津市抗癌协会泌尿肿瘤及老年肿瘤专业委员会委员
天津市中西医结合学会肿瘤专业及围术期专业委员会委员
主要从事肿瘤的个体化多学科综合治疗及精准治疗的应用基础研究
主持国家自然科学基金面上项目2项,主持国际上第一项前列腺癌精准治疗临床试验(NCT02208583)
获2016年推动中国前行的力量十大医学新锐奖
以第一或通讯作者发表论文50余篇,被《JCO》等SCI杂志收录20余篇
在晚期肿瘤的治疗中,靶向治疗和免疫治疗已经成为非常重要的治疗手段之一,可以显著改善患者的治疗结局。如何使得更多的患者接受到相应的靶向治疗或寻找从免疫治疗中获益的人群,是当下的重要研究课题,通过CGP检测可以发现患者的分子突变谱以及相应免疫标签,为患者的靶向或免疫治疗选择提供重要参考。上述第1项研究采用由FMI开发的FoundationOneCDx或FoundationOne Liquid检测平台,对靶向治疗耐药后的组织或血浆标本进行检测,可以发现耐药后的获得性基因变异,为后续开展相应的联合靶向治疗,克服耐药提供重要参考。第2项研究在大样本量的真实世界罕见肿瘤患者中评估了TMB状态及其预后价值,可以寻找难治性罕见肿瘤中有望从免疫治疗中获益的患者,进而为这类难治性患者带来治疗希望。第3项研究是来本中心的真实世界研究,对状态较差,缺乏标准治疗的患者进行CGP检测,有望寻找到潜在的治疗靶向。研究中部分患者并没有接受推荐的靶向治疗,而接受相应的推荐治疗的患者,可以取得较好的疗效。这就提示我们,晚期肿瘤患者,应该尽早开展多基因检测,以指导患者的治疗,进而改善预后。随着靶向治疗和免疫治疗的发展,单基因检测已经无法满足临床需求,多基因检测可以一次性检测多个基因,综合全面的基因突变谱,可以为患者制定最佳的治疗方案。FoundationOneCDx或FoundationOne Liquid是由FMI开发的CGP检测平台,经过严谨的分析验证,应用“基于独特靶向富集杂交捕获”的NGS(二代测序)技术。FoundationOneCDx在一次检测中平行提供了覆盖324个基因的4种基因变异类型及TMB和MSI两种基因标签的全面分子信息,可以精准地指导个体化靶向及免疫治疗。目前,FoundationOneCDx已经进入中国市场,从上述第3项研究可知,基于FoundationOneCDx的检测结果指导临床实践确实可以使患者获益更多,而且目前已经有很多患者从此检测中获益,CGP检测已经成为临床诊疗中很重要的一部分。
1. Pan-cancer analysis of clinical acquired resistance (AR) in BRAF-driven real-world cases. 2019 ESMO, abs 1878PD.
2. Prevalence and Prognostic Effect of High Tumor Mutational Burden (TMB-H) Across Multiple Less Common Solid Cancers Using a Real-World Dataset. 2019 ESMO, abs 1877PD.
3. Genomic-guided individualized precision therapy in refractory metastatic solid tumor patients with extensively poor performance status: a Chinese single institutional prospective observational real-world study. 2019 ESMO, abs 1885P.














 苏公网安备32059002004080号
苏公网安备32059002004080号


