
第81例
抗HER2靶向治疗是乳腺癌患者治疗历程中的一个里程碑!在HER2阳性乳腺癌的辅助,新辅和晚期都有显著疗效,明显改善生存状况。妥妥双靶用于新辅助治疗,不仅提高了患者的pCR率,更带来EFS和OS的获益。对于符合新辅助治疗指征的HER2阳性乳腺癌,妥妥双靶新辅助治疗,是一种更优的治疗选择。

浙江大学附属第一医院乳腺疾病诊治中心主任
中华医学会外科学分会乳腺外科学组委员
中国抗癌协会乳腺癌专业委员会委员
中国临床肿瘤学会乳腺癌专家委员会委员
中国医师协会乳腺外科医师委员会委员
中国医师协会乳腺癌精准专业委员会委员
中国医药教育协会乳腺疾病专业委员会 常委
中国医疗保健国际交流促进会乳腺疾病分会常委
浙江省抗癌协会乳腺癌专业委员会副主任委员
浙江省中西医学会乳腺病专业委员会副主任委员
浙江省医师协会乳腺肿瘤委员会副主任委员

浙江大学医学院附属第一医院乳腺疾病诊治中心
浙江省医师协会乳腺肿瘤专业委员会委员
2015年曾至日本临床进修
2016年获“指尖上的艺术”中青年医师乳腺癌手术视频大赛南中国赛区一等奖
参与多项乳腺癌相关科研研究及多中心临床研究
基本情况
患者女性,50岁,已婚已育,未绝经,发现右乳肿块3个月就诊,既往体健,无家族史。
治疗经过
患者因发现右乳肿块3个月就诊。查体:双乳对称,右乳头略有脱屑,无凹陷或溢液。右乳内下象限可及一6cm×3cm左右肿块,边界不清,质硬,可推动,双侧腋下未及明显肿大淋巴结。乳腺钼靶检查提示:右乳内下浓密腺体影伴局部边缘纠集,BI-RADS 4B类;右乳外上集聚沙粒样细点状钙化灶,BI-RADS 4a类。乳腺超声和造影检查:右乳下象限低回声团,大小约3.0cm×1.9cm×2.4cm,超声造影:动脉期快速高增强范围明显扩大。右腋下可及肿大淋巴结,BI-RADS 5类。乳腺MRI检查:右乳多发占位,考虑多中心乳腺癌伴病灶周边导管内浸润,并累及乳头,右腋下淋巴结转移,BI-RADS 5类。

图1. 乳腺钼靶检查
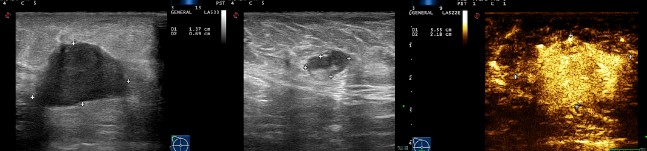
图2. 乳腺超声检查
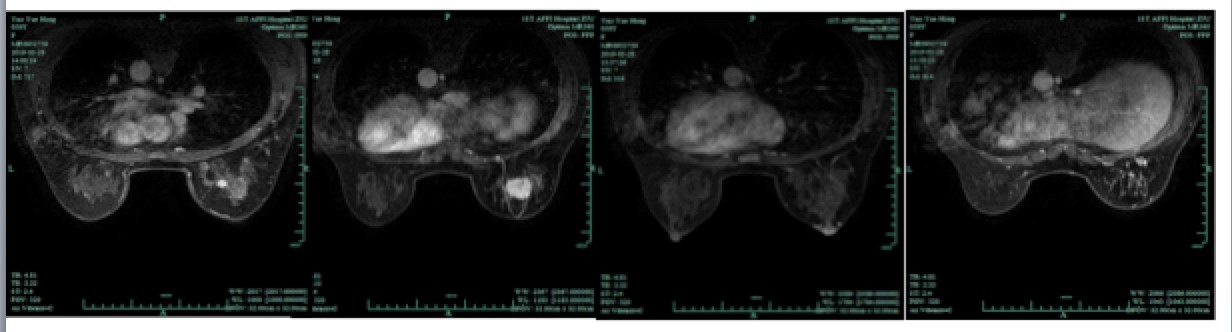
图3. 乳腺MRI检查
行右乳肿块及右腋窝淋巴结穿刺,病理结果示:(右乳肿块穿刺标本)乳腺浸润性导管癌;(腋窝淋巴结穿刺标本)查见癌转移。免疫组化:ER(-),PR(-),AR(+20%),HER2(3+),Ki67(16%)。诊断为右乳癌伴右腋窝淋巴结转移性癌,cT2N1M0,HER2阳性型。
新辅助治疗
2019年3月22日开始接受TCbHP (多西他赛 110mg,卡铂 500mg,曲妥珠单抗 400mg/300mg,帕妥珠单抗 840mg/420mg)化疗+双靶新辅助治疗。第一次治疗后第三天出现腹泻,最多7~8次/天,予蒙脱石散对症治疗后缓解,第7天检查出现Ⅳ度粒缺,予短效升白对症治疗后恢复。第二次治疗后予长效生白针预防粒缺,过程顺利,未出现腹泻及其他明显不良反应。二次治疗后复查乳腺超声评估,乳腺肿块及腋窝淋巴结均较治疗前缩小,造影大小亦较前次缩小。四次治疗后复查乳腺超声评估,右乳未见明显肿块,右腋窝未见肿大淋巴结。此外,患者每次化疗前的检查心超EF值未见明显变化,结果总结见下表。
表1. 新辅助治疗过程中的EF值变化
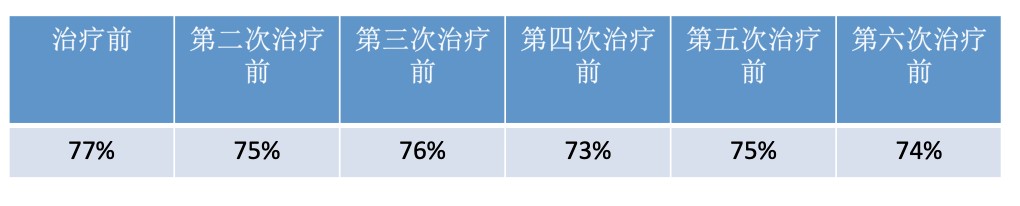
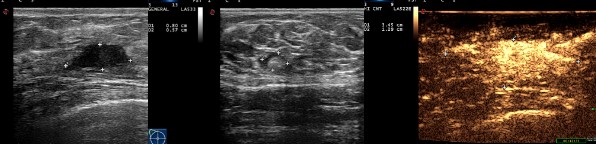
图4. 2周期新辅助治疗后复查乳腺超声
图5. 4周期新辅助治疗后复查乳腺超声
手术治疗
新辅助治疗6周期后,于2019年7月17日行右乳癌改良治术+Ⅰ期背阔肌联合假体乳房重建术。术后病理结果示:(右乳)符合乳腺癌化疗后改变(MP分级:5级),腋窝淋巴结转移性癌(1/39)。术后评价为pCR。
辅助治疗
建议患者术后行放疗,并继续双靶治疗至1年。
总结
患者50岁,已婚已育,未绝经,因发现右乳肿物3个月就诊,行右乳肿块及右腋窝淋巴结穿刺,病理示:右乳腺浸润性癌,免疫组化结果:ER(-),PR(-),AR(+20%),HER2(3+),Ki67(16%)。诊断为右乳癌伴右腋窝淋巴结转移性癌,cT2N1M0,HER2阳性型。TCbHP新辅助治疗, 2个周期后取得PR; 4个周期治疗后,右乳未见明显肿块,右腋窝未见肿大淋巴结。共接受6个周期新辅助治疗后,于2019年7月17日行右乳癌改良根治术+Ⅰ期背阔肌联合假体乳房重建术,术后评价新辅助治疗pCR。建议术后接受辅助放疗、并继续双靶治疗至1年。
点评专家

加拿大麦吉尔大学博士后
云南省肿瘤医院乳腺二科副主任
云南省中青年学术技术带头人后备人才
云南省高层次人才医学学科带头人
中国抗癌协会青年理事
中国抗癌协会乳腺癌专业委员会委员
中国肿瘤临床协作专委会乳腺癌专家委员会委员
中国医促会乳腺疾病专业委员会常务委员
中国医促会肿瘤整形外科乳腺学组青年委员会副组长
中国医药教育协会乳腺疾病专业委员会常务委员
云南省医师协会乳腺癌专业委员会主任委员
云南省抗癌协会临床肿瘤协作专业委员会副主任委员
云南省预防医学会乳腺癌专业委员会副主任委员
云南省抗癌协会乳腺癌专业委员会副主任委员
云南省医学会肿瘤学分会乳腺学组副组长
点评
患者为未绝经女性,术前诊断为cT2N1M0,HER2阳性型,参照美国NCCN2019 V1乳腺癌指南和《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2019)》,患者符合新辅助治疗标准。在CSCO乳腺癌诊疗指南中,HER2阳性乳腺癌新辅助治疗推荐选择含曲妥珠单抗的方案,优先选择含紫杉类的方案,其中双靶向治疗TH+P方案和TCbH方案为1A类推荐。本例患者最终选择为TCbH+P作为新辅助方案,与CSCO BC指南推荐方案有一些不一样,但从近期疗效来看,算是疗效显著的方案选择!
1. 新辅助治疗的适应证探索
《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2019)》中推荐,对于满足以下条件之一者可以选择术前新辅助药物治疗:肿块较大(>5cm)、腋窝淋巴结转移、HER2阳性、三阴性和有保乳意愿,但肿瘤大小与乳房个体积比例大难以保乳者。指南中明确指出,新辅助治疗的适应症不仅仅依据解剖分期,而应结合肿瘤分子分型、临床分期及患者意愿个体化确定。这例患者为HER2阳性患者,临床及影响评估肿瘤大小均符合新辅助治疗适应症,可以考虑新辅助治疗。
2. 新辅助治疗方案考量
NeoSphere研究【1】评估了帕妥珠单抗+曲妥珠单抗+多西他赛(PHT)治疗的疗效,结果显示,帕妥珠单抗和曲妥珠单抗联合多西他赛显著提高pCR,不影响耐受性。基于NeoSphere的研究结果,FDA将帕妥珠单抗纳入审评快速通道。TRYPHAENA研究【2】则进一步证实,在化疗起始使用就使用双靶向治疗,患者的pCR率更高;此外,不同分子亚型患者分析显示,纯HER-2阳性型患者,pCR比率更高,接受TCbHP方案治疗的pCR率可以高于80%。这例患者接受了TCbHP方案进行新辅助治疗,临床疗效也证实了临床研究的结果,2个周期治疗后取得PR,4个周期治疗后,影像学上肿瘤消失,达到CR。
3. 辅助治疗阶段继续双靶向抗HER2治疗
对于HER2阳性乳腺癌,如果把曲帕双靶方案用于辅助治疗,患者整体预后也会有所变化,APHINITY研究已经有所证实。但是如何在早期乳腺癌患者中更合理有序地应用曲帕双靶方案?2018年SABCS报道了由复旦大学附属肿瘤医院邵志敏教授团队牵头的针对亚洲人群的随机、多中心、双盲、安慰剂对照的Ⅲ期临床试验PEONY研究【3】。入组患者术前按照2:1随机选择帕妥珠单抗+曲妥珠单抗+多西他赛方案或安慰剂+曲妥珠单抗+多西他赛4周期新辅助治疗,术后患者接受3疗程FEC方案化疗后继续使用13疗程的曲帕双靶或者安慰剂+曲妥珠单抗的单靶方案治疗至1年。结果显示,曲帕双靶组相对于对照组,tpCR显著提高(39.3% vs 21.8%,P=0.0014)。PEONY研究设计在试验组从新辅助到后续辅助治疗阶段均采用曲帕双靶治疗。对于新辅助治疗达到pCR的患者,说明患者对治疗方案敏感,则方案可以延续到辅助治疗。而新辅助治疗未达到pCR的患者,PEONY研究也会进一步回答这个问题,期待未来长期随访数据的生存获益结果。
而2019年ASCO期间更新了最终结果的KRISTINE研究【4】则比较了TCHP方案(多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗)对比T-DM1+帕妥珠单抗的乳腺癌新辅助疗效,两组pCR的结果显示化疗+靶向药物组合的pCR率显著高于T-DM1+帕妥珠单抗组。TCHP组患者的无事件生存优于T-DM1+帕妥珠单抗组;两组患者的3年iDFS(无浸润乳腺癌的无病生存)相似,TCHP组3年EFS率达到94.2%。两组患者中,达到pCR患者的3年iDFS均优于未达到pCR的患者。结合该患者在新辅助治疗阶段取得pCR,因此建议患者在辅助治疗阶段继续双靶治疗一年,以取得最佳疗效。
另外,该患者预期需要进行术后辅助放疗,手术选择了右乳癌改良根治术+Ⅰ期背阔肌联合假体乳房重建术,有待进一步研究证实其利弊。在术前需要与患者及家属充分沟通。
【1】Gianni L, Pienkowski T, Im YH, Roman L, Tseng LM, Liu MC, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol 2012;13(1):25-32.
【2】Schneeweiss A, Chia S, Hickish T, Harvey V, Eniu A, Hegg R, et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol 2013;24(9):2278-84.
【3】Shao ZM, Pang D, Yang HJ, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive early or ocally advanced breast cancer in the neoadjuvant setting: Efficacy and safety analysis of a randomized phase Ⅲ study in Asian patients(PEONY). 2018 SABCS. Abr P6-17-17.
【4】Sara Hurvitz et al. Neoadjuvant trastuzumab (H), pertuzumab (P), and chemotherapy versus trastuzumab emtansine (T-DM1) and P in human epidermal growth factor receptor 2 (HER2)-positive breast cancer (BC): Final outcome results from the phase III KRISTINE study. 2019 ASCO Annual Meeting, abs 500.












 苏公网安备32059002004080号
苏公网安备32059002004080号


