
第76例
炎性乳腺癌(Inflammatory breast cancer,IBC)是一种少见的侵袭性乳腺癌,在美国约占乳腺癌人群的1%~6%。炎性乳腺癌和常见的导管型乳腺癌相比,多为HR阴性、HER2阳性型。目前越来越多的证据表明:和非炎性型局部晚期乳腺癌相比,IBC病人预后更差。本文分享一例炎性乳癌的诊疗历程,探讨HR-/HER2+炎性乳癌的诊疗思路。

青岛市中心医院乳腺医学中心主治
山东省抗癌协会乳腺癌专业委员会青年委员青岛市抗癌协会乳腺癌专业委员会委员
病史简介
患者女性,60岁,绝经年龄55岁。既往史、个人史、家属史均无殊。
2015年9月,因:发现右乳皮肤红肿1月,抗炎治疗无效伴红肿范围迅速增大”就诊。
专科查体:右乳红肿,皮温高。橘皮征,乳头内陷固定。局部可触及质硬肿物,约3cm×3cm大小,活动度差。右腋下可触及肿大淋巴结。余体查无特殊。
辅助检查:完善乳腺和淋巴结穿刺,病理提示:(右乳)浸润性癌,组织学Ⅲ级,免疫组化:ER(-),PR(-),HER2(3+),Ki67(40%+)。(右腋下淋巴结)低分化癌浸润。完善全身骨扫描(2015年9月30日):颈椎、第5腰椎考虑良性病变可能性大,请随访。心脏彩超提示:肺动脉瓣轻度反流。未行胸、腹、盆强CT及颅脑MR增强检查评估基线水平。
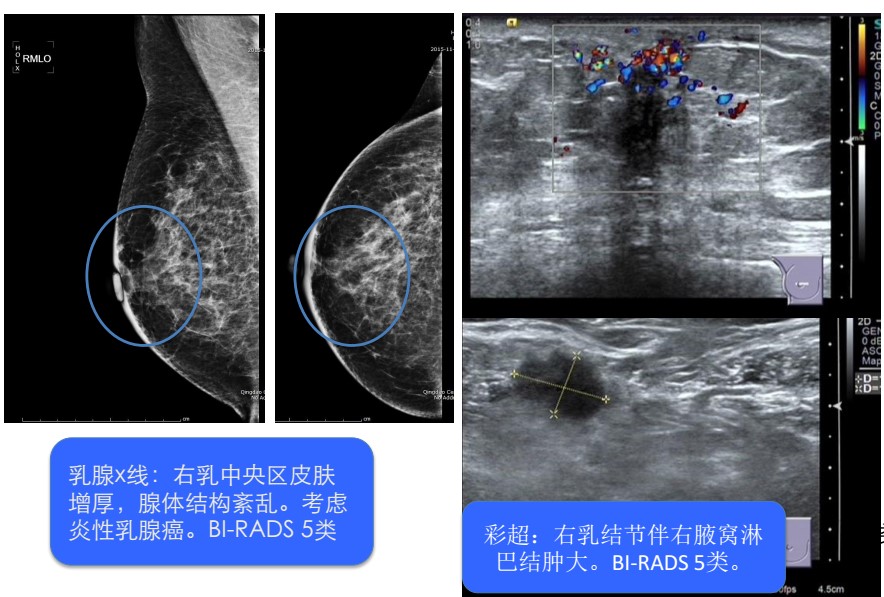
图1 乳腺X线与超声影像
初步诊断:右乳炎性乳腺癌伴右腋窝淋巴结转移(cT4dN1M0,ⅢB期,HR-/HER2+)
新辅助治疗
2015年9月,予以TEC方案新辅助治疗4周期,具体用药方案为:多西他赛120mg+表柔比星120mg+环磷酰胺0.8g。因个人原因未联合抗HER2靶向治疗,3周期后综合疗效评价为部分缓解(PR)。
主要不良反应:Ⅲ度骨髓抑制,II度胃肠道反应,I度神经毒性等。患者依从性较差,新辅助治疗3周期后中断治疗3个月。
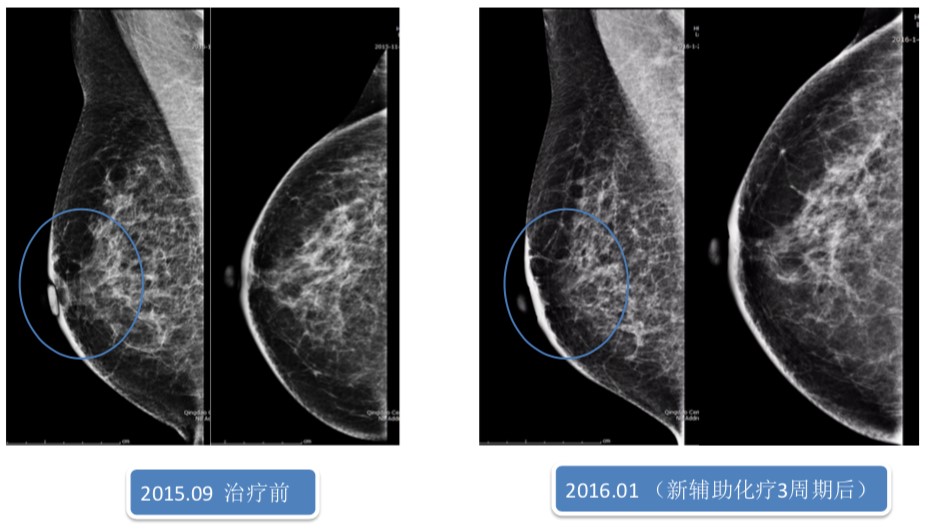
图2 新辅助治疗前后乳腺X线影像学表现
第一次疾病进展
2016年3月,患者再次就诊,肝功能:ALT 304U/L;AST 234U/L。患者自诉曾行 “理疗”。腹部CT(图3)提示:肝内多发低强化结节灶,考虑转移灶可能。PET-CT提示:右乳腺皮肤增厚并乳头下方片条影,无明显FDG代谢活性;肝多发转移并肿瘤活性。
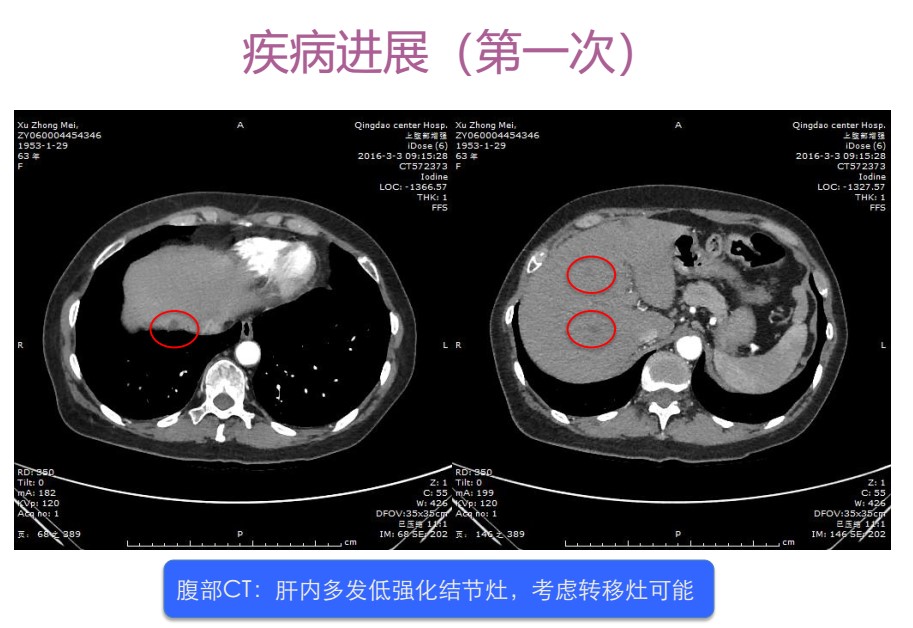
图3 腹部CT(2016年3月)
一线治疗
2016年3月起行曲妥珠单抗(首剂8mg/kg+维持6mg/kg)+卡培他滨(2.0g bid po d1-14)治疗。治疗副反应:轻度手足综合征,监测心肌标志物及心脏彩超,无明显心脏毒性。治疗4个月后疗效评估:SD。随后曲妥珠单抗维持治疗1年至2017年3月,疾病控制稳定,后因费用问题患者拒绝继续行曲妥珠单抗靶向治疗。
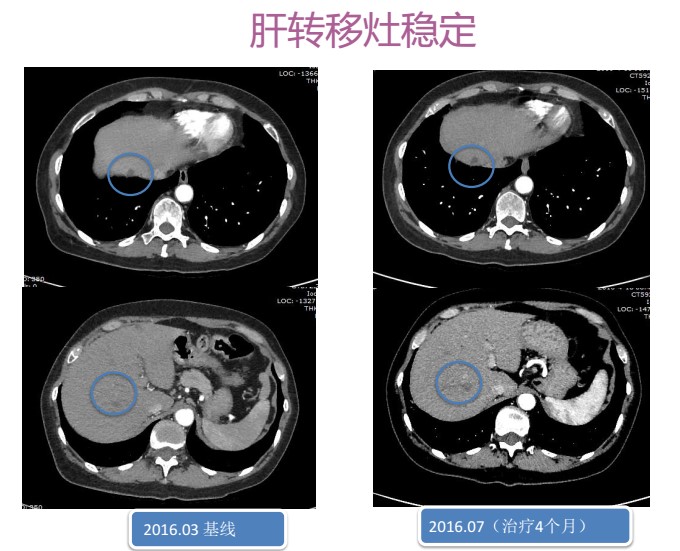
图4 腹部CT显示肝脏转移灶变化
第二次疾病进展
2017年9月患者因出现“头痛,下肢活动障碍”等症状再次就诊,头颅MR增强提示:右额叶占位,考虑转移瘤。
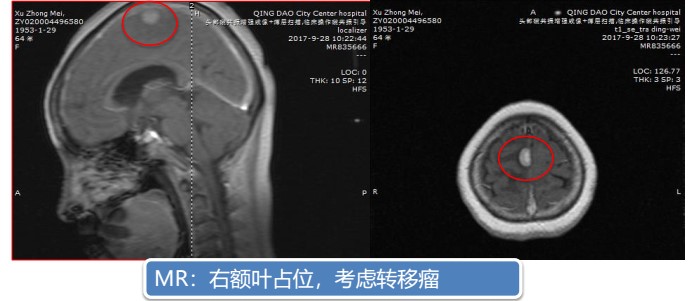
图5 头颅MRI(2017年9月)
颅脑进展后治疗:局部在神经外科行“头部伽玛刀治疗”——50%等剂量曲线,周边剂量1650cGy,共4个靶点,分3次照射。每次550cGy,隔日进行。2017年9月—至今,继续予以曲妥珠单抗靶向治疗。定期复查,颅内病灶消失。肝脏CT影像(2019年3月):右乳癌化疗后,肝转移治疗后,显示右乳癌皮肤增厚并乳头下方片条影,肝实质密度欠均匀,肝多发囊肿。乳腺原发灶彩超见图7。肝转移灶、颅内转移灶完全缓解,无新发病灶出现。综合疗效评价:CR。目前曲妥珠单抗持续抗HER2治疗中。
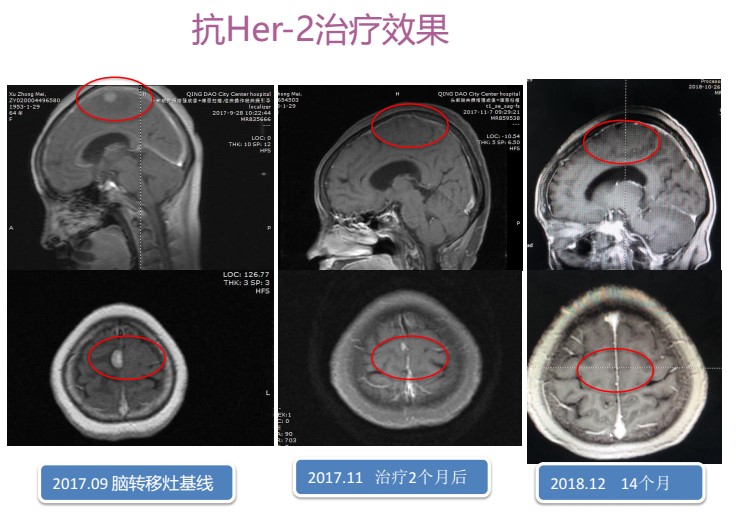
图6 抗HER2治疗颅内病灶的变化
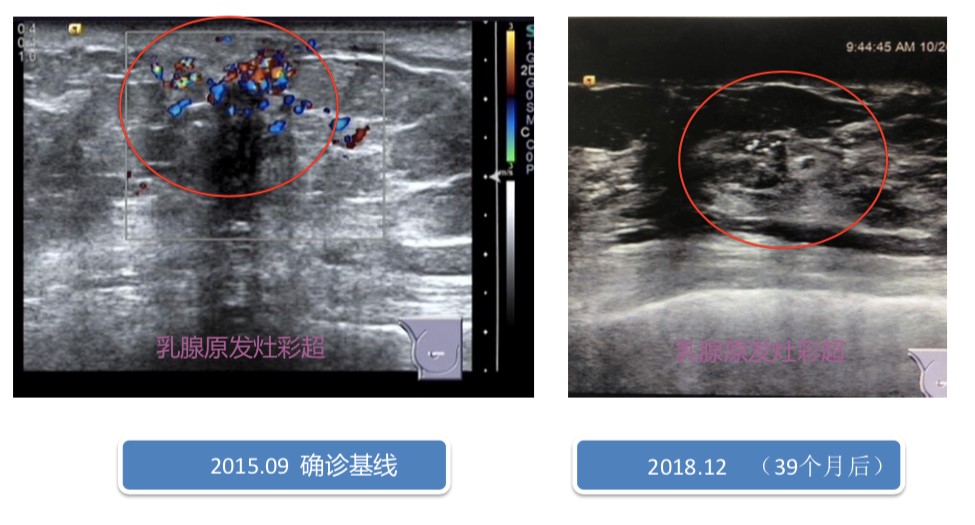
图7 抗HER2治疗乳腺病灶超声变化
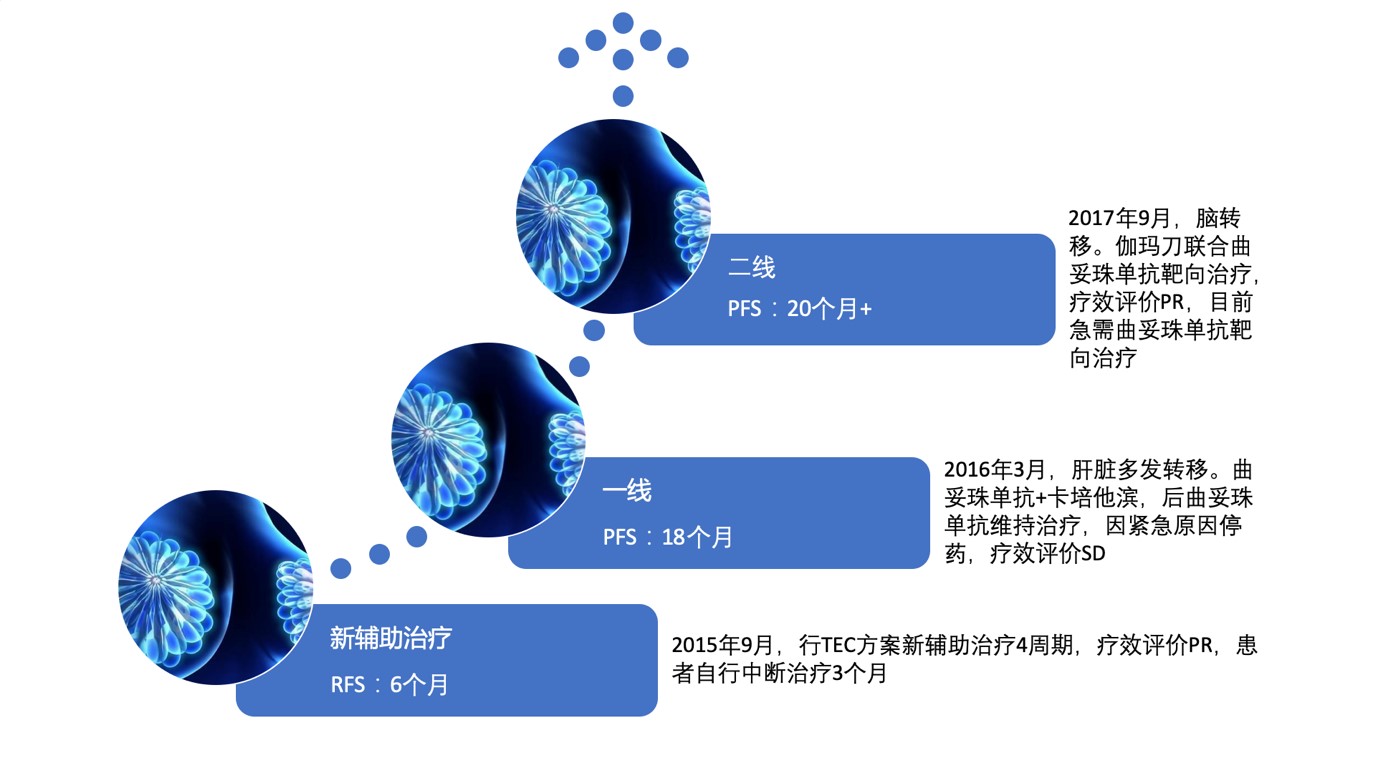
图8 患者治疗历程
点评专家

中山大学附属肿瘤医院内科
中国临床肿瘤学会(CSCO)青委会委员
广东省胸部肿瘤防治委员会乳腺癌专业委员会委员兼秘书长
中国南方肿瘤临床研究协会(CSWOG)青委会常委
广东省医学教育协会肿瘤学专业委员会常委委员
广东省中西医结合学会乳腺病专业委员会委员
广东省药学会乳腺科用药专家委员会委员
点评
患者为中老年女性,发病年龄60岁,已绝经。结合查体、辅助检查、穿刺病理结果,初始诊断为右乳炎性乳腺癌伴右腋窝淋巴结转移(cT4dN1M0,ⅢB期,HR-/HER2+)。
1.关于炎性乳癌
炎性乳腺癌(Inflammatory breast cancer,IBC)是一种少见的侵袭性乳腺癌,约占乳腺癌人群的1%~6%。炎性乳腺癌是一种临床诊断,需要有皮肤红斑、真皮水肿(橘皮征)或更多的乳腺皮肤改变。炎性乳腺癌与常见的导管型乳腺癌相比,多为HR阴性、HER2阳性型。按照AJCC第7版肿瘤分期手册,根据淋巴结转移程度以及是否存在远处转移,IBC被划分到ⅢB,ⅢC或IV期乳腺癌。按照定义,即使没有明显的乳腺肿块,IBC也被划分为T4d。在放射影像学上,可观察到局部乳腺皮肤增厚,在某些病例中还可以看到患侧乳腺的肿块。尽管使用“炎症性”这个名词,IBC的临床特征主要是由癌栓导致的真皮淋巴管堵塞。虽然活检在评估乳腺组织和真皮淋巴管是否存在肿瘤细胞是需要的,但IBC的诊断主要依赖于临床表现,侵犯真皮淋巴管也不是诊断IBC的充分必要条件。IBC的鉴别诊断包括乳腺炎和蜂窝织炎。
既往IBC常常被划分为局部晚期乳腺癌。目前越来越多的证据表明:和非炎性型局部晚期乳腺癌相比,IBC病人发病年龄更轻且预后更差。
2.炎性乳癌预后更差,亟需更为完善的诊疗
对于没有远处转移(stage T4d,N0~3,M0)的临床/病理诊断为IBC的患者,需要通过MDT讨论对其分期进行全面评估。病情的检查包括全面的病史、体格检查和实验室检查(包括白细胞和血小板水平)。在决定化疗方案前需对肿瘤激素受体和HER2受体的表达状态进行病理学证实。影像学检查有助于在影像学指导下的活检、明确局部区域转移及远处转移。所以怀疑IBC的女性必须行针对性双侧乳腺钼靶检查,乳腺B超也是必需的。乳腺MRI为可选检查。同时 2019V2版NCCN指南:对于临床或病理诊断为T4dN0~3M0的IBC患者,仍需根据病灶的分子分型礼来制定治疗策略。推荐首选含有蒽环类和紫杉类药物的术前化疗,若HER2阳性,应联合抗HER2靶向治疗。
结合此患者,在初始治疗前的基线评估和治疗方案选择上尚存在不足之处:①未完善双侧乳腺钼靶检查评估对侧乳腺情况。②未行胸、腹、盆CT及头颅MR评估疾病基线水平,是否初诊即存在远处转移。③在穿刺病理已明确HER2阳性的情况下术前化疗未联合抗HER2靶向治疗。④患者自行中断治疗3个月。尤其患者依从性差,自行中断治疗3个月,导致疾病进展后失去手术时机,并迅速出现疾病进展。
3. 一线治疗方案选择
该患者RFS 6个月后出现肝脏多发转移,一线治疗方案选择曲妥珠单抗联合卡培他滨,后续单药曲妥珠单抗维持治疗1年,该方案的选择值得商榷。众所周知,对于HER2阳性晚期乳腺癌,H0648g和M7701研究【1~2】确立了曲妥珠单抗联合紫杉类一线标准治疗的地位。HERNATA研究【3】证实曲妥珠单抗联合长春瑞滨也能取得相似疗效。2019年ASCO大会上CLEOPATRA研究【4】公布了8年的随访结果:曲妥珠单抗+帕妥珠单抗+多西他赛 vs曲妥珠单抗+多西他赛,中位OS最长(57.1个月 vs 40.8个月),PFS也有明显获益(18.7个月 vs 12.4个月),其8年OS率为37% vs.23%。也就是说双靶联合化疗可使超过1/3的HER2阳性晚期乳腺癌患者的生存期达到8年余,再次证实了HER2阳性晚期乳腺癌一线双靶治疗能够使患者获得长期生存。除此之外,CHAT研究【5】证实,对于能够耐受双药化疗的患者,HTX方案较HT方案在PFS上有获益(17.9个月 vs 12.8个月),尤其是考虑后续维持治疗的患者。结合此患者的治疗方案选择,结合患者疗效和耐受性,优先选择抗HER2双靶方案联合化疗。患者已经出现肝脏转移病灶,结合目前指南及共识,患者应该在一线治疗取得疾病控制的前提下进行维持治疗,而患者在维持治疗一段时间后自行中断治疗,再次体现其依从性不佳。而本例患者TEC方案停药不到半年,即出现多发肝脏病灶,后续化疗药物可以不考虑选择紫杉类化疗药物,卡培他滨是可选择的方案。
4.二线治疗方案的选择
患者曲妥珠单抗维持治疗1年后因经济原因停药,一线PFS18个月后出现颅脑单发转移而颅外病灶控制稳定。根据2019年CSCO BC指南对于乳腺癌脑转移的治疗:对于1~3个脑转移病灶的患者,如颅外疾病控制良好,KPS评分超过60分,I级推荐行手术切除(1A),术后残腔部位行SRS。如不能手术病灶,考虑行SRT(1B)。HER2阳性患者可以考虑药物治疗(2B)。此患者立即接受了“伽马刀局部治疗”,符合治疗原则和规范。
此外,对于HER2阳性复发转移乳腺癌曲妥珠单抗治疗进展后,需要根据患者既往治疗判断后续方案选择:如果既往治疗有效,因为毒性或经济原因停药,则优先考虑继续使用曲妥珠单抗,可考虑换用其他化疗药;如果在曲妥珠单抗治疗中进展,则优先考虑更换抗HER2靶向药物。而对于HER2阳性晚期乳腺癌治疗过程中出现脑转移,如果颅外病灶未进展,经有效的脑转移局部治疗后,应继续抗HER2靶向治疗。此患者既往曲妥珠单抗治疗有效,因经济原因停药,颅脑进展行局部治疗后继续曲妥珠单抗靶向治疗,符合治疗规范。
该HER2阳性型炎性乳腺癌患者在整个治疗过程中虽有部分欠妥之处,但在后续的曲妥珠单抗持续抗HER2治疗中获益,肝脏和颅脑病灶持续CR,获益显著,再次证明持续抗HER2靶向治疗的重要性。
【1】Kataoka K, Tokunaga M, Mizusawa J, et al. A randomized Phase II trial of systemic chemotherapy with and without trastuzumab followed by surgery in HER2-positive advanced gastric or esophagogastric junction adenocarcinoma with extensive lymph node metastasis: Japan Clinical Oncology Group study JCO[J]. Japanese Journal of Clinical Oncology, 2015, 45(11):1082-1086
【2】 Slamon D J, Leylandjones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2.[J]. N Engl J Med, 2001.
【3】Andersson M, Lidbrink E, Bjerre K, et al. Phase III randomized study comparing docetaxel plus trastuzumab with vinorelbine plus trastuzumab as first-line therapy of metastatic or locally advanced human epidermal growth factor receptor 2-positive breast cancer: the HERNATA study.[J] .J. Clin. Oncol., 2011, 29: 264-71.
【4】End-of-study analysis from the phase III, randomized, double-blind, placebo (Pla)-controlled CLEOPATRA study of first-line (1L) pertuzumab (P), trastuzumab (H), and docetaxel (D) in patients (pts) with HER2-positive metastatic breast cancer (MBC). 2019 ASCO,abs1020.
【5】Wardley Andrew M,Pivot Xavier,Morales-Vasquez Flavia et al. Randomized phase II trial of first-line trastuzumab plus docetaxel and capecitabine compared with trastuzumab plus docetaxel in HER2-positive metastatic breast cancer.[J] .J. Clin. Oncol., 2010, 28: 976-83.












 苏公网安备32059002004080号
苏公网安备32059002004080号


