ALK重排在NSCLC(非小细胞肺癌)中的发生率约为3%~7%,多见于腺癌、不吸烟或轻度吸烟者。在过去8年时间里,对于ALK重排的NSCLC,获批了多个不同ALK-TKI,那么对于这类患者的治疗,如何合理的安排用药呢?在2019年ASCO年会继续教育专场上,来自美国范德比尔特大学医学中心的Leora Horn教授[1]带来了相关主题演讲——ALK重排晚期NSCLC的治疗,如何排兵布阵?

在演讲之前,Horn教授首先分享了一个病例,以此引出话题。“这是一位60岁的高加索、非吸烟女性,新诊断为Ⅳ期NSCLC,合并肺、肝脏和骨转移。肝脏活检病理为腺癌,标本进行PD-L1表达和分子检测发现,PD-L1高表达(80%),同时检测到ALK重排。对于这位患者,应该如何治疗?”
ALK重排NSCLC概述
ALK重排在NSCLC中发生率约为3%~7%,多见于腺癌、不吸烟或轻度吸烟者。目前针对ALK重排检测有多个可选方法,包括FISH、IHC和NGS。临床上,对于这类患者有多种称法,包括ALK重排、ALK融合和ALK阳性
在过去8年时间里,对于ALK重排的NSCLC,获批了多个不同ALK-TKI。2011年,第一代药物克唑替尼获批,可用于ALK重排患者的各线治疗。仅接着,在2014年和2015年,塞瑞替尼和阿来替尼分别获批用于克唑替尼进展后的患者。2017年,另一个第二代药物brigatinib也获批用于克唑替尼耐药后的患者,同年,塞瑞替尼和阿来替尼分别获批用于一线治疗。2018年11月,第三代药物lorlatinib也在美国FDA获批。
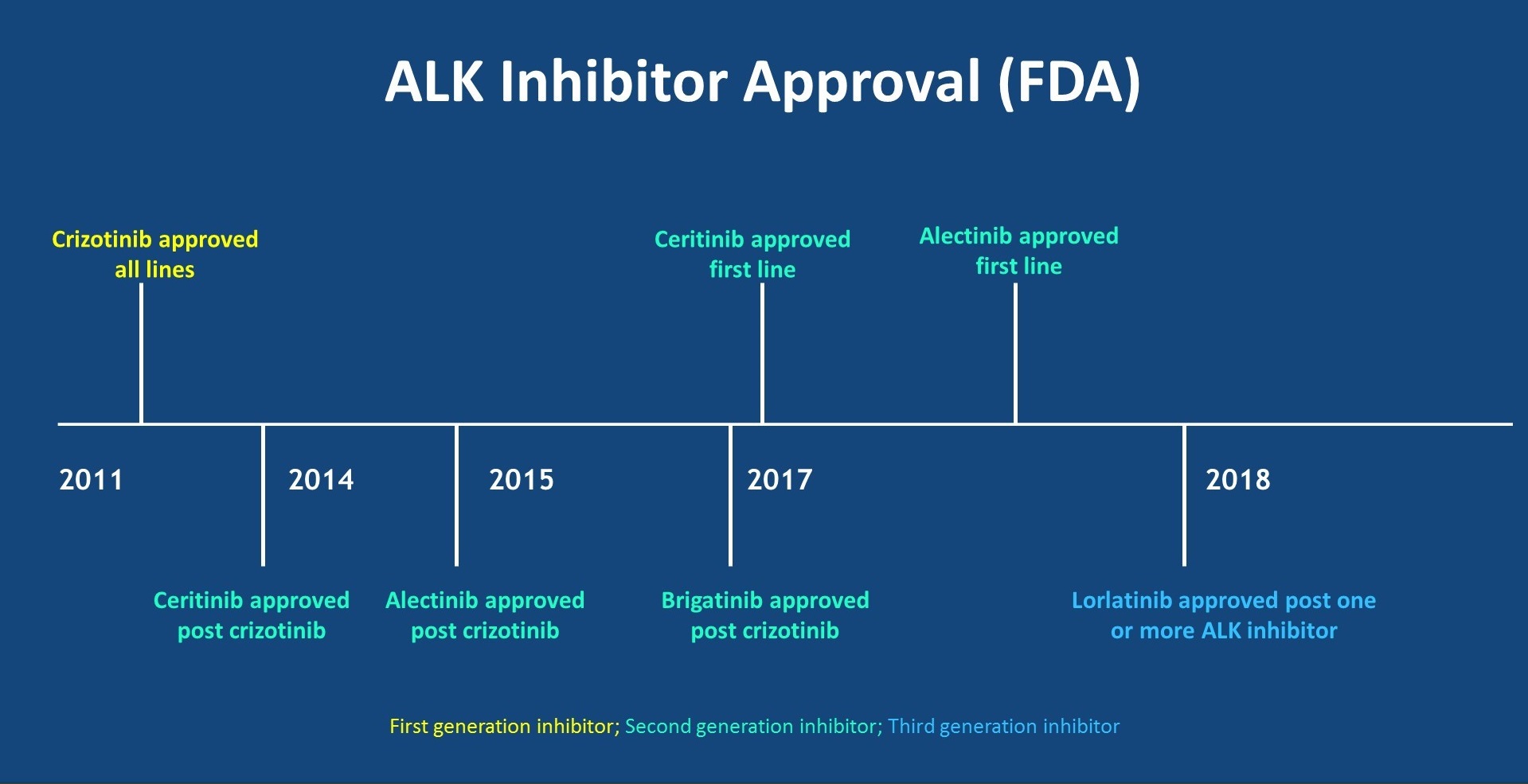
美国FDA获批的ALK抑制剂
ALK重排NSCLC,如何进行治疗选择?
鉴于目前对于ALK重排的NSCLC患者,已有多个治疗选择,在临床实践中,我们就面临着选择的困境。当然,最重要的考量因素是药物的疗效;与此同时,还需要考虑安全性以及不同药物的治疗花费。
如果是在2011年,那么便只有克唑替尼可选,主要依据是基于PROFILE 1014研究,但值得注意的是,克唑替尼获批用于ALK重排患者各线治疗是在PROFILE 1014 研究结果公布之前,因此这一研究中大多数的患者来自美国以外的其他地区。PROFILE 1014 研究结果证实,克唑替尼对比培美曲塞铂类化疗用于ALK阳性NSCLC患者的一线治疗,可以显著改善PFS(10.9个月 vs 7.0个月),提高ORR(74% vs 45%)。在2018年的ASCO大会上,Solomon 教授报道了PROFILE 1014研究OS更新结果,结果显示克唑替尼一线治疗组患者的OS有获益的趋势,但差异无统计学意义,mOS分别为尚未达到和47.5个月(HR=0.76,P=0.0978)。
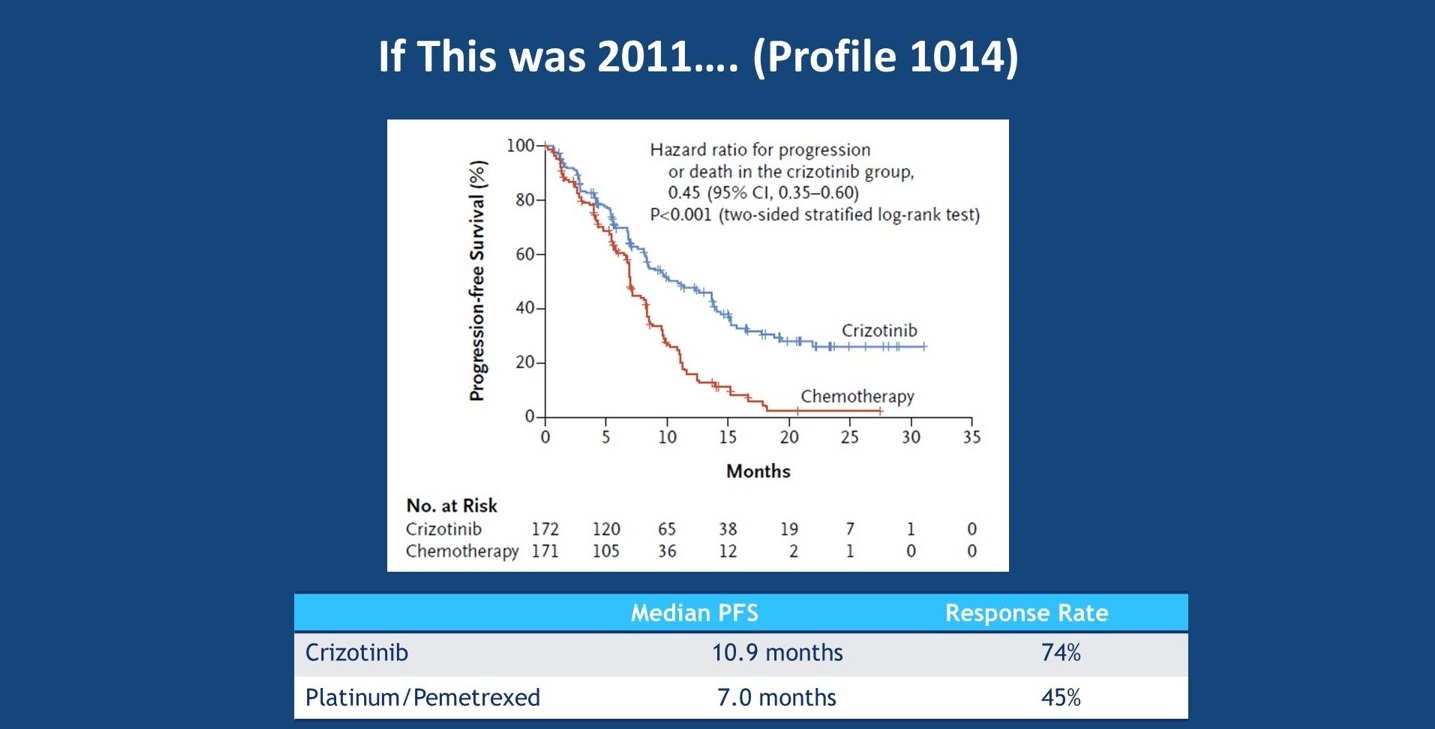
PROFILE 1014 研究
时间来到2017年春天,我们有了塞瑞替尼一线治疗的数据,即ASCEND-4研究,这一研究入组经FISH检测确认为ALK阳性的NSCLC患者,随机分配接受塞瑞替尼或培美曲塞铂类化疗,再次观察到一线ALK-TKI治疗的优势,一线塞瑞替尼对比化疗显著延长PFS,mPFS分别为16.6个月和 8.1个月(HR=0.55,P<0.0001)。这两项研究都是化疗对比ALK TKI作为ALK阳性NSCLC一线治疗的研究。两项研究的结果与EGFR突变人群的故事类似。即当发现一个治疗靶点后,可以对比靶向治疗和化疗的疗效,通常都是靶向治疗胜出。这也提示我们后续对于分子突变状态已知的患者,无需再进行类似的研究。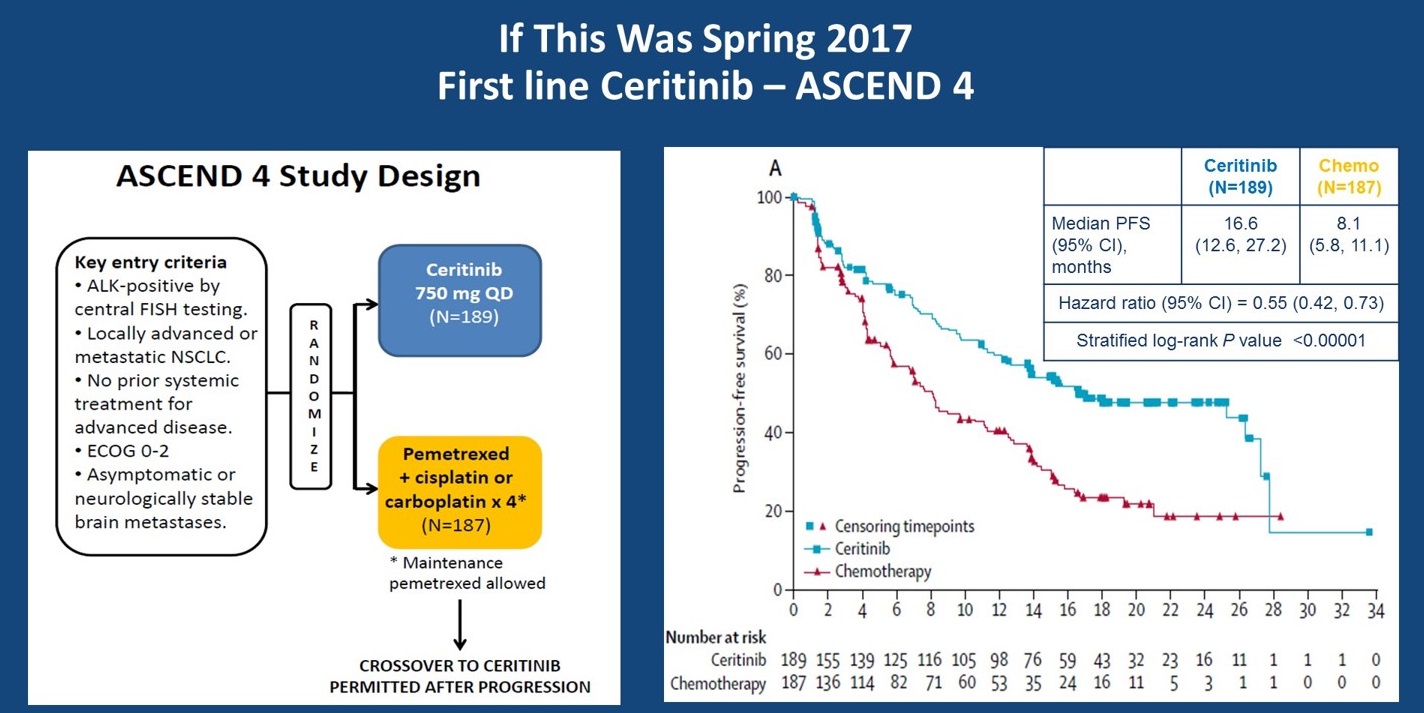
ASCEND-4研究
当时间来到2017年秋季,又是另一翻景象,全球ALEX研究结果公布。这一研究入组了经中心实验室采用IHC检测为ALK阳性的初治NSCLC患者,随机分配接受阿来替尼或克唑替尼治疗。初步的结果在2017年ASCO大会公布,结果显示阿来替尼对比克唑替尼可以显著降低疾病进展风险(HR=0.47),两组的mPFS分别为尚未达到和11.1个月。在2018年ASCO大会上,ALEX研究进一步更新了研究者评估的PFS结果,阿来替尼组和克唑替尼组的mPFS分别为34.8个月 vs 10.9个月。
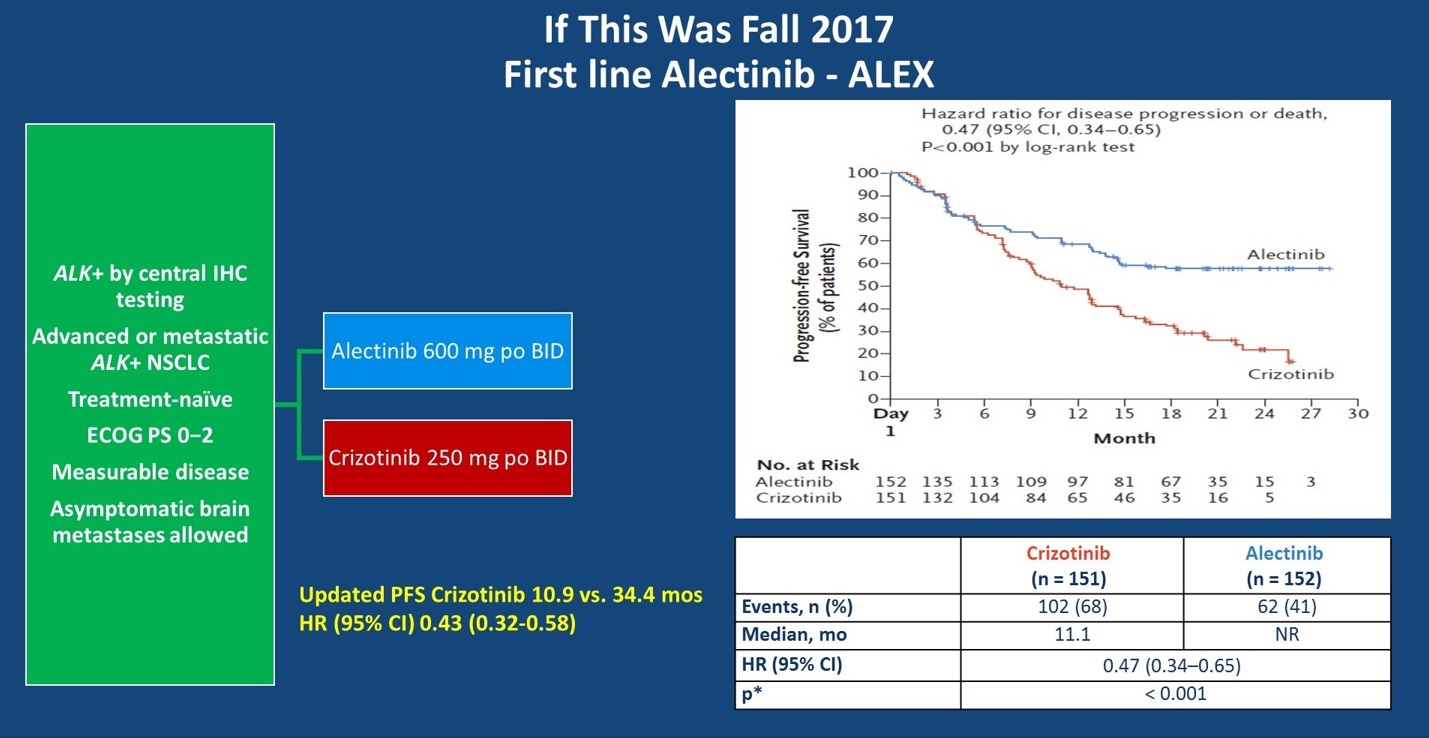
ALEX研究
在2018年9月的世界肺癌大会上,进一步公布了ALTA-1L研究的结果,即brigatinib用于ALK阳性患者一线治疗,当然目前brigatinib尚未获批一线适应证。在这一研究中,入组患者和上述研究稍有不同,在ALTA-1L研究中,患者可以由当地实验室检测为ALK阳性,后续经过了中心实验室确认,研究允许患者在入组前接受过一线系统性治疗,但不能为ALK-TKI。这一研究结果证实, brigatinib对比克唑替尼可以显著改善PFS(HR=0.49,P=0.0007),目前brigatinib组的mPFS尚未达到。
ALTA-1L研究
在接下来的几年里,我们仍然会有所期待,两项大型随机Ⅲ期临床研究已经完成入组,正在等待结果。其中eXalt3 研究评估了ensartinib对比克唑替尼,研究允许当地实验室采用FISH检测阳性的患者入组,同时允许患者可以既往接受过一线系统性治疗。另一项研究对比了lorlatinib和克唑替尼,当地实验室检测的ALK阳性患者可以入组,但要求患者既往未接受过任何治疗。
未来几年值得期待的研究
对于合并脑转移的患者,治疗又该如何选择?
如果患者基线时合并脑转移呢?ALEX研究和ALTA-1L研究均单独分析了脑转移患者的疗效。在ALEX研究中,基线合并脑转移的患者,接受阿来替尼对比克唑替尼治疗,可以取得显著更长的PFS,mPFS分别为尚未达到和7.4个月,HR=0.40,P<0.001(注:ALEX后续公布数据:mPFS分别为27.7和7.4个月,HR=0.35,P<0.001)。进一步分析在开始治疗前可能接受过放疗的患者,发现两组的PFS曲线在治疗一段时间后分开,这主要是因为阿来替尼对比克唑替尼有更好的CNS疗效,当然这也提示在基线时接受过脑放疗的患者相比于未接受放疗的患者,出现颅内进展的时间更晚。Brigatinib同样具有较好的CNS疗效,对于基线合并CNS转移的患者(HR=0.20),brigatinib对比克唑替尼显示出较好的系统性PFS,此外颅内PFS也得到显著改善(HR=0.27)。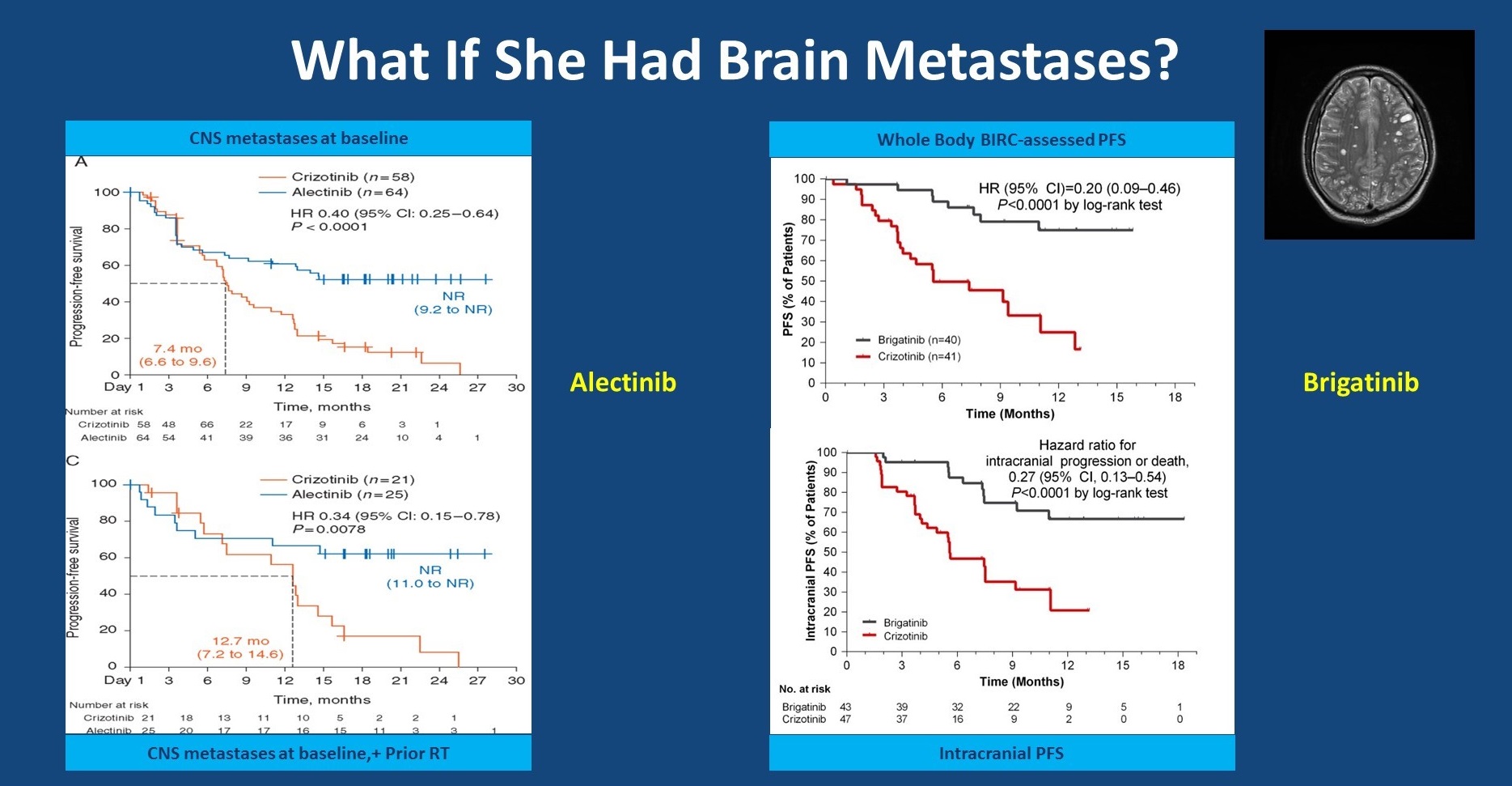
ALEX研究和ALTA-1L研究基线合并CNS转移患者的疗效数据
从疗效、安全性和治疗花费3个方面进行分析
那么对于这例患者的一线治疗,我们该如何选择呢?我们可以从疗效、安全性和治疗花费3个方面进行分析。下表总结了目前可供选择的ALK-TKI的疗效数据,从中可以看出所有药物均可以取得较好的缓解率,约为70%~80%,克唑替尼的中位PFS劣于其他的二代ALK-TKI,此外,克唑替尼的CNS有效率也较其他二代ALK-TKI更差。
进一步权衡不同药物的安全性,每个药物的安全性稍有不同,阿来替尼较独特的毒性为肌痛,brigatinib为肺炎和CPK(肌酸激酶)升高。在临床研究中,需要进行剂量减少低的患者比例,塞瑞替尼最高,但在研究采用的是塞瑞替尼750mg,口服服用,当将用药剂量调整为450mg含餐服用时,可以降低毒性。因为毒性导致剂量减低的患者比例,阿来替尼和brigatinib相似。在治疗费用对比上,各个药物均较昂贵,从塞瑞替尼的$12000/月到克唑替尼的$20000/月,当然这是来自范德比尔特大学医学中心药剂师的估价,不同供应商购买价格会有所不同,但总体而言,ALK阳性患者接受靶向治疗的费用昂贵。
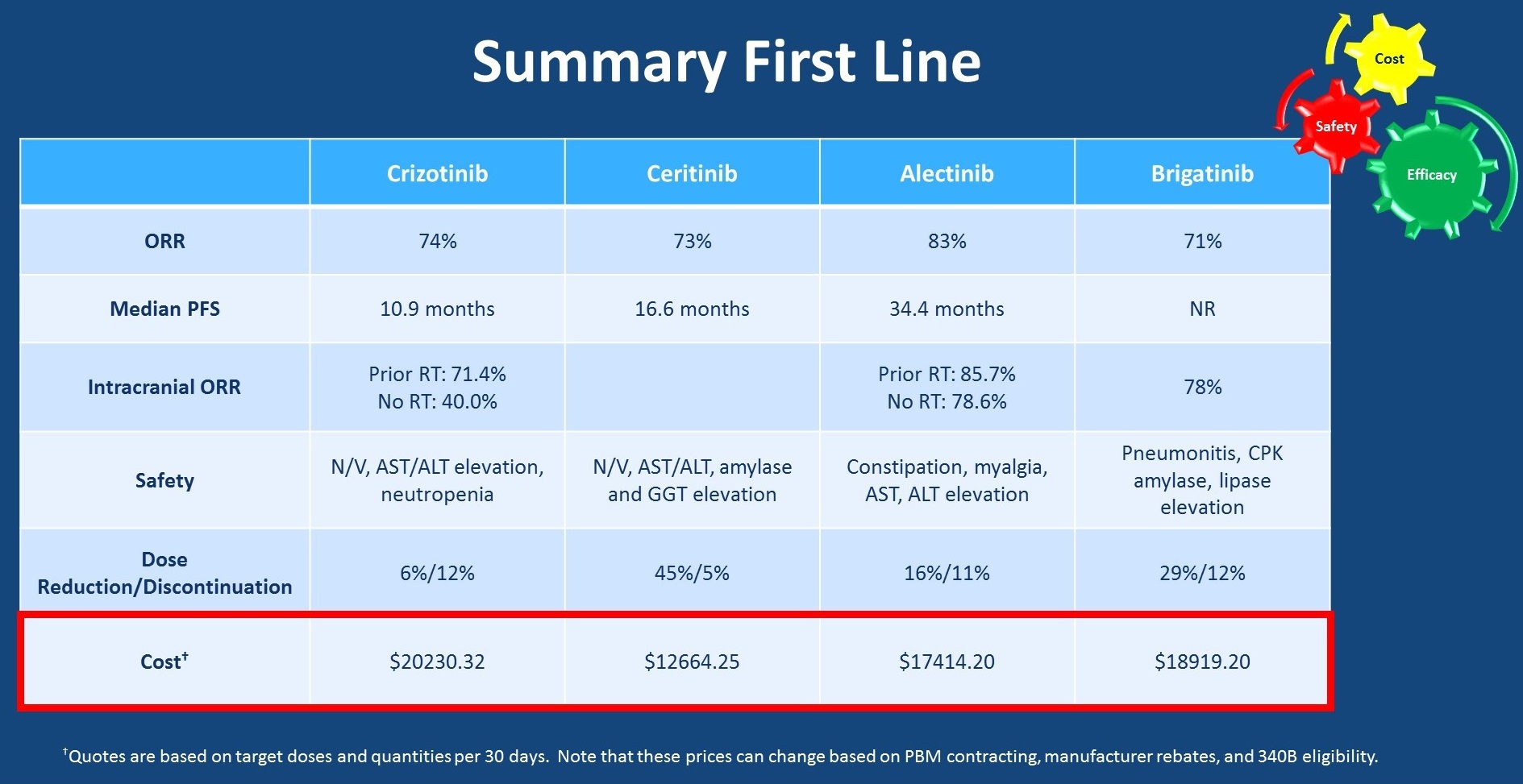
ALK-TKI一线治疗数据汇总
假设患者一线使用克唑替尼,进展后如何治疗?
如果患者一线接受了克唑替尼治疗,那么二线治疗如何选择?Ross Camidge教授对不同的新一代ALK-TKI用于克唑替尼耐药患者的疗效横向对比,包括brigatinib、lorlatinib、ensartinib、阿来替尼和塞瑞替尼。不同药物治疗的PFS存在一些差异,brigatinib和lorlatinib 用于克唑替尼耐药后的患者,相比于ensartinib、阿来替尼和塞瑞替尼具有显著更长的PFS。各个药物在不同研究中的疗效相对一致,从下图也可以看出患者的克唑替尼耐药后,我们有非常明确可以克服耐药的药物。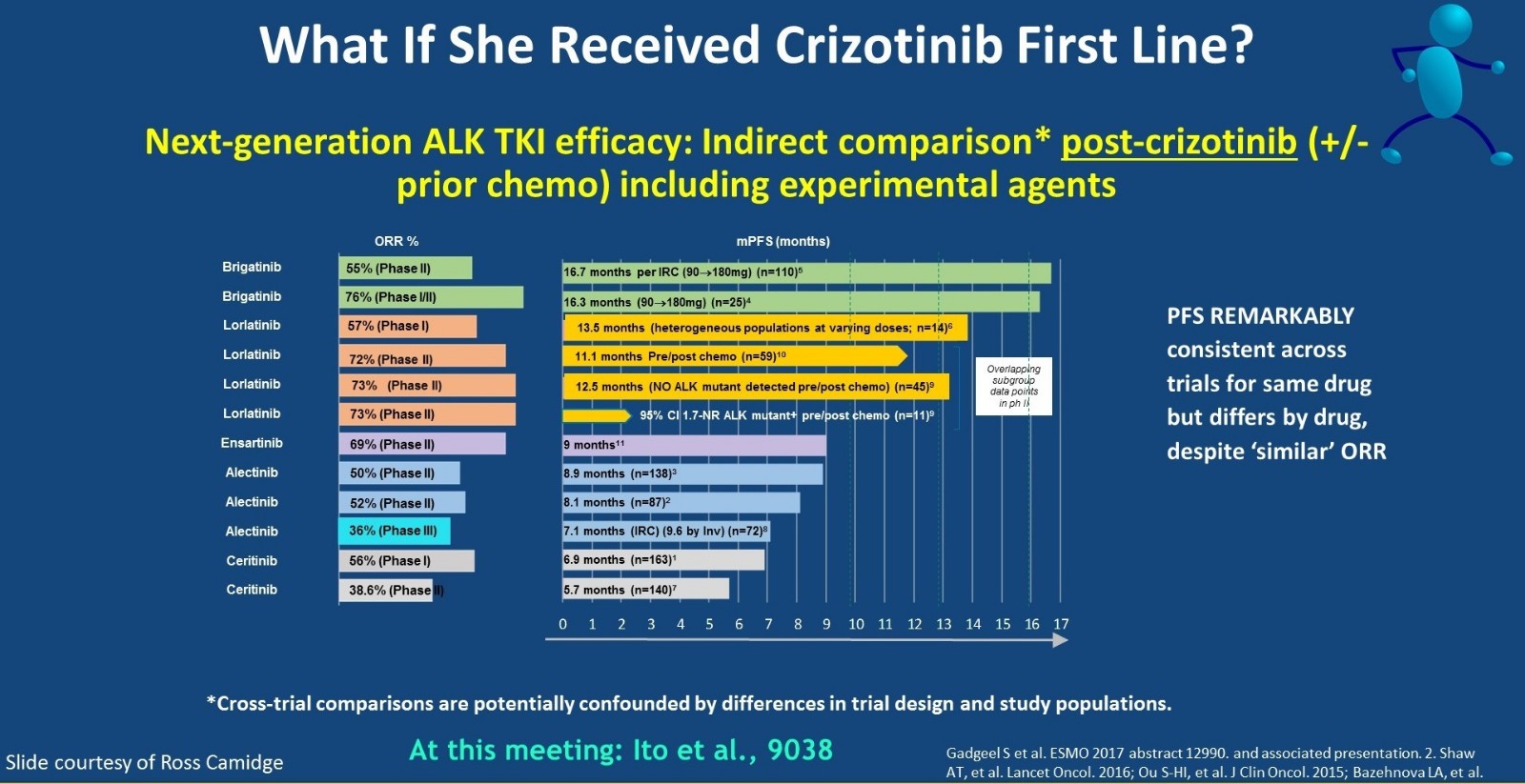
新一代ALK-TKI用于克唑替尼耐药患者的疗效对比
患者在第二代ALK-TKI治疗进展后如何治疗?
如果患者接受第二代ALK-TKI进展后,如何治疗呢?不同的ALK-TKI耐药后显示出不同的耐药机制,其中最具有挑战性的耐药机制为G1202R突变,这在第二代ALK-TKI耐药的患者中发生率更高,但lorlatinib可以有效克服这一耐药。
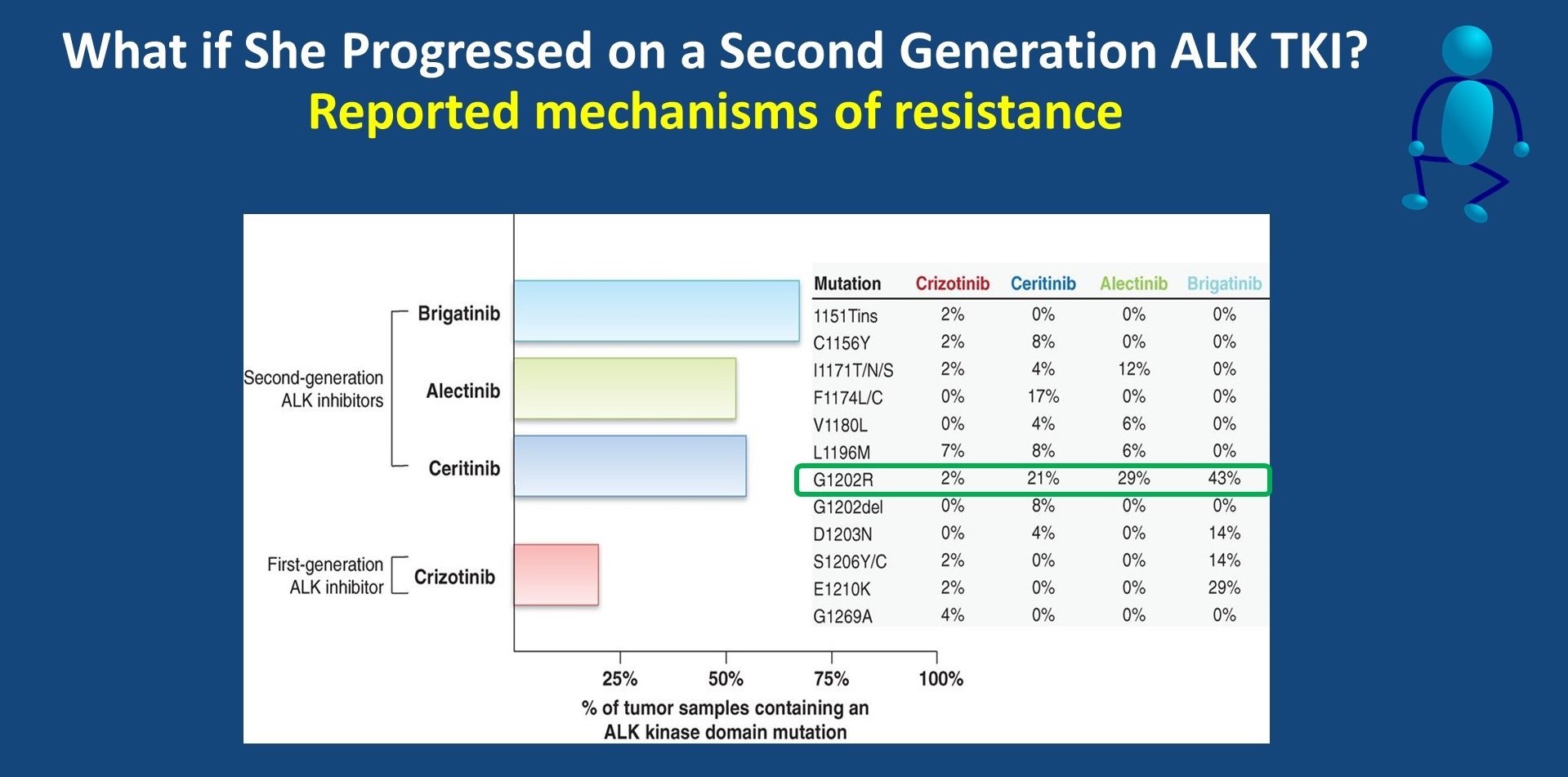
第二代ALK-TKI耐药机制总结
目前,有一些小型研究探索了第二代ALK-TKI耐药后继续使用另一个第二代TKI。如ASCEND-9研究在ALK阳性患者中评估了阿来替尼进展后,使用塞瑞替尼治疗的疗效。研究入组了20例患者,客观缓解率约为25%,中位疗效持续时间约位6个月,并不是特别长,中位起效时间位1.8个月。
ASCEND-9研究
此外,一些小型回顾性研究在ALK阳性患者中评估了阿来替尼进展后使用brigatinib,如去年发布的一项研究,入组了22例患者,ORR为17%,PFS也不是特别长,4.4个月。在数据发布时,仍有5例患者持续观察到疗效。在2019年ASCO大会上,另外2项研究评估了第二代ALK-TKI进展后,接受brigatinib治疗的疗效。此外,还有一项研究EXALT-1评估了在任意ALK-TKI耐药后,评估ensartinib的疗效,疗效结果与其他研究相似,ORR为23%左右。且从研究中可以看出,患者既往接受过的ALK-TKI越多,其接受新一代TKI治疗的疗效可能越差。在这些研究中,既往接受过2个TKI治疗的患者中观察到取得PR的患者,PD的患者多为既往接受过3个或以上TKI治疗的患者。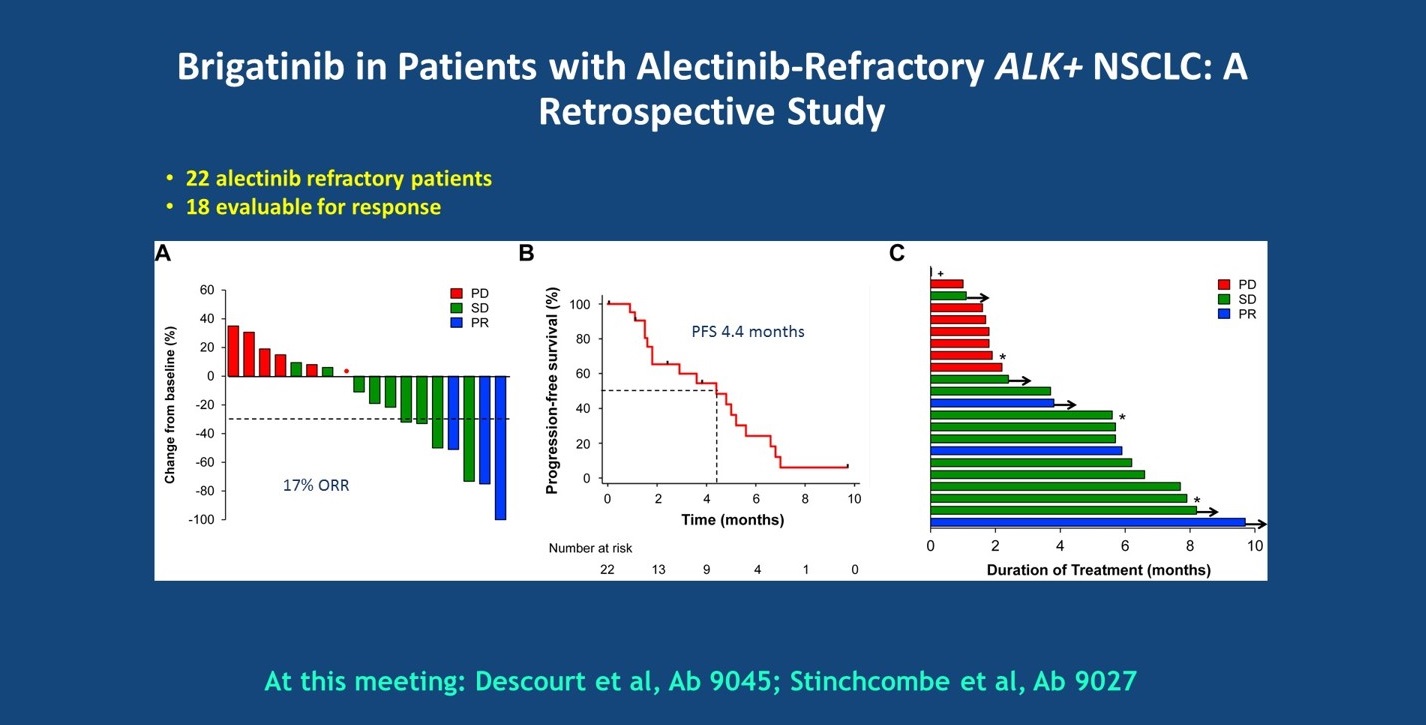
brigatinib用于第二代耐药患者
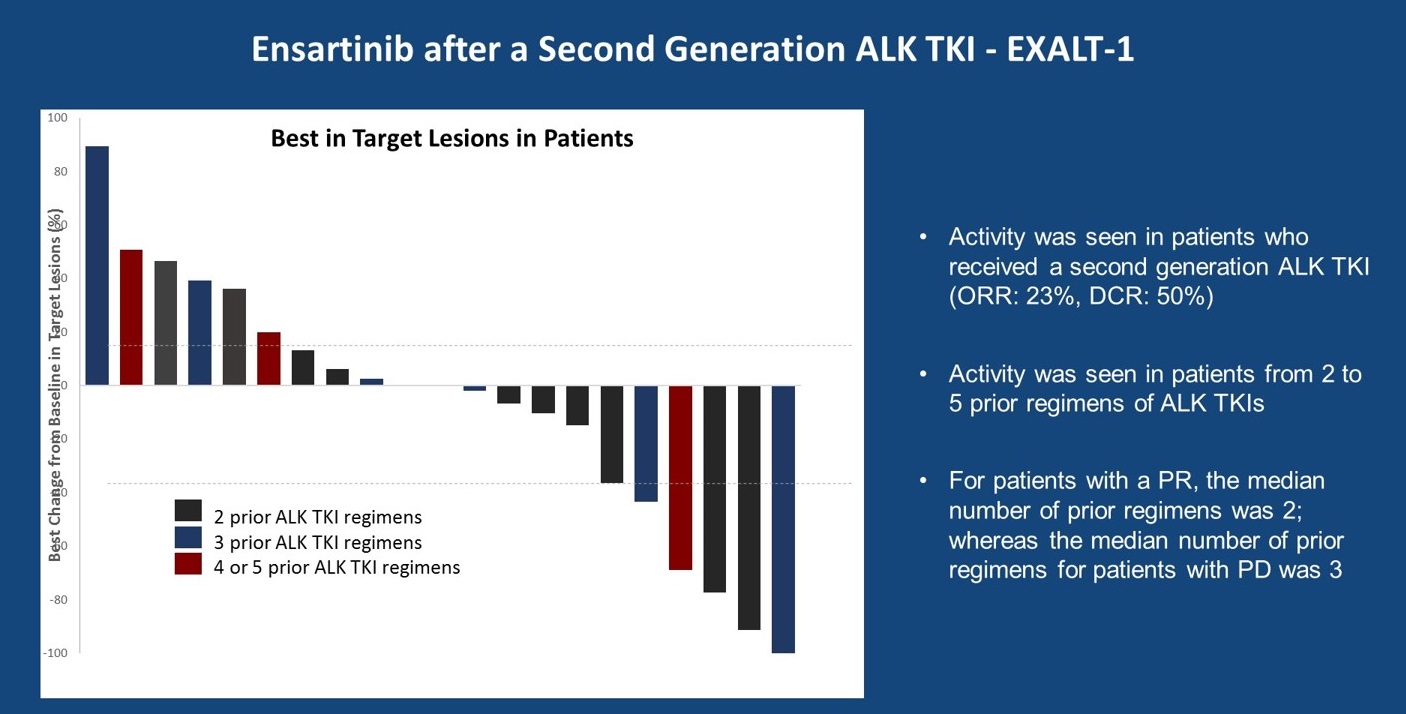
EXALT-1研究
Lorlatinib用于这类患者中的疗效如何呢?去年,lorlatinib已经获批用于既往接受过第二代ALK-TKI治疗进展的患者,来自lorlatinib 研究EXP3B、EXP4和EXP5 3个队列中超过100例患者的数据显示,lorlatinib治疗既往接受过克唑替尼或第二代ALK-TKI的患者,ORR在数值上更高,约为30%~40%。此外,PFS分析显示,不同耐药机制的患者接受lorlatinib治疗的PFS可能存在差异,如耐药后出现ALK激酶区突变的患者,可以取得较为持久的PFS,达到11个月,然而,对于那些耐药后不再依靠ALK通路驱动的患者,接受lorlatinib治疗的疗效会较差。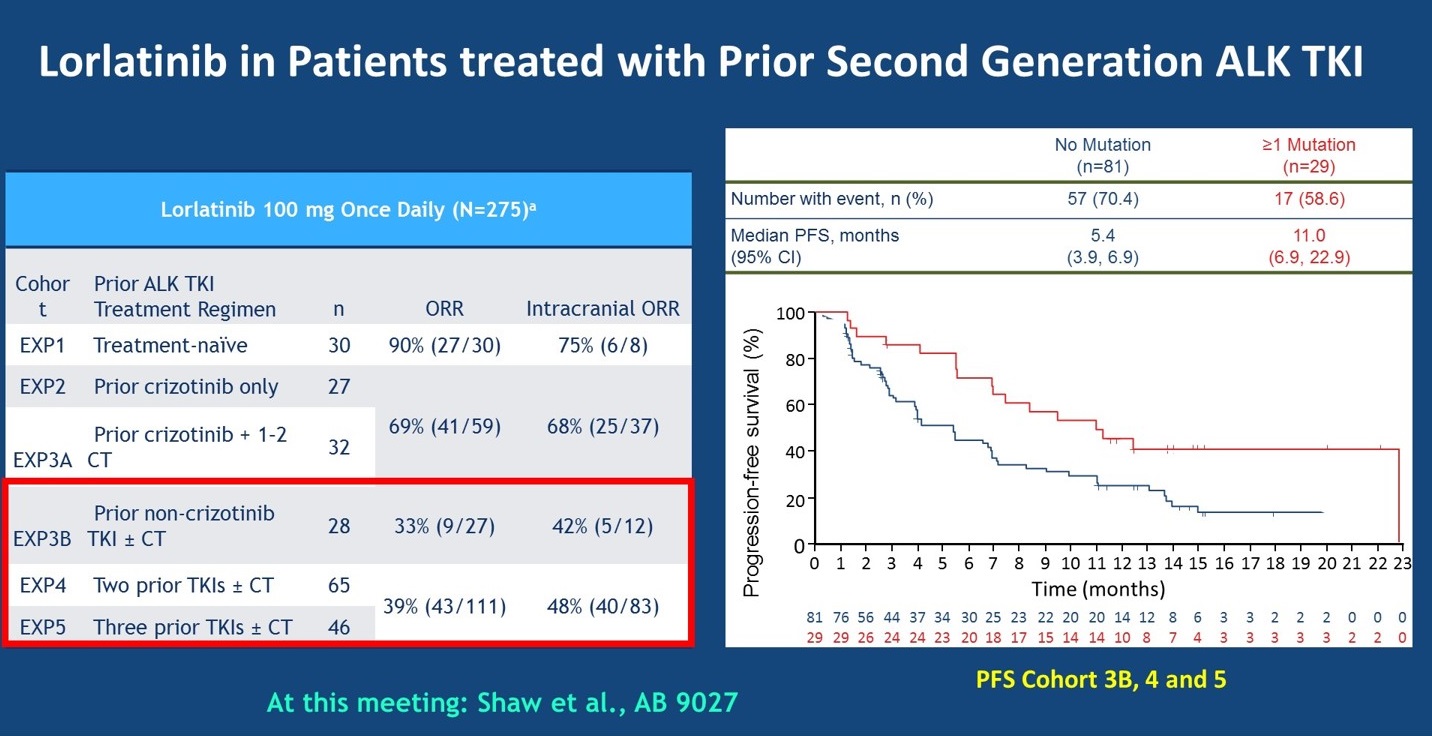
lorlatinib用于第二代耐药患者
患者每次进展后是否都需要进行耐药机制检测?
我们是否应该在每次进展后对患者进行测序呢?对于初治对患者,可以根据FISH、IHC或NGS检测的结果,推荐患者接受ALK-TKI治疗。但在患者进展时,明确患者的耐药机制则变得十分重要。下图总结了ALK-TKI耐药后的不同耐药机制,从临床前数据来看,lorlatinib似乎是最有潜力的ALK-TKI,对多个不同对耐药突变敏感。Brigatinib和ensartinib同样显示出对多个耐药突变敏感,但塞瑞替尼和克唑替尼则不同。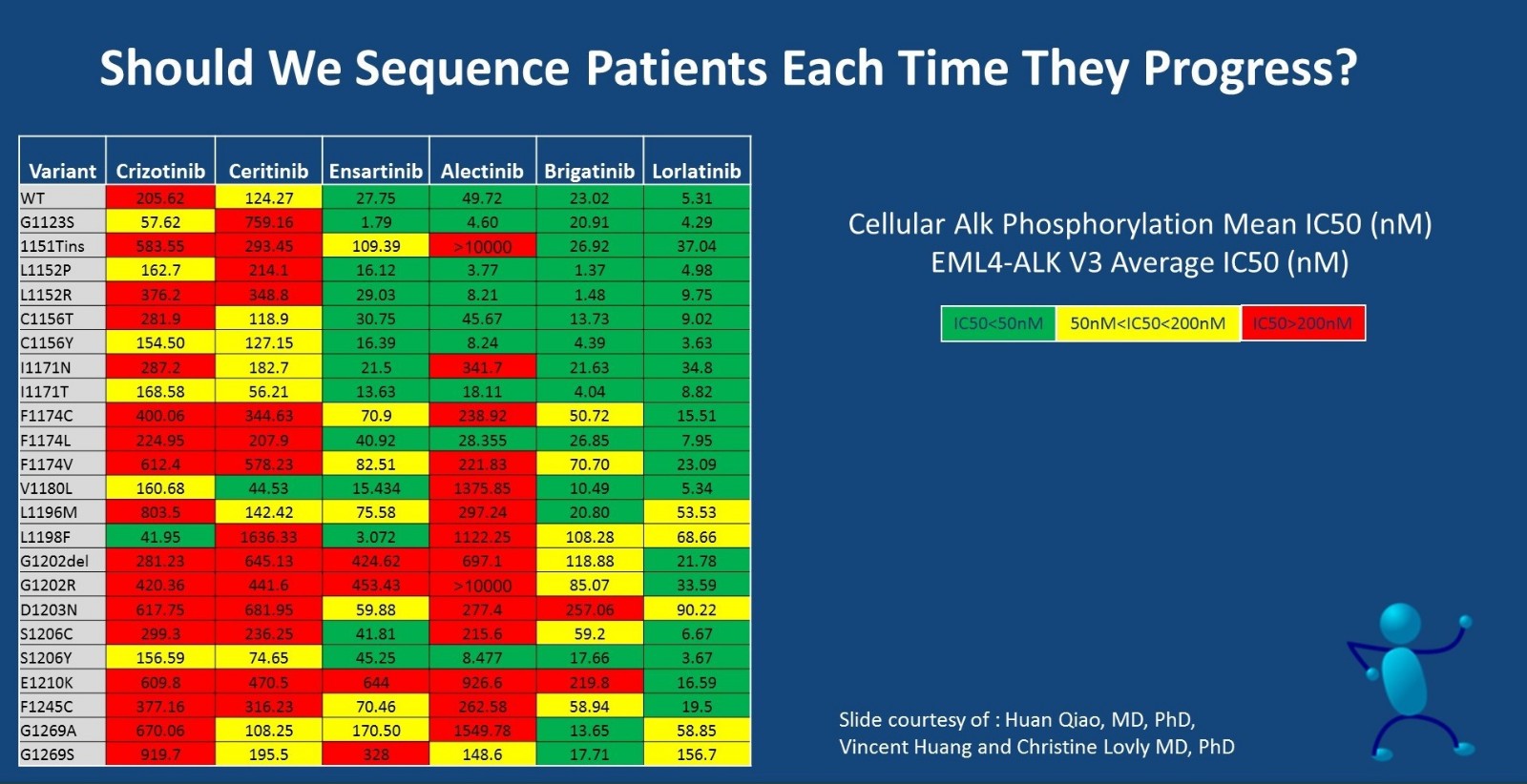
ALK-TKI对ALK激酶区不同位点突变的敏感性
(注:在2016年AACR年会上,Justin F. Gainor[2]教授公布的来自临床研究的数据中,塞瑞替尼的数据与本次ASCO大会Leora Horn和Christine Lovly教授分享的临床前研究数据有较大差异,期待未来更多的临床实践和研究来进一步验证各ALK抑制剂对不同突变位点的敏感性。)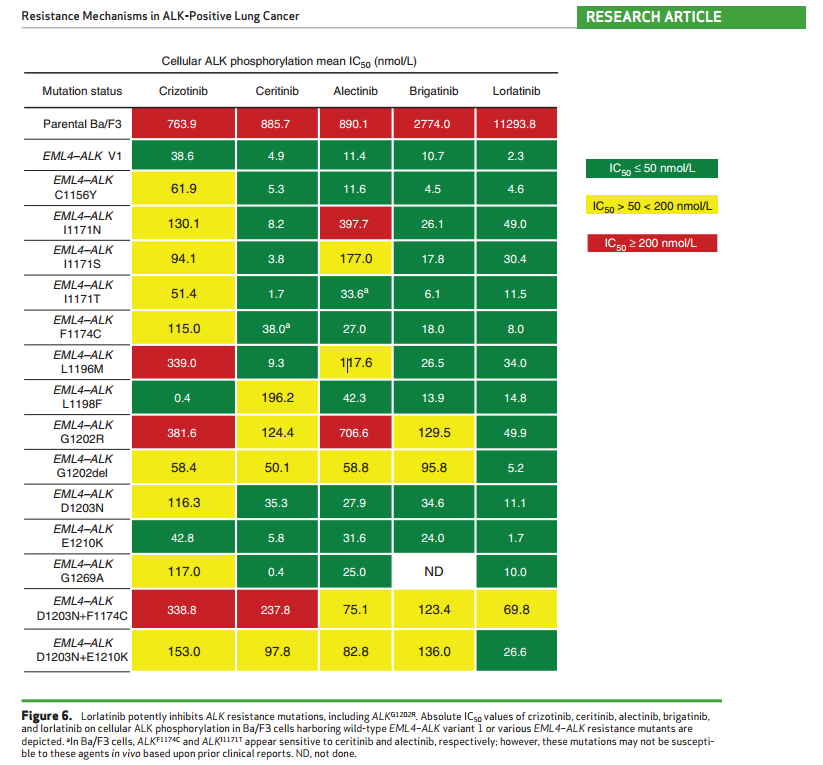
Justin F. Gainor教授研究结果(图片来源于参考文献2)
那么耐药后是选择组织标本还是选择血浆标本来进行检测呢?从eXalt1研究的探索性分析来看,FISH检测ALK阳性的患者,仅74%可以通过NGS检测到ALK突变。因此,我们不可以直接根据血浆检测的结果来治疗患者。如果患者血浆检测阴性,应该再次进行组织活检以进一步确认。此外,在eXalt1研究中,我们还发现组织和血浆NGS检测均为阴性的患者,接受ensartinib也可以取得缓解,因为这些患者FISH检测是阳性的,因此,FISH和IHC在ALK重排检测上仍然非常重要,不能仅仅依靠NGS检测的结果指导治疗。
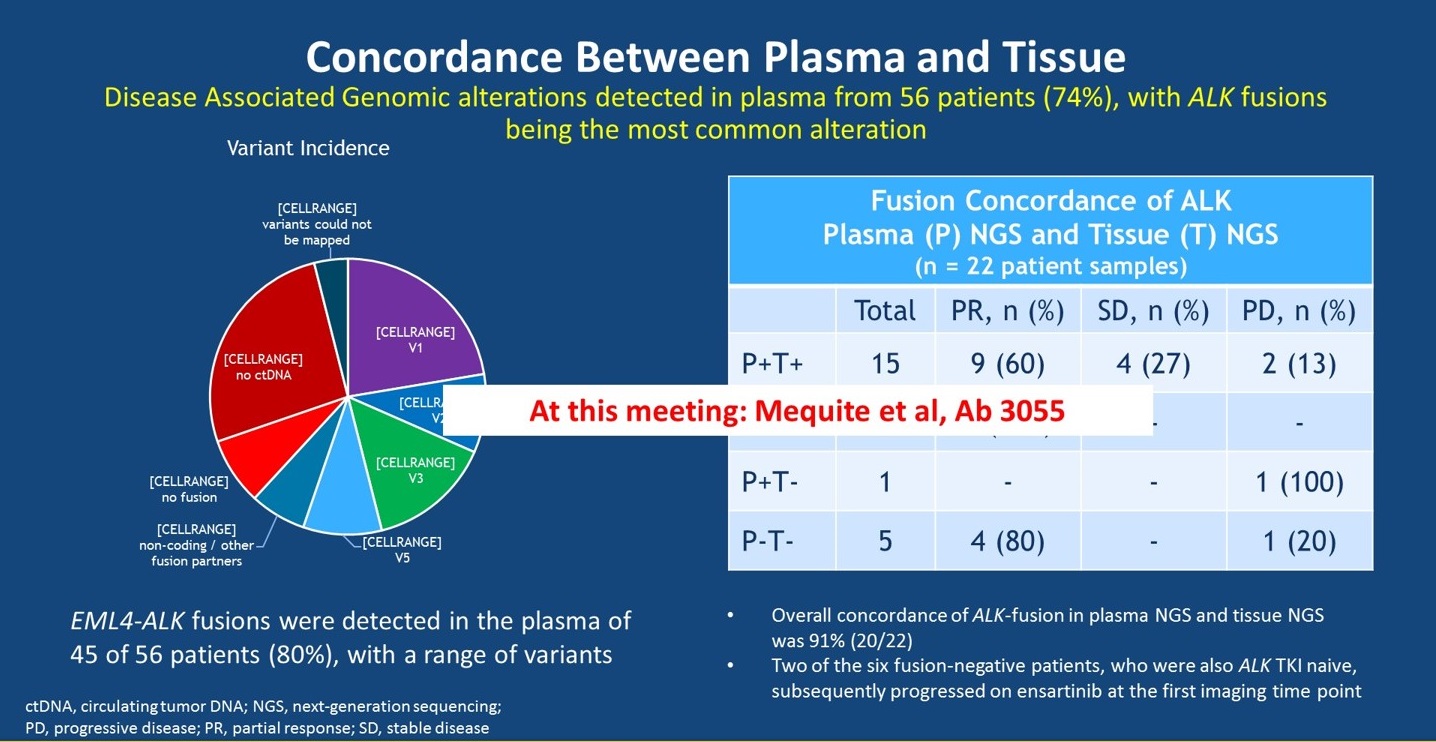
血浆与组织标本的一致性评价
如何回答第二代ALK-TKI耐药后患者的治疗选择?
从以上的研究结果中,可以给我们哪些启示呢?NCI ALK master protocol研究是否可以帮助我们回答这一问题?这是一项大型的研究,入组了第二代ALK-TKI进展后的ALK阳性患者,将根据患者耐药后的基因突变情况随机分配接受lorlatinib、塞瑞替尼、阿来替尼、ensartinib和克唑替尼。如果患者耐药后未检测到ALK耐药突变或MET变异,则随机接受另一个第二代TKI。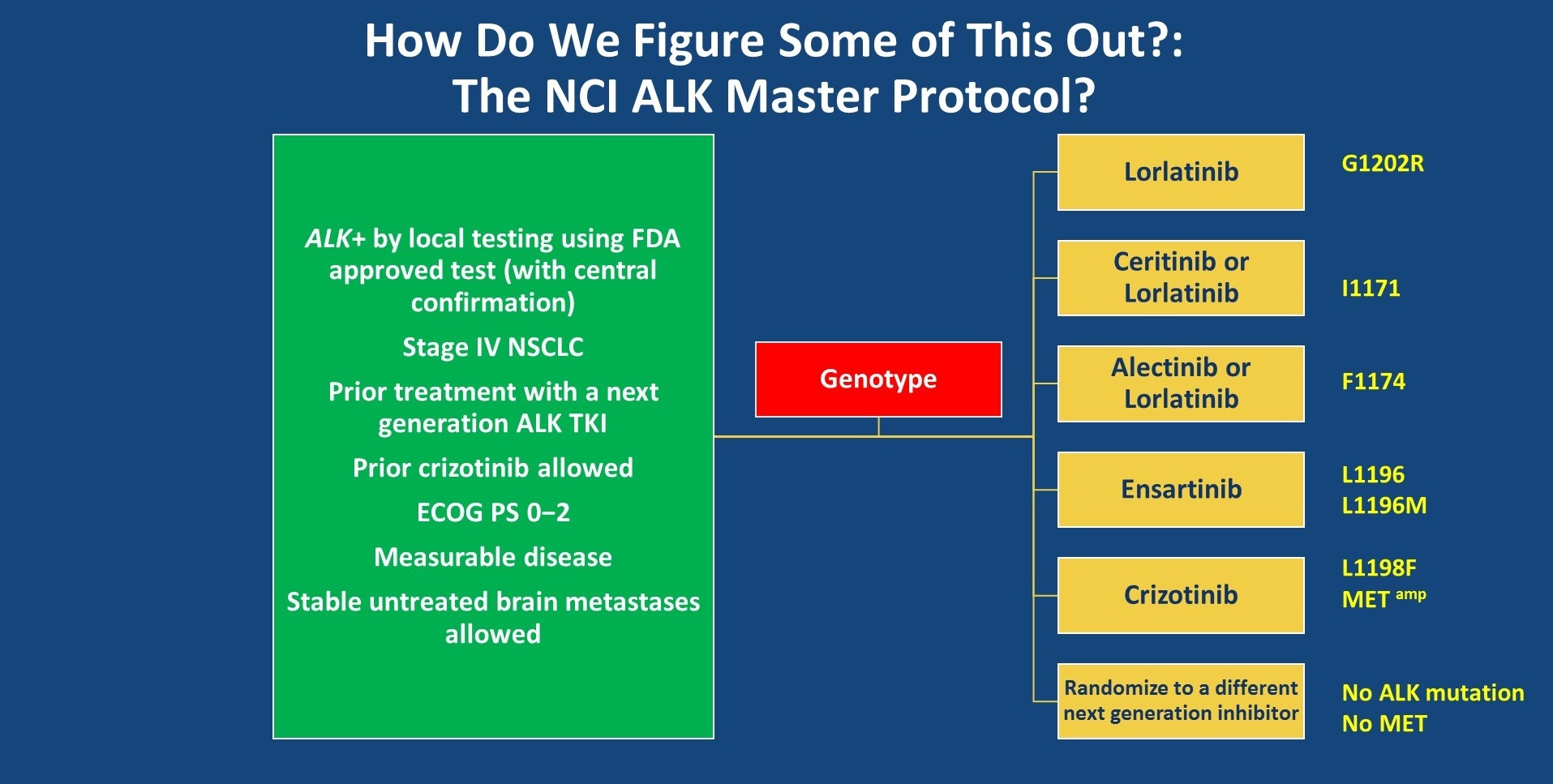
NCI ALK master protocol研究
是否已经解决当前治疗的困境?
如开头介绍道,这例患者为PD-L1高表达(80%),那么这位患者是否应该介绍免疫检查点抑制剂治疗?答案是否定的。既往Dana-Farber癌症中心发表了一项研究,评估了EGFR和ALK阳性患者中PD-L1表达状态及其接受免疫治疗的疗效,结果显示,在ALK阳性的患者中,有26%的患者为PD-L1高表达(≥50%)。但相比于野生型患者,这类患者接受免疫检查点抑制剂治疗的有效率较低,小于5%。因此,对于这位患者的治疗,ALK重排较PD-L1表达在一线治疗选择中更为重要。
从目前的研究数据来看,第二代ALK-TKI相比于克唑替尼,疗效更优,但目前所有头对头比较的研究均仅报道了PFS结果,后续仍需要继续观察这些研究的OS结果。患者在接受ALK-TKI治疗耐药后,应该进行活检评估耐药机制,进而选择后线治疗。当患者对ALK-TKI治疗不再有效时,是否应该选择化疗或免疫检查点抑制剂仍值得考虑。此外,在进行一线治疗选择时,我们需要考虑药物的安全性,尤其是从患者本身的状态去考量,如合并间质性肺炎的患者,我们需要谨慎使用brigatinib,因为其可能引发肺炎。最后,药物的治疗花费同样需要考虑,当然,并不是最便宜的药物会最终胜出。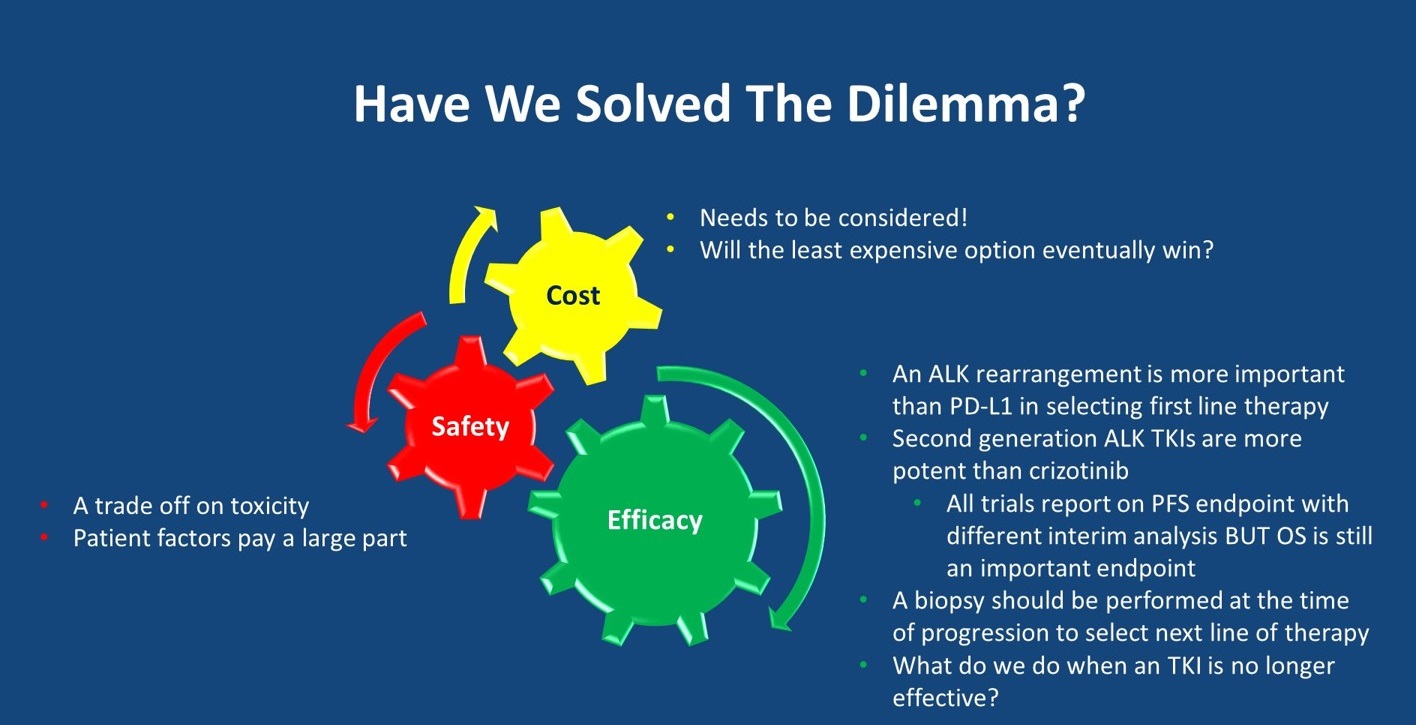
[1] Leora Horn.Sequencing the ALK Tyrosine Kinase Inhibitors.2019 ASCO.
[2] Gainor JF,Dardaei L,Yoda S,et al.Molecular Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in ALK-Rearranged Lung Cancer[J].Cancer Discov,2016,(10):1118-1133.











 苏公网安备32059002004080号
苏公网安备32059002004080号


