世界上规模最大、学术水平最高、最具权威的临床肿瘤学会议——美国临床肿瘤学会(ASCO)年会将于2019年5月31日至6月4日在美国芝加哥隆重召开。今年的主题为“Caring for Every Patient, Learning from Every Patient”。在本次ASCO年会上,儿童肿瘤领域也将迎来多项重磅研究。中山大学肿瘤防治中心的张翼鷟、孙晓非教授带领团队成员为我们精心编译并精彩点评了儿童肿瘤领域的4项重大研究,【肿瘤资讯】带您先睹为快。


中山大学肿瘤防治中心儿童肿瘤科主任
华南肿瘤学国家重点实验室PI
中国抗癌协会血液病转化研究专委会副主任委员 秘书长
CSCO抗淋巴瘤联盟常委
中国研究型医院儿童肿瘤专业委员会常委
中国医药教育协会造血干细胞移植及细胞治疗专业委员会常委

中山大学肿瘤防治中心儿童肿瘤科主任导师
广东省抗癌协会小儿肿瘤专业委员会前任主任委员
中国抗癌协会儿童肿瘤专业委员会常委、内科学组副组长
广东省/广州市抗癌协会神经肿瘤专业委员会常委
美国儿童肿瘤协会(COG)国际会员
国际儿童肿瘤协会(SIOP)会员
儿童复发/难治性急性髓细胞性白血病患者中venetoclax与大剂量阿糖胞苷联合应用的安全性和活性的研究(ABS:10004)
背景
venetoclax是一种口服BCL-2拮抗剂,在初诊或复发的急性髓细胞性白血病(AML)成人的治疗中已显示有效。 此研究首次在2~22岁复发AML患者中应用venetoclax联合大剂量阿糖胞苷和伊达比星。
方法
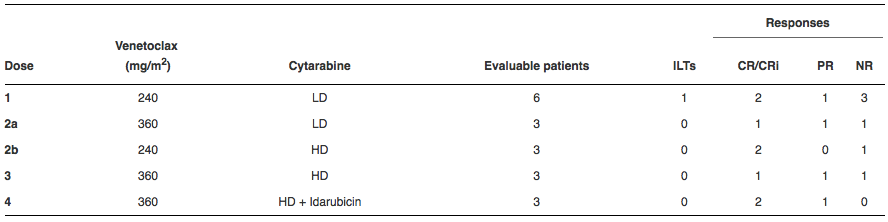
该研究为rolling-six设计Ⅰ期研究,入组患者包括复发或者对至少2个诱导治疗疗程未获缓解的AML患者。所有患者在第1~28天接受venetoclax(240 mg/ m2或360 mg/ m2),并且从第8天开始接受低剂量(100 mg/ m2 每12小时× 20次)或高剂量(1000 mg / m2 每12小时×8次)阿糖胞苷(表)。先前接受阿霉素的总剂量<270 mg/ m2的患者在第8天接受剂量水平为4的伊达比星12 mg /m2; 其他患者纳入接受剂量水平为3的扩增队列。非血液性CTCAE 3级或更高级别的毒性为强度限制性毒性(intensity limiting,ILT),但不包括大剂量阿糖胞苷常见毒性。
结果
在18名可评估的患者中,观察到单一ILT(超过第50天的远期血液学抑制)(表)。毒性与有潜在细胞毒性的化疗一致,14名患者共有40人次的3级毒性,包括6例感染和23例中性粒细胞减少性发热。有1例发生4级真菌败血症。Ⅱ期研究中,与大剂量阿糖胞苷或大剂量阿糖胞苷/伊达比星联合使用时,推荐venetoclax的剂量为360 mg/m2(最大600 mg)。在12例接受7天venetoclax窗口治疗后原始细胞减少>50%的患者中,整个治疗周期结束后的骨髓反应包括7例CR / CRi和3例PR。其中4例患者发生微小残留病灶阴性缓解。为了进一步明确这些药物组合的潜在活性,BH3样本分析和剂量水平为3和4的2期扩展研究目前正在进行中。
结论
venetoclax联合阿糖胞苷或阿糖胞苷/伊达比星治疗复发/难治性AML患儿有效且耐受是良好的。
(翻译:朱晓琴)

广东省抗癌协会小儿肿瘤专业委员会副主任委员兼秘书
广东省医疗行业协会血液病管理分会常务委员兼秘书
广东省抗癌协会神经肿瘤专业委员会委员兼小儿脑瘤学组副组长
广东省抗癌协会靶向与个体化治疗专业委员会委员
中国抗癌协会小儿肿瘤专业委员会委员
中国研究型医院学会儿童肿瘤专业委员会委员
中华医学会儿科学分会肿瘤学组委员
急性髓细胞性白血病(AML)是一种克隆性恶性增生性疾病。近年来, 由于对AML 的细胞形态学、免疫表型、细胞遗传学乃至分子生物学特性的逐步深入了解, 治疗策略和方法的不断改进及创新以及化疗强度的提高, 儿童AML的完全缓解(CR)率已高达80%~85%,5年无病生存率可达40%~60%。然而,还有相当比例的病例复发。复发因素与发病年龄、起病时外周血白细胞数、免疫表型、染色体、达到完全缓解的速度快慢等有关。对复发/难治的儿童AML尚无有效的挽救治疗方法。
在过去的20多年中,以细胞凋亡为靶点的药物一直是新药研究的热点。Bcl-2 相关蛋白之间的平衡对细胞凋亡有至关重要的调控作用。使用有机小分子拮抗此类蛋白的功能有望恢复肿瘤细胞中的凋亡机制,从而达到消除肿瘤的目的。通过抑制肿瘤细胞中过度表达的抗细胞凋亡成员的抗凋亡作用,恢复其正常的凋亡通路及增加其对化疗放疗的敏感性,成为治疗肿瘤的新策略。其中,Bcl-2家族蛋白抑制剂的venetoclax研发已取得显著进展,在治疗慢性淋巴细胞白血病方面显示出良好的效果,在初诊或复发的成人急性髓性白血病(AML)中也有效。AT-101和Bcl-201等药物已进入临床研究阶段。
venetoclax在儿童AML应用的安全性和有效性仍未知。本研究将venetoclax联合大剂量阿糖胞苷和伊达比星治疗儿童复发/难治AML,并进行相关药代动力学研究,发现venetoclax在儿童的耐受性好,未明显增加联合化疗的毒性。通过Ⅱ
期临床研究,推荐venetoclax与大剂量阿糖胞苷或大剂量阿糖胞苷/伊达比星联合用时的合适剂量为360 mg/m2(最大600 mg),指导后续临床研究的合理用药。研究初步显示venetoclax在儿童复发/难治AML治疗反应好,单药客观反应率达66.7%,显示出良好的应用前景。而且能口服用药,生物利用度高,使用方便。venetoclax联合大剂量阿糖胞苷和伊达比星治疗有望成为儿童复发/难治AML的标准挽救治疗方案。
门冬酰胺酶治疗中断对儿童ALL结局的影响:儿童肿瘤组(COG)的报告(ABS:10005)
背景
门冬酰胺酶(ASP)是急性淋巴细胞白血病(ALL)治疗的重要组成部分,但常因毒性而被中止使用。因过敏反应(而不是其他毒性反应)常被欧文菌门冬酰胺酶 (Erwinia Asparaginase,EA)替换。大多数治疗方案使用离散的、不连续的门冬酰胺消耗周期。在治疗方案中,采用EA替换或完整ASP治疗周期被中断的影响是未知的。
方法
将1~30.99岁的患者纳入一线COG B-ALL试验[标危(NCI SR):AALL0331;高风险(NCI HR)AALL0232]。根据试验、风险等级和随机化(表),患者接受的聚乙二醇天门冬酰胺酶(PEG)剂量有所不同。维持治疗不含ASP。从维持期开始的地标分析比较了接受所有规定剂量的PEG,转换为EA但达到所有规定剂量及未达到ASP所有规定剂量的患者之间的无事件生存率(EFS)。
结果
本研究包括5195例AALL0331和3001例AALL0232患者。在AALL0331和AALL0232中,PEG停药的累积发生率分别为12.2%±4.6%和25.4%±0.8%。在校正患者和疾病变量的多变量分析中,与接受所有规定PEG剂量的患者相比,未接受所有规定ASP剂量的NCI HR患者的EFS[风险比(HR)1.5,95% CI 1.2~1.9;P=0.002]更低。完成疗程的EA替代患者的风险未增加(HR 1.195,95% CI 0.7~1.6;P=0.69)。排除因胰腺炎或血栓停止ASP的患者后,灵敏度分析得出了相似的结果。停用ASP的NCI SR患者的风险未增加(HR 1.2,95% CI 0.9~1.6;P =0.23);但当分析仅限于早期慢反应的NCI SR患者时,患者的风险显著增加(HR 1.7,95% CI 1.1~2.7;P =0.03)。

结论
停止使用ASP剂量与EFS明显较低有关,必须平衡ASP再激发的风险。我们的结果也说明了EA短缺的潜在严重后果。
(翻译:孙斐斐)

中山大学肿瘤防治中心儿童肿瘤科
门冬酰胺酶(ASP)是急性淋巴细胞白血病(ALL)联合化疗中的主要药物,但其具有过敏、胰腺炎、凝血功能异常等诸多较为严重的毒性反应。出现过敏反应的患者体内会继发产生门冬酰胺酶抗体影响药物的疗效,因此常常会使用欧文菌门冬酰胺酶(EA)进行替换治疗。而出现重度胰腺炎和脑、肺等重要器官出血或血栓等严重药物毒性的患者,将会停用一切门冬酰胺酶治疗。大部分临床医生都担心无法接受完整ASP治疗周期会对患者的预后造成影响。而事实上,目前还很少有这样的研究统计采用EA替换或完整ASP治疗周期被中断对患者预后的影响。因此,这项研究具有很大的现实意义,将帮助我们衡量毒性与治疗效果之间的利弊选择。
此次研究对接受所有规定剂量的聚乙二醇天门冬酰胺酶(PEG),转换为EA但达到所有规定剂量及未达到ASP所有规定剂量的患者的无事件生存率(EFS)进行了比较。发现与接受所有规定PEG剂量的患者相比,未接受所有规定ASP剂量的NCI HR患者的EFS更低。但停用ASP的NCI SR患者的风险未增加。但当分析仅限于早期慢反应的NCI SR患者时,患者的风险显著增加。因此,从中我们可以得出,对于NCI HR患者和早期慢反应的NCI SR患者来说,完整的门冬酰胺酶治疗周期显得更为重要。而对于早期快反应的NCI SR患者,在毒副反应较大时,减少门冬酰胺酶的总剂量的影响会较小一些。在整组中,完成疗程的EA替代患者的风险未增加。表明EA替代治疗并不会影响患者的生存。而目前国内外均出现的EA短缺的现状可能会影响到ASP过敏患者的生存,造成严重的后果,各国均应重视这个问题。
恩曲替尼在儿童和青少年复发性或难治性实体瘤(包括中枢神经系统肿瘤)Ⅰ/Ⅰb期临床研究中显示出显著疗效(ABS:10009)
背景
恩曲替尼是一种具有中枢神经系统活性的酪氨酸激酶抑制剂(TKI),靶向治疗携带NTRK1/2/3(编码TrkA、TrkB、TrkC)、ROS1 和ALK 基因融合突变的实体肿瘤。本研究旨在评估恩曲替尼在儿童复发性/难治性实体瘤或中枢神经系统(CNS)肿瘤中的疗效。
方法
入组患者≤20岁。在确定所有参加者的推荐剂量后,存在NTRK1/2/3、ROS1 或ALK 以及神经母细胞瘤(NBL)(不管是否存在突变),纳入Ⅰb扩展队列。研究者评估的反应包括完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)或疾病进展(PD)。疗效评价标准:CNS肿瘤采用RANO评分、实体瘤采用RECIST评分、NBL采用Curie评分。
结果
2016年5月至2018年10月,共29例纳入研究,中位年龄7岁(4.9个月~20岁),28例接受了疗效评估。恩曲替尼耐受性良好。剂量限制性毒性包括肌酐升高、味觉障碍、疲劳和肺水肿。建议剂量为550mg/(m2/d)。所有反应均在剂量≥400 mg/m2时发生。6例高级别CNS伴有基因融合中:1例CR(ETV6-NTRK3);3例PR(TPR-NTRK1、EEF1G-ROS1、EML1-NTRK2 );1例未确认的PR(GOPC-ROS1);1例尚未评估(KANK1-NTRK2 )。8例颅外实体瘤中,6例存在基因融合患者:1例CR(DCTN1-ALK ),5例PR(TFG1-ROS1、EML4-NTRK3、ETV6-NTRK3、KIF5B-ALK、ETV6-NTRK3 )。15例NBL中,1例CR(ALK F1174L)。所有患者中位治疗时间为85天(6~592天),无反应者为56天(6~338天),反应者为281天(56~592天),中位反应时间为57天(30~58天)。
结论
对于所有具有NTRK1/2/3、ROS1 或ALK 融合的难治性中枢神经系统和实体瘤(11/11)以及ALK 突变的NBL患儿,恩曲替尼均能产生显著、快速和持久的反应。在缺乏靶蛋白激酶异常的肿瘤中未见疗效。
(翻译:路素英)

中山大学肿瘤防治中心儿童肿瘤科主管医师
广东省抗癌协会小儿分会青委会委员
广东省抗癌协会肉瘤专业委员会委员
儿童和青少年复发难治实体瘤(包括中枢神经系统肿瘤)总体预后尚差,随着近年来靶向治疗的进展,儿童和青少年复发性或难治性实体患者也有了新的选择。
儿童青少年肿瘤中,Trk 基因融合主要发生于婴儿型纤维肉瘤、先天性中胚层肾瘤、软组织肉瘤、原发中枢神经系统肿瘤等。2018年11月27日,美国FDA批准首个TRK抑制剂Larotrectinib用于治疗NTRK 基因融合的晚期实体瘤患者,在治疗Trk 基因融合肿瘤成人和儿童多种类型的实体瘤患者的临床试验中,总体缓解率(ORR)为75%(22% CR和53% PR)。恩曲替尼与Larotrectinib齐名,同为广谱抗癌药,恩曲替尼的靶点包含:NTRK1/2/3、ROS1 和ALK 基因,它可以通过血脑屏障,并且没有不良的脱靶活性。该研究中,7例NTRK 融合的患者中,除外1例未评估外,1例CR、5例PR,ORR为100%(6/6)。这对于Trk融合患者是一种新的选择。ROS1 主要发生于非小细胞癌、胶质瘤等。此研究中,ROS1 融合患者共3例,除外1例未确认的PR,另外2例均PR。神经母细胞瘤(NBL)中有6%~10%的散发性NB带有体细胞 ALK 突变,还有3%~4%具有高频率 ALK 基因扩增,在此研究中,1例ALK F1174L突变的NBL患者获得CR。
该研究采用恩曲替尼治疗儿童和青少年复发性或难治性实体瘤患者安全性好,对于携带NTRK1/ 2/3 、ROS1 和ALK 基因融合突变的患者ORR为100%,而且有效时间持久,中位有效时间持续281天,令人倍受鼓舞。恩曲替尼代表了一种独特的癌症治疗方法——“异病同治”,此疗法代表着精准治疗时代个性化治疗的进步,尽管儿童肿瘤患者总体突变率较低,相对成人而言,在靶向治疗领域进步较缓慢的情况下,无疑给儿童肿瘤患者打开了一扇全新的希望之门。
使用抗GD2抗体dinutuximab beta(DB)长期输注(LTI)进行维持免疫治疗(IT)的一线高危神经母细胞瘤患者中进行剂量减少的皮下注射白介素-2(scIL2)的随机试验:来自HR-NBL1/ SIOPEN试验的早期结果(ABS:10013)
背景
我们试验在高危神经母细胞瘤患者中使用剂量减少的scIL2与DB-LTI和口服异维甲酸的结合,并评估了毒性和疗效(EudraCT:2006-001489-17)。
方法
高危患者[4期≥1岁;4期<1岁,MYCN扩增(MNA);2期、3期,0~21岁,MNA]接受高强度诱导化疗(rapid COJEC或在反应差时使用N5-MSKC和TVD),手术,使用白消安/美法仑的大剂量化疗和局部放疗。在诊断和HDT/SCT之间≤9个月且在HDT/SCT之前达到至少部分缓解且之后没有进展的患者随机接受最多5个周期的100mg/m2 DB-LTI(d8~17)±3×106 IU/m2 scIL2(d1~5; d8、d10、d12、d14、d16)和160mg/m2口服异维甲酸(d19~32)。
结果
2014年4月至2014年6月,来自18个国家的408名患者被随机分组。中位随访时间为1.8年。随机化分组之间的分期、年龄、MNA、诱导治疗和缓解状态均衡良好。DB-LTI组(205例)与DB-LTI&scIL2组(203例)的2年EFS和OS为64%±4% vs 63%±5%(P=0.844)和83%±3% vs 74%±4%(P=0.337)。对于CR患者,DB组的2年EFS为69%±5%,DB&scIL2组为66%±6%。在DB或DB&scIL2之前具有可评估疾病的患者,治疗结束时的反应率为57%(26%CR,31%PR)vs 52%(27%CR,25%PR),2年EFS率为58%±7%和64%±8%。DB组3级和4级毒性较 DB&scIL2组低,发热(14%vs 31%,P<0.001)和疼痛(7% vs 18%,P=0.005)。一般情况(17% vs 22%,ns),过敏(3% vs 3%,ns),毛细血管渗漏(4% vs 8%,ns),肝酶升高(20% vs 27%,ns)和神经毒性(2% vs 2%,ns)均无显著差异。
结论
我们之前报道了DB短期输注(STI)±10×6×106 IU/m2 scIL2的3级和4级毒性,分别为一般情况(16% vs 41%,P=0.000),发热(14% vs 40%,P=0.000),过敏反应(10% vs 20%,P=0.006),毛细血管渗漏(4% vs 15%,P=0.004),肝酶升高(17% vs 23%,ns),中枢神经毒性(3% vs 8%,P=0.034)和疼痛(16%vs 26%,P=0.048)。我们的结果表明,DB-LTI+剂量减少的scIL2明显降低了毒性特征,显示scIL2没有益处。 DB-LTI与DB-STI(Ladenstein,Lancet Oncology 2018; Yu,NEJM,2010)2年EFS一致,并且反应率> 50%支持其作为IT治疗的标准方案。
临床试验信息:EudraCT:2006-001489-17。
(翻译:黄俊廷)

中山大学肿瘤防治中心儿童肿瘤科
神经母细胞瘤是儿童最常见的颅外实体恶性肿瘤。随着化疗、手术和放疗的发展,低、中危的儿童神经母细胞瘤的治愈率已经达到80%以上,但是高危神经母细胞瘤的治愈率仍较低,国内高危神经母细胞瘤5年无事件生存仅有30%~40%,2015年抗GD2单抗上市以后,国外研究报道的高危神经母细胞瘤的治愈率大为改善,无事件生存可达50%以上,总生存可达70%以上。国内抗GD2单抗已加入我国临床急需新药名单,有望在近期内上市。
在抗GD2单抗的早期研究中显示,抗GD2单抗联合白介素-2可能有增强抗神经母细胞瘤的作用,结果发表于《新英格兰医学杂志》,但是在GD2单抗上市以后,2016年ASCO年会上SIOPEN公布了欧洲抗GD-2单抗3期临床试验的结果,显示相较于单独使用抗GD-2单抗,联合使用白介素-2并不会提高无事件生存率和总体生存率,反而会增加过敏和毛细血管渗出等毒副作用。结果发表于《柳叶刀·肿瘤》杂志。
近年来,美国和欧洲相继批准了抗GD2单抗用于高危型神经母细胞瘤患者的维持期治疗方案,显著提升了预防肿瘤复发或转移的效果。但是在维持治疗期间是否需要白介素-2增强抗GD2单抗的作用,仍然需要探讨,本次ASCO大会上SIOPEN的这项随机临床研究早期结果显示,白介素-2在维持治疗期间对生存并没有获益,但是发热和疼痛等毒副作用增加。这项研究中建议抗GD2单抗维持治疗无需联合白介素-2,研究终点2年EFS已经达到60%以上,2年OS达80%以上,因此可以作为高危神经母细胞瘤维持治疗的标准方案。
[1]Karol SE, Alexander T, Gupta SD,et al.Safety and activity of venetoclax in combination with high-dose cytarabine in children with relapsed or refractory acute myeloid leukemia[EB/OL].(2019-05-16)[2019-05-17]. http://abstracts.asco.org/239/AbstView_239_263511.html
[2]Gupta S, Wang C, Raetz EA,et al.Impact of asparaginase discontinuation on outcome in childhood ALL: A report from the Children’s Oncology Group (COG)[EB/OL].(2019-05-16)[2019-05-17].http://abstracts.asco.org/239/AbstView_239_252255.html
[3]Robinson GW, Gajjar AJ, Gauvain KM, et al.Phase 1/1B trial to assess the activity of entrectinib in children and adolescents with recurrent or refractory solid tumors including central nervous system (CNS) tumors[EB/OL].(2019-05-16)[2019-05-17]. http://abstracts.asco.org/239/AbstView_239_263027.html
[4] Ladenstein RL,Poetschger U, Valteau-Couanet D,et al.Randomization of dose-reduced subcutaneous interleukin-2 (scIL2) in maintenance immunotherapy (IT) with anti-GD2 antibody dinutuximab beta (DB) long-term infusion (LTI) in front–line high-risk neuroblastoma patients: Early results from the HR-NBL1/SIOPEN trial[EB/OL].(2019-05-16)[2019-05-17]. http://abstracts.asco.org/239/AbstView_239_262657.html













 苏公网安备32059002004080号
苏公网安备32059002004080号


