
The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. Jonathan J. Havel, Diego Chowell & Timothy A. Chan Nature Reviews Cancer (2019)
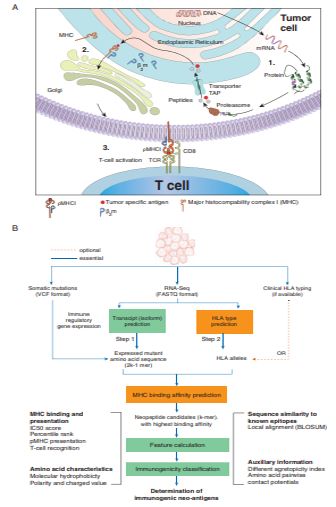
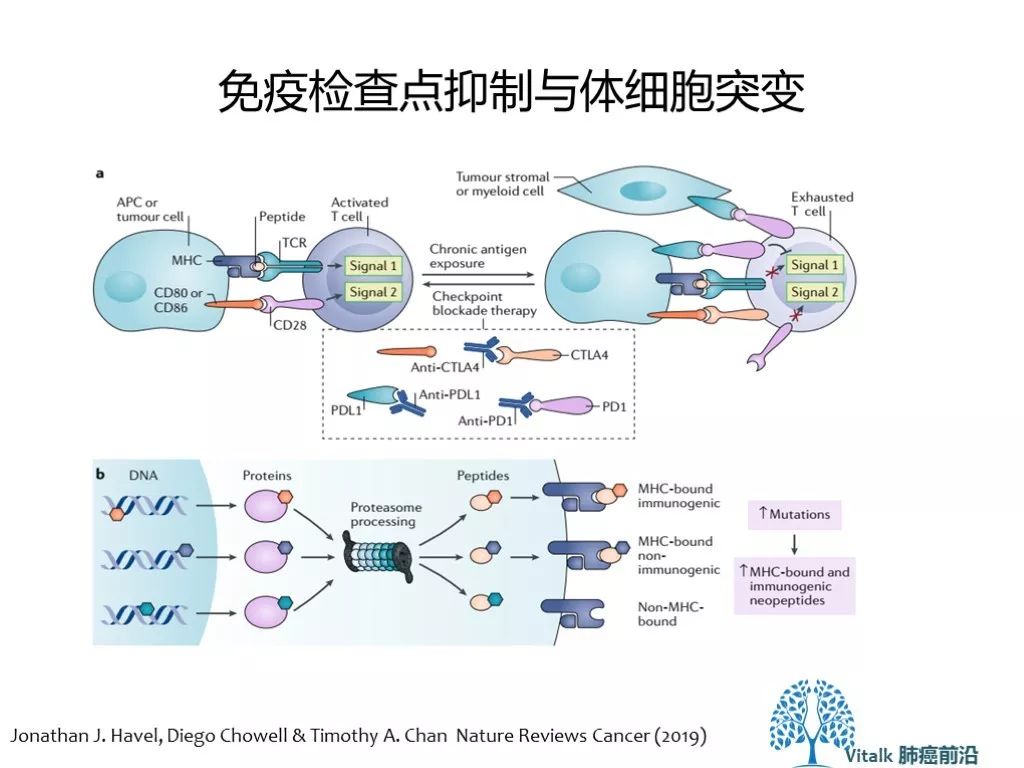 T细胞通过两个信号(TCR-MHC-peptide 识别抗原肽 & CD28 –CD 80/86 共刺激信号)被激活。肿瘤细胞基因组的突变或异常表达的蛋白被加工成与MHC I类分子结合(或不能结合)的肽。具有免疫原性的peptide (MHC-bond immunogenic peptides)引发随后的免疫反应。通常肿瘤突变负荷越高(每兆碱基体细胞碱基替换及插入缺失突变的突变总数),产生MHC-bond peptides 可能性也越高 (这就是我们所认识的新抗原)。
T细胞通过两个信号(TCR-MHC-peptide 识别抗原肽 & CD28 –CD 80/86 共刺激信号)被激活。肿瘤细胞基因组的突变或异常表达的蛋白被加工成与MHC I类分子结合(或不能结合)的肽。具有免疫原性的peptide (MHC-bond immunogenic peptides)引发随后的免疫反应。通常肿瘤突变负荷越高(每兆碱基体细胞碱基替换及插入缺失突变的突变总数),产生MHC-bond peptides 可能性也越高 (这就是我们所认识的新抗原)。
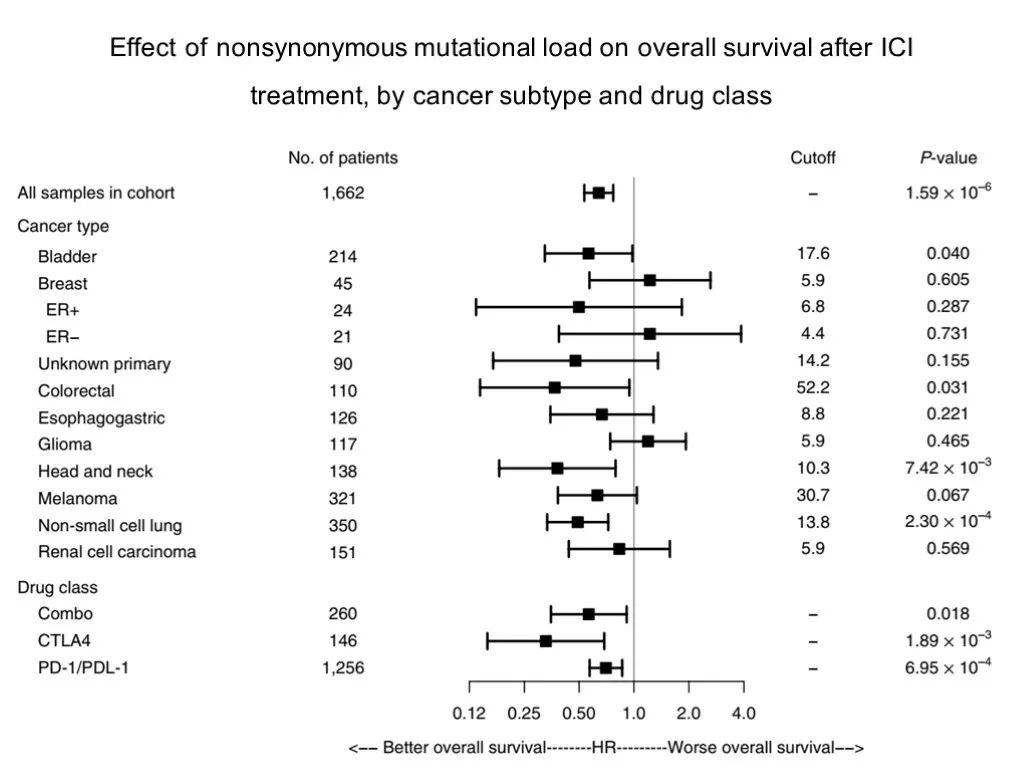
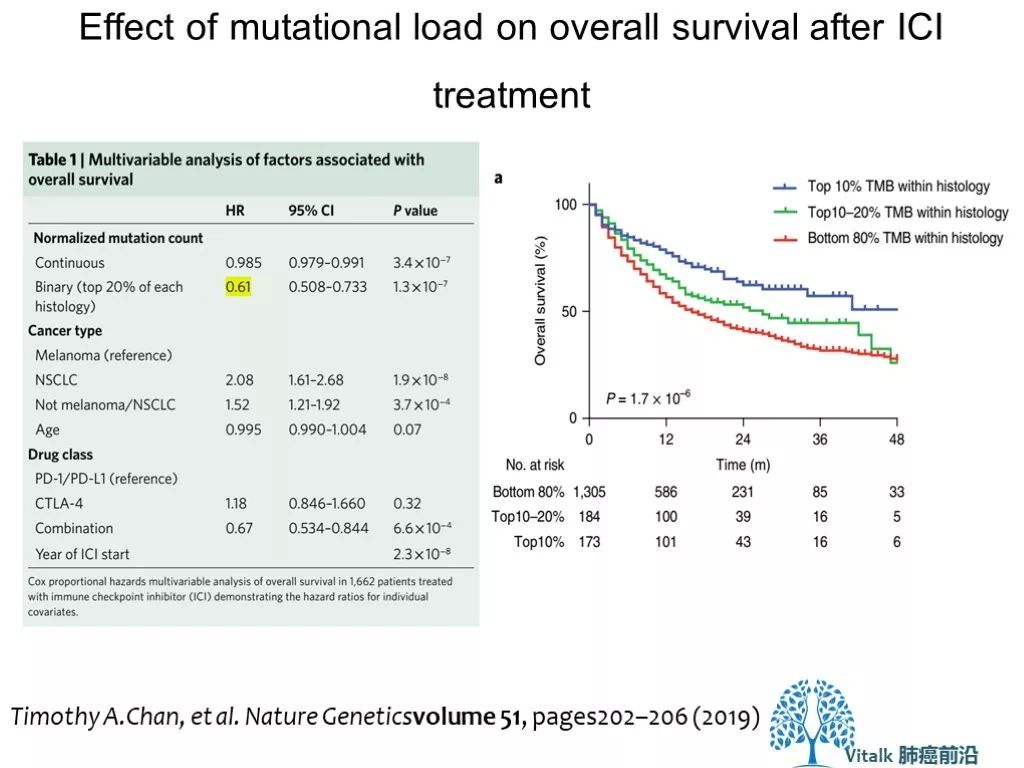 2019年 MSKCC 研究团队分析了1,662名接受ICI治疗的晚期癌症患者和5,371名非ICI治疗患者的临床和基因组数据(MSK-IMPACT)测序,分析发现,在这些患者中,不论何种组织来源,TMB 处于最高20%分位时,患者能够从ICI治疗中获得长期生存获益(HR 0.61)。这种正相关出现在大多数肿瘤类型中。但TMB的cutoff 在不同肿瘤间存在较大差异,很难找到一个通用的cutoff值(比如 10或者20)。高TMB是个疗效预测因素,不是预后因素,对于不接受PD-1治疗的患者,TMB Hi vs low OS 没有差别
2019年 MSKCC 研究团队分析了1,662名接受ICI治疗的晚期癌症患者和5,371名非ICI治疗患者的临床和基因组数据(MSK-IMPACT)测序,分析发现,在这些患者中,不论何种组织来源,TMB 处于最高20%分位时,患者能够从ICI治疗中获得长期生存获益(HR 0.61)。这种正相关出现在大多数肿瘤类型中。但TMB的cutoff 在不同肿瘤间存在较大差异,很难找到一个通用的cutoff值(比如 10或者20)。高TMB是个疗效预测因素,不是预后因素,对于不接受PD-1治疗的患者,TMB Hi vs low OS 没有差别
Timothy A.Chan, et al. Nature Genetics volume 51, pages202–206 (2019) ,
从该项研究公布的TMB cutoff(top 20%),中位值都小于100,其中结直肠癌的52 ,应注意存在MMRd的富集因素(测序样本来自接受CPI治疗的样本)。
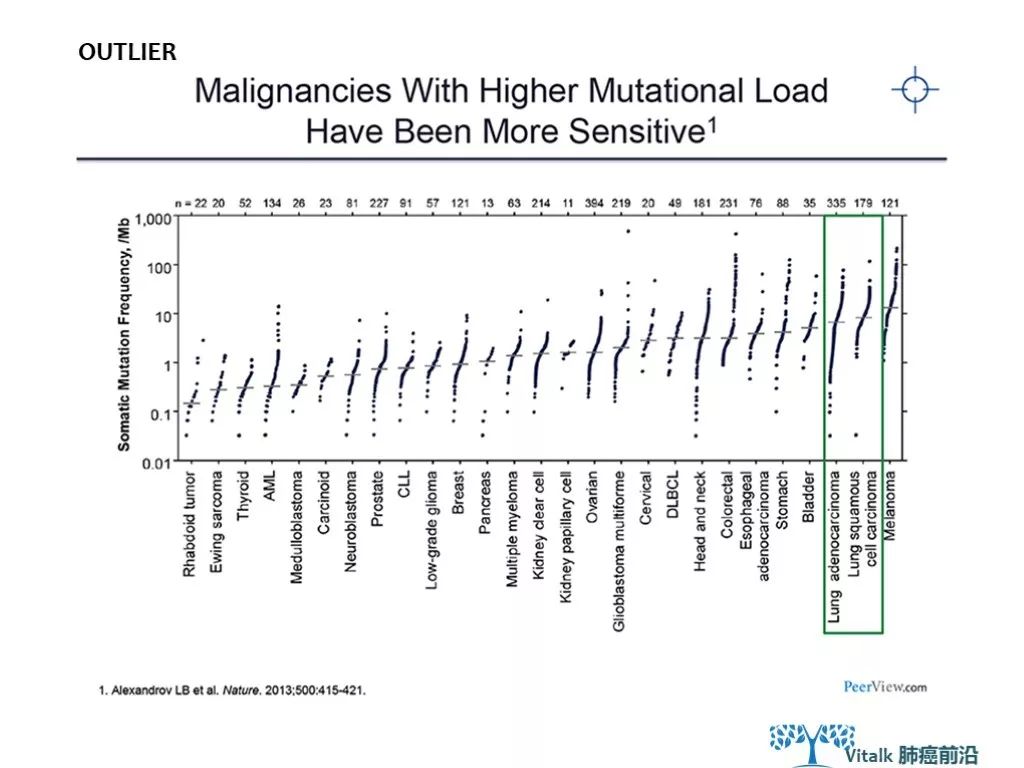
这个研究中的一个例外,RCC,透明肾细胞癌,这种肿瘤的突变负荷相对较低,但是表现为几乎所有肿瘤中最高免疫细胞浸润特征。
另外有研究提示,透明肾细胞癌具有19种肿瘤类型中最高的插入突变负荷,这种移码突变被认为相较于nsSNVs变异具有高出3倍的产生新抗原的能力。
Insertion-and-deletion-derived tumour-specific neoantigens and the immunogenic phenotype: a pan-cancer analysis. Lancet Oncol. 18, 1009–1021 (2017)
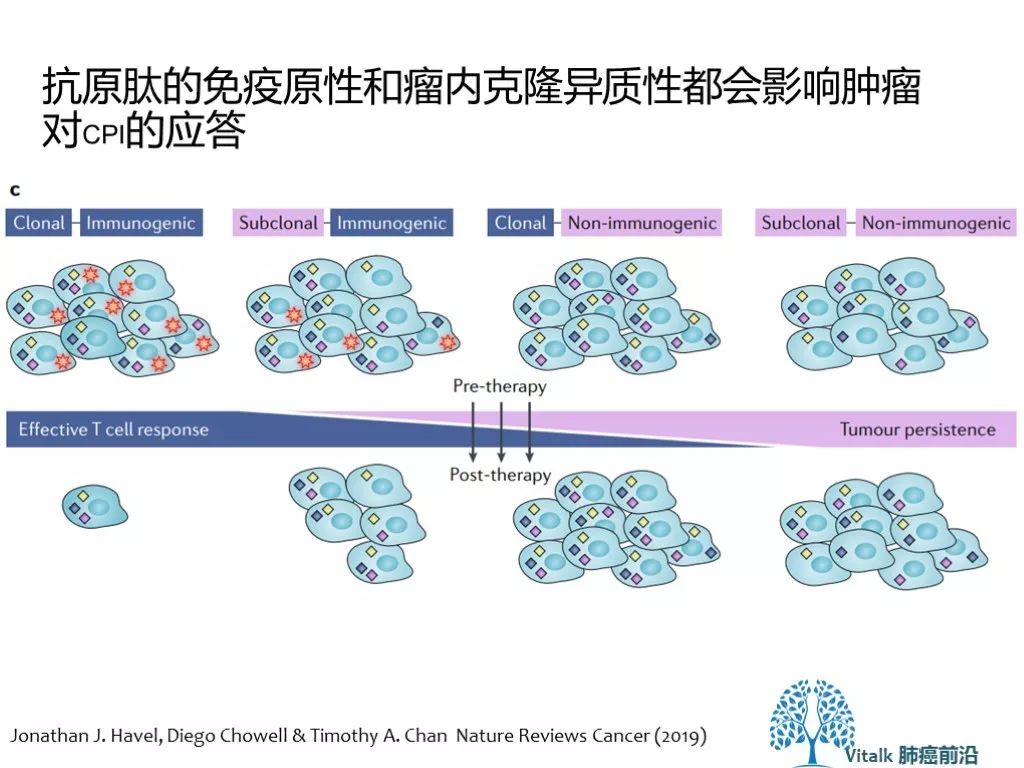
Neoantigen 最重要的特性可能在于,它是存在与大部分 还是 小部分肿瘤细胞。肿瘤细胞遵循克隆进化的规律(达尔文法则,现在的假说相信,那些由主干克隆突变(异质性低的肿瘤)产生的新抗原比亚克隆突变(高度异质性肿瘤)具有更高的免疫原性。
有意思的是,现在应用化疗与CPI联合的假说是 基于化疗对细胞的直接杀伤可能刺激新生抗原的释放,但需要了解另一种可能性,事先用化学疗法治疗可能会增加亚克隆突变的发生率并促进肿瘤内异质性。这两个因素都CPI响应呈负相关。 此外有研究提示,在初次化疗治疗后复发的卵巢肿瘤中观察到的新抗原的分析显示,少于5%的新型新抗原可归因于化疗相关的特征。复发后获得的绝大多数突变是由化疗暴露前肿瘤固有的突变过程引起的。这些结果表明化疗暴露不是影响新抗原生成的主要因素。临床研究KN024的更新OS 也提示,在高PD-L1表达人群,一线CPI单药的OS 要优于化疗后二线交叉到CPI 组。
影响肿瘤免疫原性的多种因素
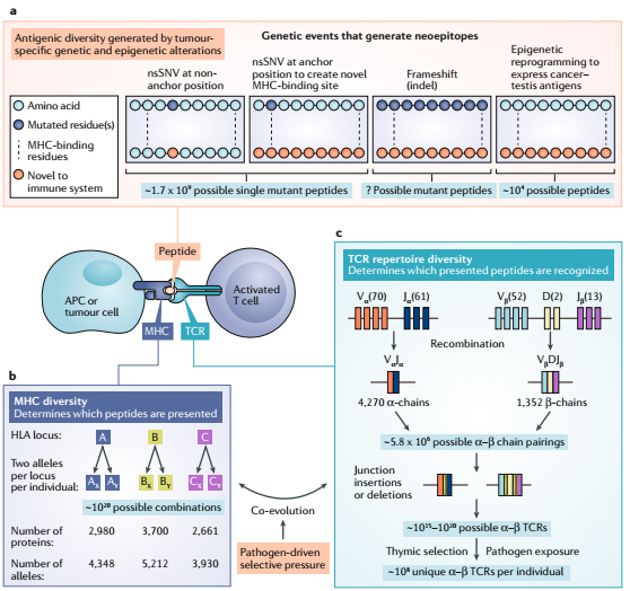
“非我族类,虽远必诛”,突变新抗原具有什么特点,才被视为“异己”?
A 免疫原性的新抗原(新生肽)来源于不同的突变:nsSNVs,插入/缺失 突变,移码突变,表观遗传改变。不同的突变产生新抗原的概率具有很大差异。与原编码序列差异越明显的突变越容易产生被T细胞识别的新抗原
插入/删除及移码突变导致氨基酸序列和空间结构改变会比较大,与MHC分子结合的亲和力会更强,被T细胞识别为新抗原的可能性越大。
B HLA 基因(人類白細胞抗原(英语:human leukocyte antigen,缩写为HLA),是編碼人类的主要组织相容性复合体(MHC)的基因),是人类基因组中具有高度多态性的基因。已知的HLAA,HLAB,HLAC等位基因多达数千种。每个个体具有HLA基因上的两个等位基因,这产生了 万亿数量级(10 20)的组合差异,导致可能产生的肿瘤抗原类型数以千计。
C TCR识别并结合HLA呈递的肽表位。 每个个体都具有通过体内每个发育中的T细胞内的可变(V),多样性(D)和连接(J)基因区段的半随机重组产生的独特TCR谱。 通过末端脱氧核苷酸转移酶的活性,在基因区段连接处缺失或插入核苷酸进一步增加了TCR多样性。 T细胞克隆随后经历正向、负向胸腺选择以富集结合自身MHC分子但不结合自身肽的T细胞。现在认为,HLA和TCR基因都已进化为结合病原体衍生的序列。 这可能会决定哪些肿瘤衍生的新抗原最有可能引发有效的T细胞反应。 APC,抗原呈递细胞。
预测肿瘤突变是否引起免疫反应的算法

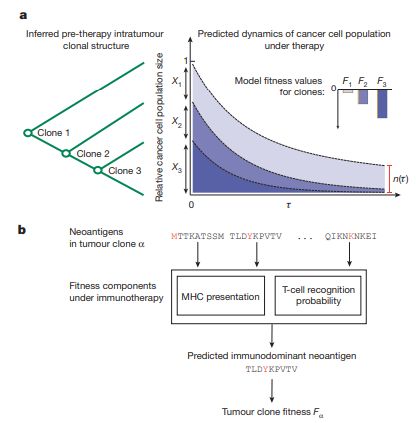

Comprehensive Analysis of Hypermutation in Human Cancer
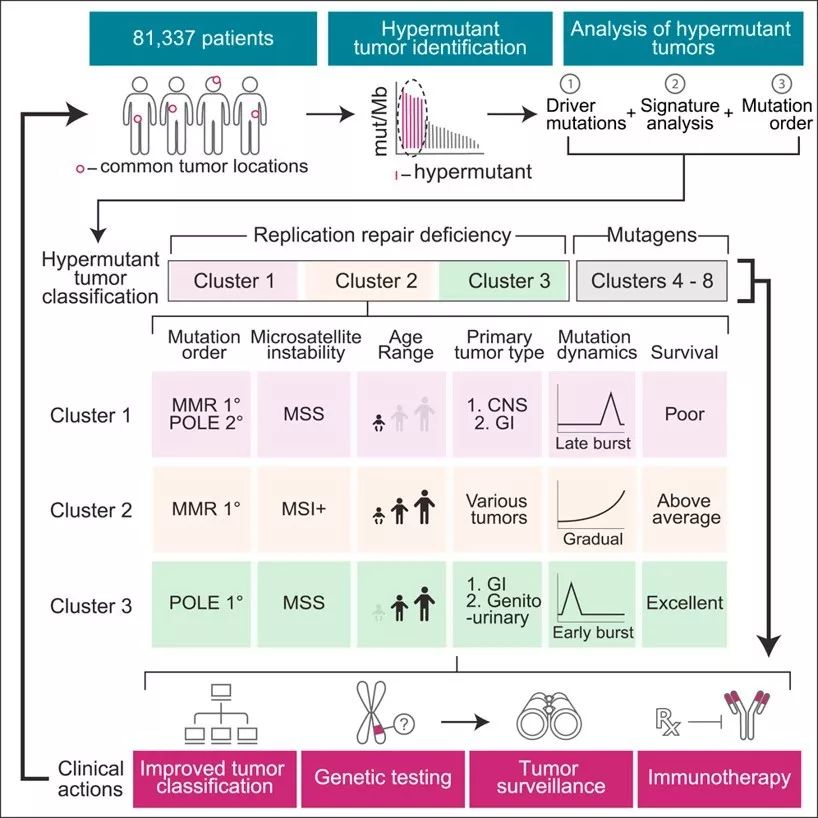
Cell 2017 171, 1042-1056.e10DOI: (10.1016/j.cell.2017.09.048
有多种突变类型能够引起基因组“超突变”。包括泛肿瘤的MMRd,我们都知道携带有这种变异的肿瘤(无论组织来源),对CPI(免疫检查点)抑制剂治疗都有较好的肿瘤应答。随后的研究发现,MSI阳性肿瘤具有较高的突变负荷。其他的超突变包括,DNA聚合酶突变 POLE POLD,DNA 同源重组修复缺陷 (HRD)。这些突变的存在理论上可以增加新抗原负荷,从而增强肿瘤的免疫原性,带来更好的对免疫检查点抑制剂的应答。在临床上验证这一假设的工作正在进行。
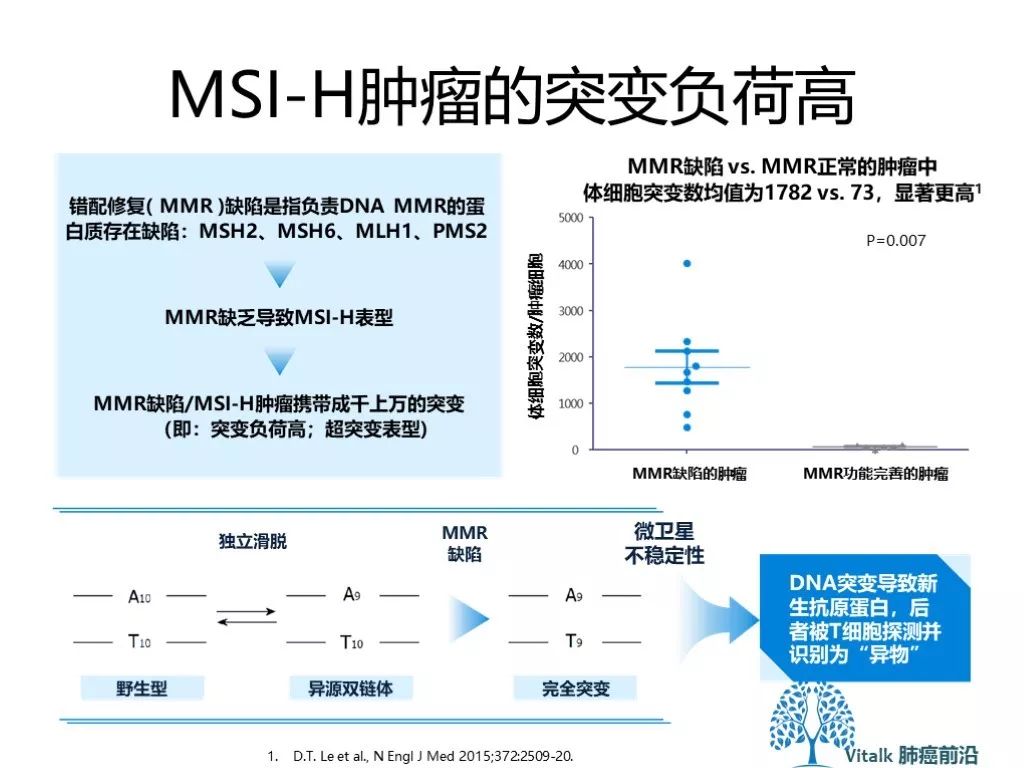
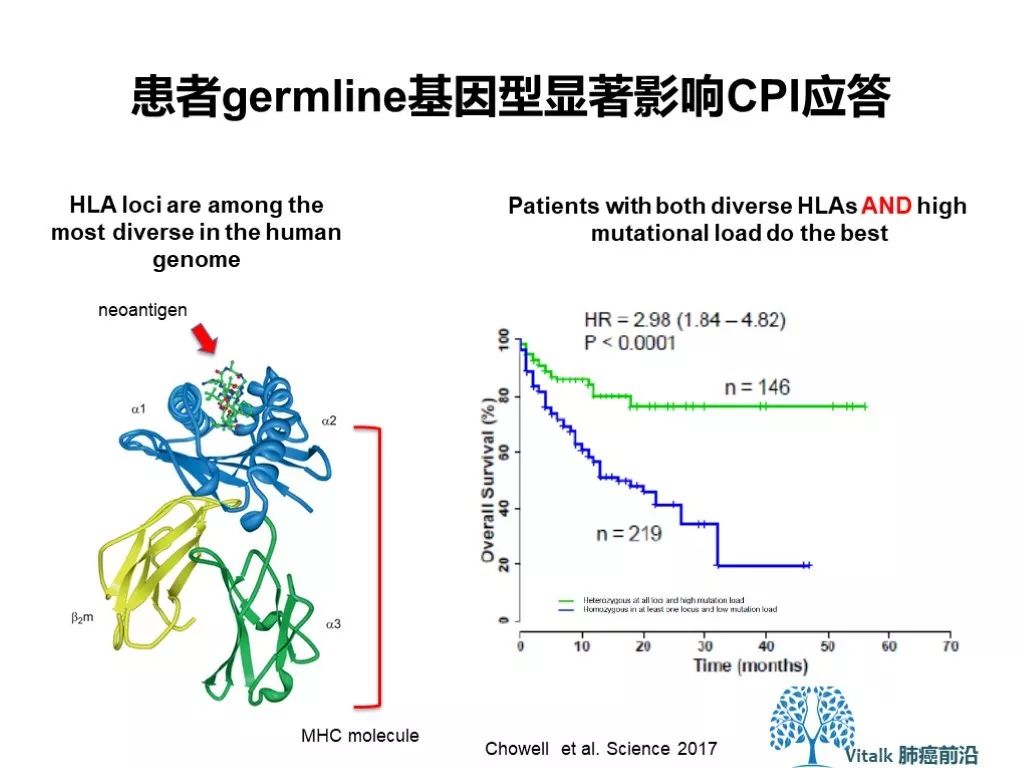
HLA-I类分子杂合缺失(LOH)与更差的治疗结局相关。
D. Chowell, L. G. T. Morris, C. M. Grigg, J. K. Weber, R. M. Samstein, V. Makarov, F. Kuo, S. M. Kendall, D. Requena, N. Riaz, B. Greenbaum, J. Carroll, E. Garon, D. M. Hyman, A. Zehir, D. Solit, M. Berger, R. Zhou, N. A. Rizvi, T. A. Chan, Patient HLA class I genotype influences cancer response to checkpoint blockade immunotherapy. Science 359, 582–587 (2018)
Timothy A. Chan 是这篇的通讯
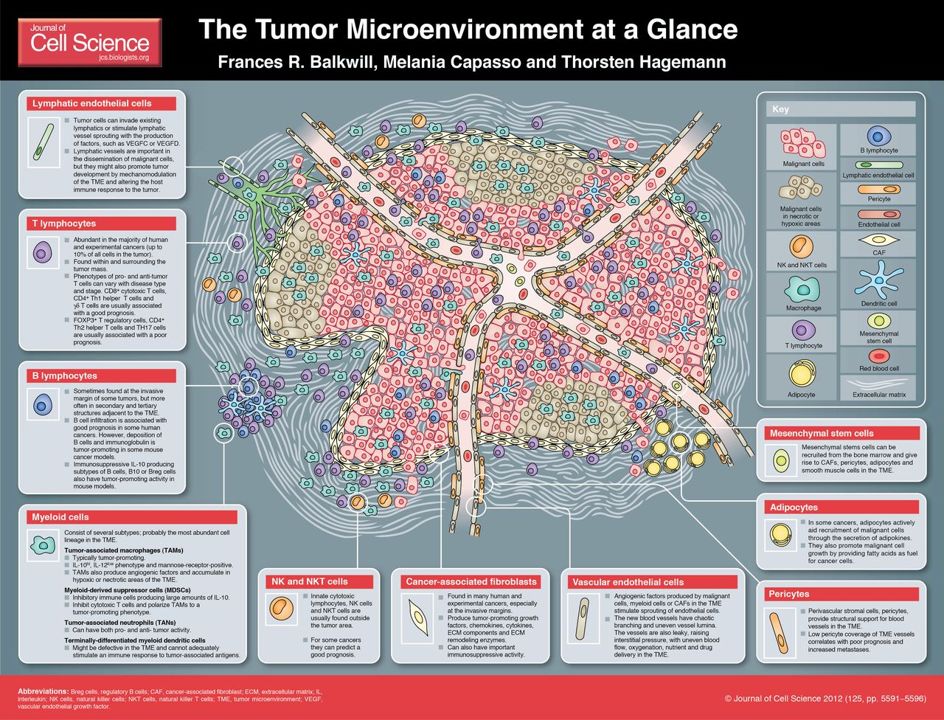
免疫微环境:PD-L1表达;肿瘤浸润淋巴细胞—密度,表型和多样性;T细胞以外的其他免疫细胞;转录组和表观遗传学特征。这是一个最网红的概念,此处省略3000字赘述。
但这种清晰的,泾渭分明的分类罗列,是科学家的智慧提炼的产物。实际上,我们能够在实验室里(可能没有)看到的所谓 TME,长成如下这几个“阿凡达”的样子:
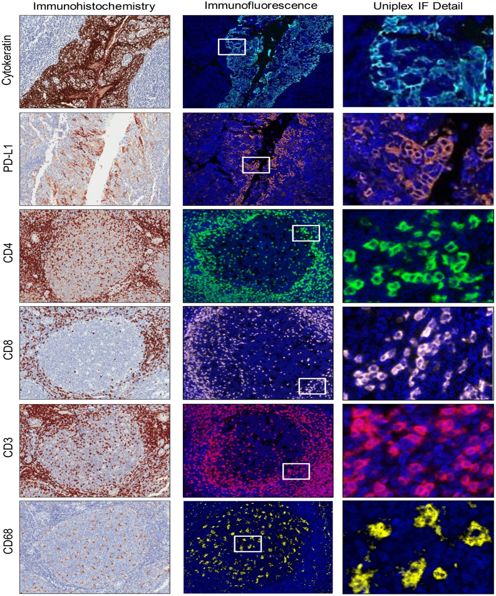
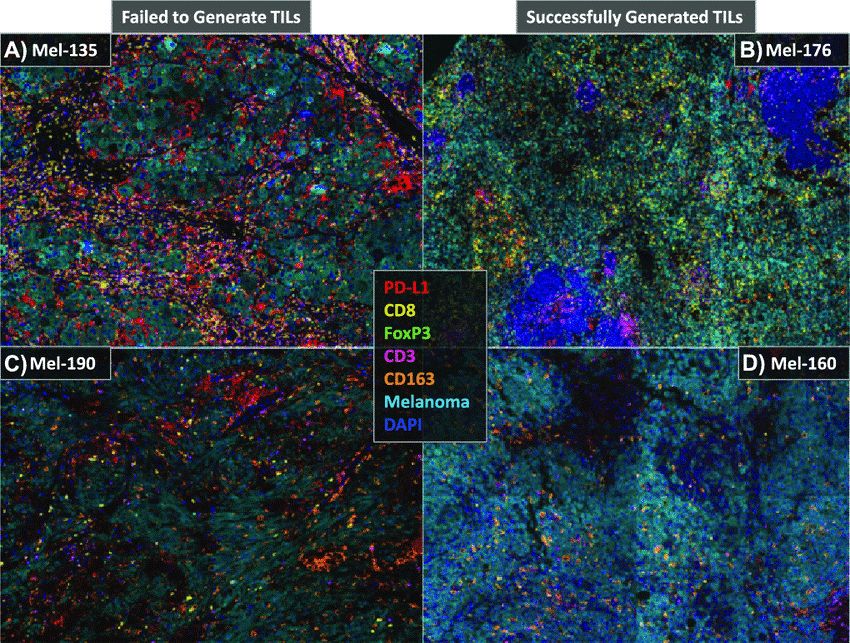
肿瘤免疫微环境:不仅围绕T细胞
Cellular Characterization of Immune Infiltrates in Solid Cancers
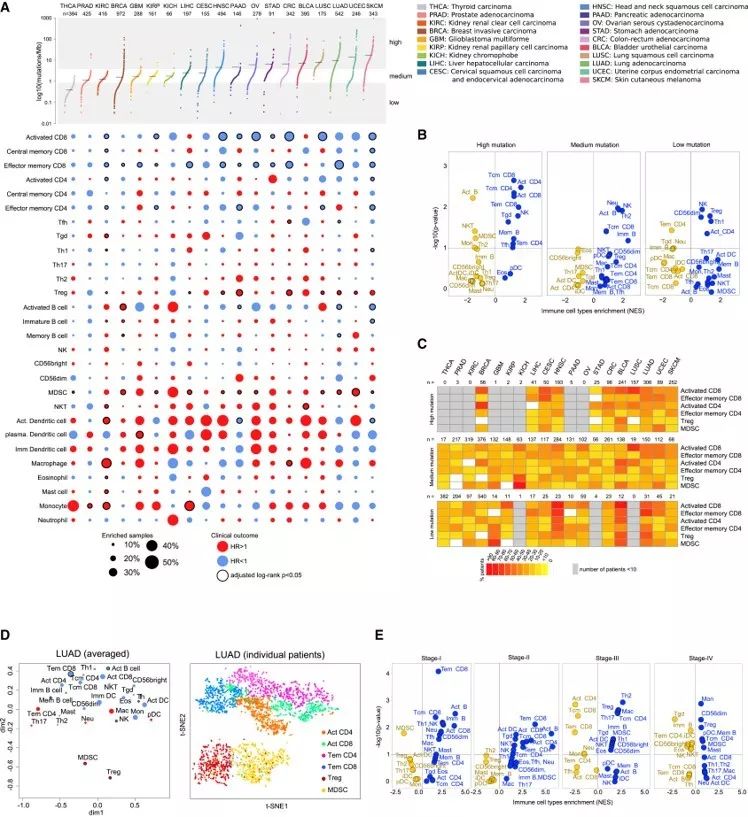
(A)19中肿瘤的免疫细胞雅兴。根据参与固有免疫或适应性免疫过程的免疫细胞亚型或突变负荷进行分类。
(B) 基于来自GSEA的NES得分计算的具有高,中和低突变负荷的肿瘤中的免疫细胞类型的富集(蓝色)和缺失(黄色)的火山图。
(C) 在不同突变负荷的不同肿瘤类型中,所选择的免疫细胞亚群富集的分数
(D) 肺腺癌免疫细胞浸润情况
(E)基于来自GSEA的NES得分计算的肿瘤I期至IV期癌症的免疫细胞类型的富集(蓝色)和缺失(黄色)的火山图
Charoentong, P. et al. Pan-cancer immunogenomic analyses reveal genotype-immunophenotype relationships and predictors of response to checkpoint
blockade. Cell Rep. 18, 248–262 (2017).

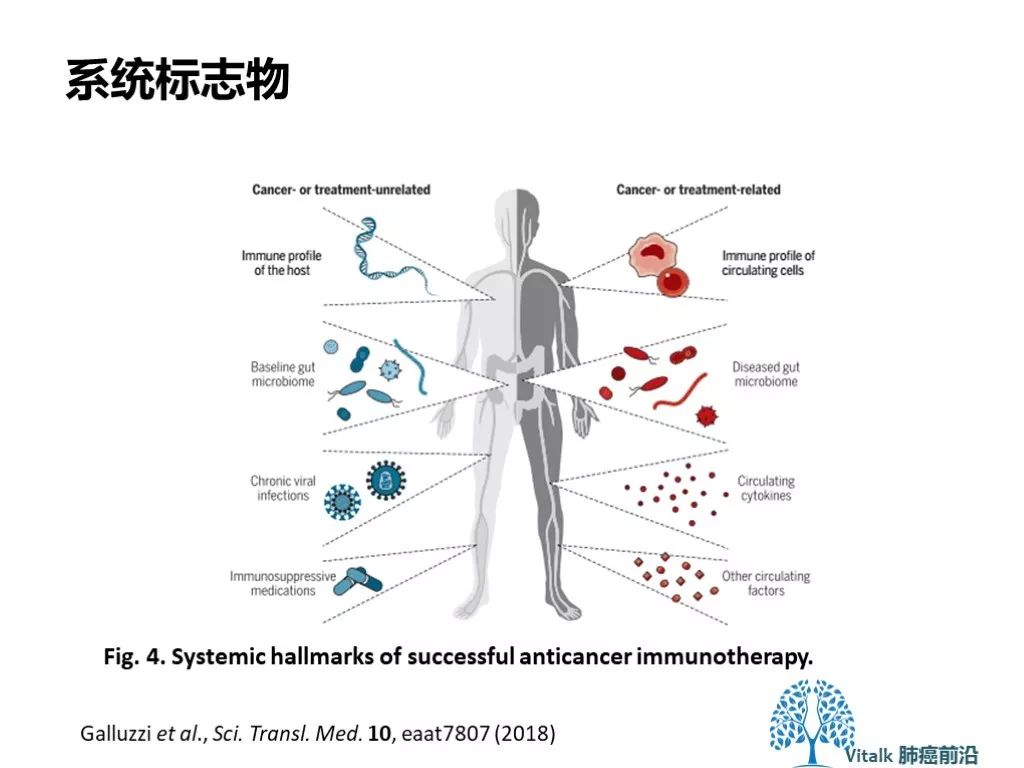 癌症患者从免疫治疗中获益的程度取决于其整体免疫系统功能,可受癌症和治疗以外其他因素的影响,包括参与诱导,调节和执行肿瘤靶向免疫的基因变化;通过病毒感染或药理学试剂导致全身免疫抑制;以及肠道微生物群的组成。此外,人体系统的多种因素可以改变全身免疫微环境,有利于产生具有免疫抑制活性的未成熟骨髓细胞,通过改变肠道微生物组(生态失调),以及释放细胞因子和其他淬灭抗癌免疫的因子影响应答。许多这些变化可能参与促进肿瘤抵抗治疗,因此构成了开发新型治疗干预的有希望的目标。这些和其他一些循环因子能够提示免疫效应细胞的功能从而知道治疗决策。已知的外周血组成的其他几个特征与ICI反应有关,包括总淋巴细胞计数,T细胞克隆性,单核细胞计数,循环Treg细胞水平,细胞因子水平(例如,IL-6,IL-8和IL-10), 相对嗜酸性粒细胞计数,循环单核细胞或MDSCs和乳酸脱氢酶(LDH)活性。
癌症患者从免疫治疗中获益的程度取决于其整体免疫系统功能,可受癌症和治疗以外其他因素的影响,包括参与诱导,调节和执行肿瘤靶向免疫的基因变化;通过病毒感染或药理学试剂导致全身免疫抑制;以及肠道微生物群的组成。此外,人体系统的多种因素可以改变全身免疫微环境,有利于产生具有免疫抑制活性的未成熟骨髓细胞,通过改变肠道微生物组(生态失调),以及释放细胞因子和其他淬灭抗癌免疫的因子影响应答。许多这些变化可能参与促进肿瘤抵抗治疗,因此构成了开发新型治疗干预的有希望的目标。这些和其他一些循环因子能够提示免疫效应细胞的功能从而知道治疗决策。已知的外周血组成的其他几个特征与ICI反应有关,包括总淋巴细胞计数,T细胞克隆性,单核细胞计数,循环Treg细胞水平,细胞因子水平(例如,IL-6,IL-8和IL-10), 相对嗜酸性粒细胞计数,循环单核细胞或MDSCs和乳酸脱氢酶(LDH)活性。
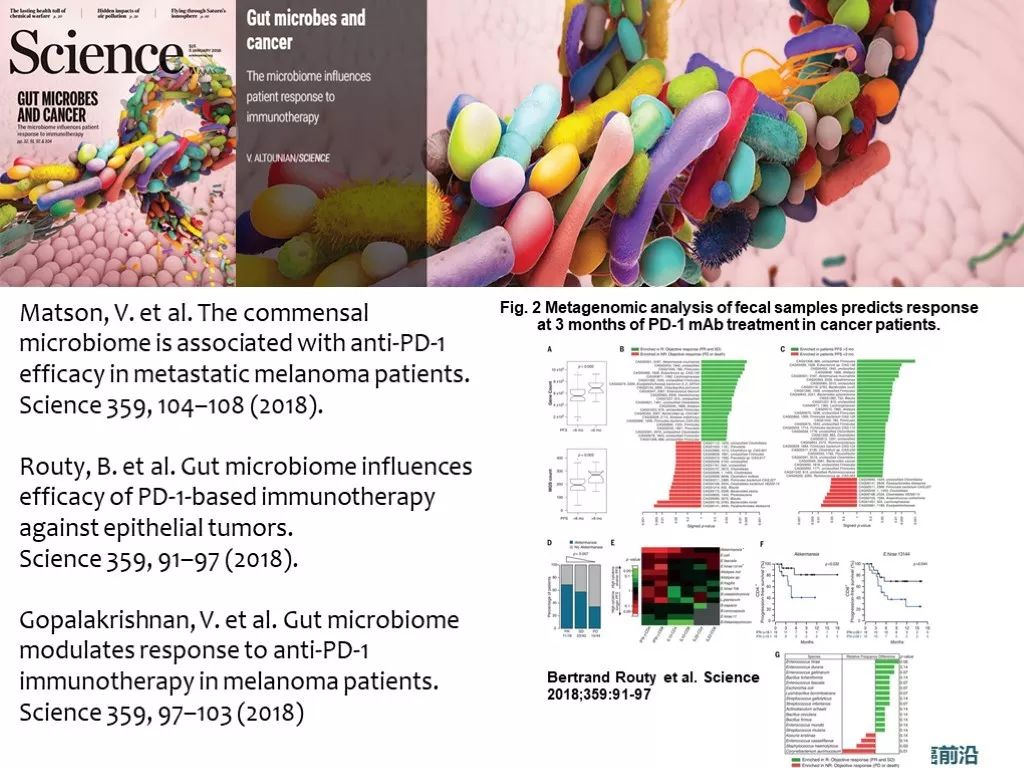 共栖微生物,就是俗称 肠道菌群,可能对健康人群的免疫反应与疾病免疫应答疗效产生影响。更重要的是,目前看起来肠道菌群而非口腔菌群的组成和多样性能够影响免疫检查点抑制剂治疗的疗效。自2011以来,关于microbiota与肿瘤免疫应答之间关系的高影响力研究 陆续见刊。
共栖微生物,就是俗称 肠道菌群,可能对健康人群的免疫反应与疾病免疫应答疗效产生影响。更重要的是,目前看起来肠道菌群而非口腔菌群的组成和多样性能够影响免疫检查点抑制剂治疗的疗效。自2011以来,关于microbiota与肿瘤免疫应答之间关系的高影响力研究 陆续见刊。
2015年,SCIENCE 杂志上发表了一项来自法国的免疫学家Laurence Zivogel博士领导的研究小组发现,CTLA-4抗体治疗的T细胞应答,与肠道中多形拟杆菌(B. thetaiotaomicron)和脆弱类杆菌(B. fragilis)的存在有关,他们证明了,通过脆弱类杆菌移植,可以增强CTLA-4抗体疗法的抗癌特性。同年,SCIENCE上还发表了芝加哥大学的Thomas Gajewski研究团队,证明了肠道中双歧杆菌属(Bifidobacterium)的存在,有利于PD-L1抑制剂的抗肿瘤效果。
2018年 1月 SCIENCE连发三篇文章,阐述了肠道微生物菌群,抗生素使用,与黑色素瘤,肺癌,肾癌,尿路上皮癌对免疫抑制剂治疗应答产生了影响。这几项研究中发现的“能够增强免疫应答的菌群”不完全一致,但同样都提示,肠道菌群多样性的增加能够有益于提高肿瘤对CPI治疗的应答。
抗生素对免疫治疗的疗效可能产生影响 Routy 研究中发现 在接受免疫检查点抑制剂治疗前的2个月内或者治疗后1个月内接受广谱抗生素 broad-spectrum combination ATB (氨苄青霉素+粘菌素+链霉素) ,PFS/OS 都相对较未接受抗生素治疗患者更短,分析人群 :advanced NSCLC (n = 140), RCC (n = 67), or urothelial carcinoma (n = 42) ,其中69例接受ATB治( β-内酰胺+/-抑制剂,氟喹诺酮类或大环内酯类),其他研究中发现 在免疫检查点抑制剂使用前30天内使用 β内酰胺和氟喹诺酮 类抗生素可能影响疗效。Derosa et al Ann Onc 2018。
含有特定肠道微生物群的患者接受免疫治疗疗效好。Routy 等对 PD-1/PD-L1 抑制剂治疗反应良好或没有反应的患者的肠道菌群进行分析,发现 AKK 菌(Akkermansia muciniphila)普遍存在于那些接受过 ICIs 治疗之后达到缓解疗效的患者体内,那些抗PD-1疗法治疗效果很差的患者,体内缺乏一种叫做Akkermansia muciniphila的细菌。而将 无应答患者的肠道菌群移植到小鼠模型后,同时补充这种细菌,则小鼠能重新获得免疫应答。
Gopalakrishnan 等以 112 例接受过抗 PD-1 免疫疗法的晚期黑色素瘤患者为研究对象,分析了患者粪便中微生物的多样性,发现肠道菌群与 PD-1 抗体的疗效有关;对 PD-1 抗体治疗有反应的 30 名患者与没有反应的 13 名患者的肠道菌群明显不同,PFS 获益者体内普遍存在 Faecalibacterium 和 Clostridiales 两种细菌。
Matson 等发现,相比于 26 名对免疫治疗没有反应的黑色素瘤患者,包括长双歧杆菌(Bifidobacterium longum)、产气柯林斯菌(Collinsella aerofaciens)和屎肠球菌(Enterococcus faecium)在内的几种特定细菌在 16 名对 ICIs 作出反应的患者中更加丰富;定量患者体内「好」菌群和「坏」菌群的比例显示,「好」菌群/「坏」菌群>1.5 与更好的免疫治疗疗效相关。

L. Zitvogel, Y. Ma, D. Raoult, G. Kroemer, T. F. Gajewski, The microbiome in cancer immunotherapy: Diagnostic tools and therapeutic strategies. Science 359, 1366–1370 (2018).
肠道微生物群改善免疫治疗疗效的机制可能包括,包括:益生菌能增加肿瘤组织中 IL-12 依赖的 CCR9+CXCR3+CD4+ T 细胞向瘤床的募集;增强 DC 功能和 Th1 反应,进而引起肿瘤组织及肠道 CD8+T 细胞增殖和活化;下调 CD4+ Treg 细胞的数量等。 有假说认为假说认为微生物组能通过其抗原激活T细胞的应答,或是直接作用于肿瘤特异的免疫应答,或是交叉影响到肿瘤特异的抗原。肠道微生物在固有免疫和适应性免疫中扮演着终身的重要角色,它们精确而有序的参与者炎症,感染,对事物和其他共栖抗原的免疫应答和免疫耐受。
 2018年11月12日,Nature Medicine发表了一份病例报告,2名癌症患者在接受粪菌移植后,由免疫治疗引起的结肠炎得到显著缓解。该研究初步数据分析表明,利用健康肠道微生物可以消除免疫检查点抑制剂治疗引起的结肠炎,重建患者的肠道菌群,并相对增加结肠粘膜中调节性T细胞的比例。该研究是人们首次证明粪菌移植对免疫治疗相关并发症有着良好的治疗效果。Nature Medicine报道的这项最新研究强调了粪菌移植在治疗癌症免疫治疗副作用方面的巨大潜力。
2018年11月12日,Nature Medicine发表了一份病例报告,2名癌症患者在接受粪菌移植后,由免疫治疗引起的结肠炎得到显著缓解。该研究初步数据分析表明,利用健康肠道微生物可以消除免疫检查点抑制剂治疗引起的结肠炎,重建患者的肠道菌群,并相对增加结肠粘膜中调节性T细胞的比例。该研究是人们首次证明粪菌移植对免疫治疗相关并发症有着良好的治疗效果。Nature Medicine报道的这项最新研究强调了粪菌移植在治疗癌症免疫治疗副作用方面的巨大潜力。
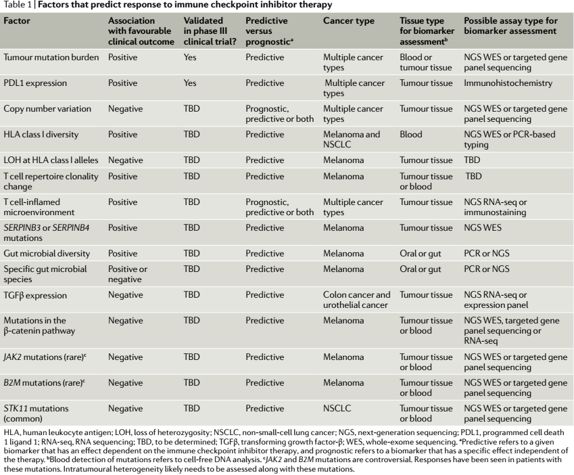
Jonathan J. Havel, Diego Chowell & Timothy A. Chan Nature Reviews Cancer (2019)
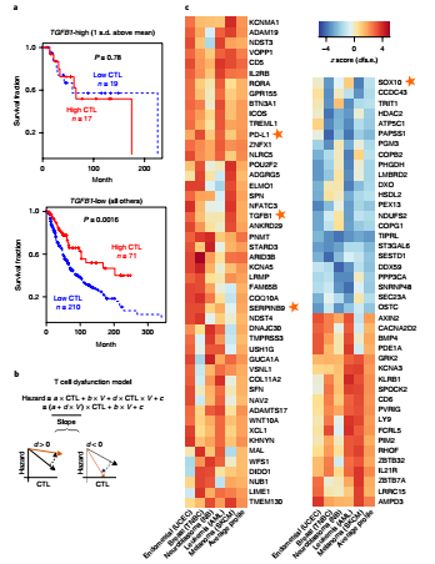
总而言之,我们远没有像期待的那样找到一个统一的免疫检查点抑制剂疗效生物标志物。如下图所示,需要找到一种预测模型可以讲所以上述讨论过的因素综合考虑,但是目前将这些海量的信息整合进临床决策仍然存在巨大的挑战。
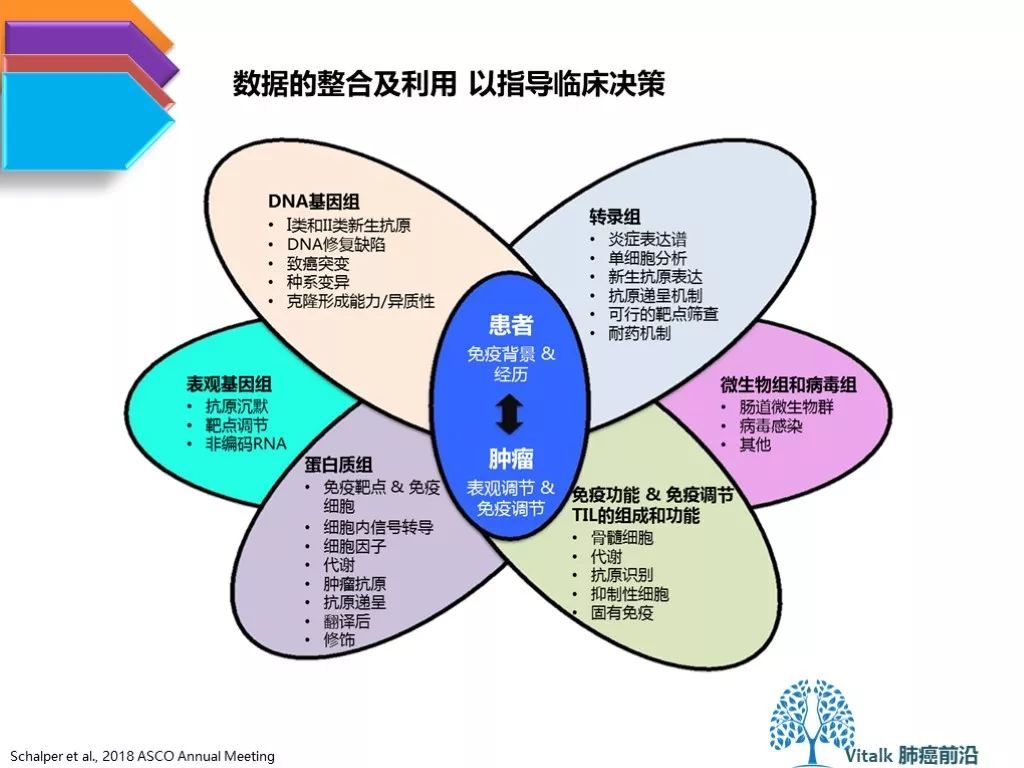 1.需要整合基因组学,表观遗传学和免疫原性异质性的信息。对于肿瘤微环境的多点,动态取样(在整个治疗开始前和治疗进行中)可能克服由于肿瘤进化和肿瘤异质性带来的bias。但可操作性的挑战巨大。 2.详细研究包括生物能量代谢,自噬,细胞衰老和免疫调节在内的这些过程,如何在基质,内皮细胞和免疫浸润中起作用,以及这些功能如何在抗肿瘤免疫调节中连接在一起。 3.尽管免疫组化能够有效染色细胞内或膜结合蛋白,但是肿瘤微环境中的细胞因子的检测仍然是挑战。 在现在和未来的临床试验/临床实践中,如何对患者的微生物组进行有效监测?
1.需要整合基因组学,表观遗传学和免疫原性异质性的信息。对于肿瘤微环境的多点,动态取样(在整个治疗开始前和治疗进行中)可能克服由于肿瘤进化和肿瘤异质性带来的bias。但可操作性的挑战巨大。 2.详细研究包括生物能量代谢,自噬,细胞衰老和免疫调节在内的这些过程,如何在基质,内皮细胞和免疫浸润中起作用,以及这些功能如何在抗肿瘤免疫调节中连接在一起。 3.尽管免疫组化能够有效染色细胞内或膜结合蛋白,但是肿瘤微环境中的细胞因子的检测仍然是挑战。 在现在和未来的临床试验/临床实践中,如何对患者的微生物组进行有效监测?











 苏公网安备32059002004080号
苏公网安备32059002004080号


