尽管以奥希替尼为代表的三代EGFR-TKI显著改善了EGFR敏感突变NSCLC患者的PFS,但仍不可避免会出现疾病进展,且奥希替尼的耐药机制具有高度异质性,其中MET扩增和EGFR C797S突变最为常见。对于EGFR-TKI耐药后NSCLC患者的治疗仍以化疗为主;既往研究显示免疫联合化疗较单纯化疗未取得显著的生存获益,在此基础上联合抗血管治疗取得一定的PFS获益,然而未观察到OS的显著性获益。因此,对于EGFR-TKI耐药后NSCLC人群,探寻更优的诊疗策略成为临床研究的热点方向。MARIPOSA-2研究是全球首个针对奥希替尼治疗进展后EGFR敏感突变NSCLC人群取得PFS显著获益的III期临床研究,基于此研究,埃万妥单抗联合化疗(ACP方案)已陆续被FDA,EMA等批准相应适应症,且NCCN指南已将其列为唯一优先治疗方案。更具里程碑意义的是,近日,国家药品监督管理局(NMPA)正式批准ACP方案用于EGFR-TKI经治且携带EGFR经典突变晚期非鳞状NSCLC。【肿瘤资讯】特邀MARIPOSA-2研究的中国主要研究者中国医学科学院肿瘤医院王洁教授深度解读和剖析埃万妥单抗联合化疗带来的突破性进展。
中国医学科学院肿瘤医院院长助理
中国医学科学院肿瘤医院山西医院总院长
中国医学科学院肿瘤医院内科主任
2021年何梁何利基金科学技术与进步奖获得者
中国临床肿瘤学会(CSCO)副理事长
中国医师协会肿瘤多学科专委会主任委员
CSCO 非小细胞肺癌专家委员会主任委员
CSCO 小细胞肺癌专家委员会副主任委员
中国抗癌协会非小细胞肺癌专业委员会副主任委员
北京医学会肿瘤分会副主任委员
北京慢性病防治与健康教育研究会副会长
三代EGFR-TKI耐药机制复杂,使其耐药后的诊疗更具挑战性
不可避免的耐药始终是EGFR-TKI面临的挑战和难题。既往研究数据显示,奥希替尼一线治疗的耐药机制复杂,其中最常见的获得性耐药机制为MET扩增与EGFR C797S突变,此外,有39%的患者存在≥2个耐药突变[1],提示这部分人群具有高度异质性。对于EGFR-TKI耐药后EGFRm NSCLC患者,既往多以化疗为主,然而疗效欠佳。一项真实世界研究显示单纯化疗的中位TTD时间仅2.1个月,中位OS为9.8个月[2]。
近年来,以免疫为基础的联合治疗模式在EGFR-TKI耐药后NSCLC人群中进行了诸多探索,然而结果却不尽如人意。CheckMate 722研究和KEYNOTE-789研究均探索了免疫联合化疗在EGFR-TKI耐药后NSCLC人群中的疗效,遗憾的是,两项研究均未达到主要研究终点[3,4]。此外,ORIENT-31研究显示免疫联合化疗和抗血管治疗相较单纯化疗可显著改善PFS,但OS无获益趋势[5]。
因此,如何基于EGFR-TKI的耐药机制,深度探寻新的治疗模式或新型药物,以进一步优化耐药后NSCLC人群的治疗策略是临床亟待解决的挑战。
追本溯源,埃万妥单抗重塑EGFR-TKI耐药后NSCLC治疗格局
埃万妥单抗是一种全人源化EGFR/MET双特异性抗体,具有配体抑制、受体降解和免疫细胞导向活性多重作用机制,联合化疗可进一步克服奥希替尼的复杂性耐药(图1)[6]。
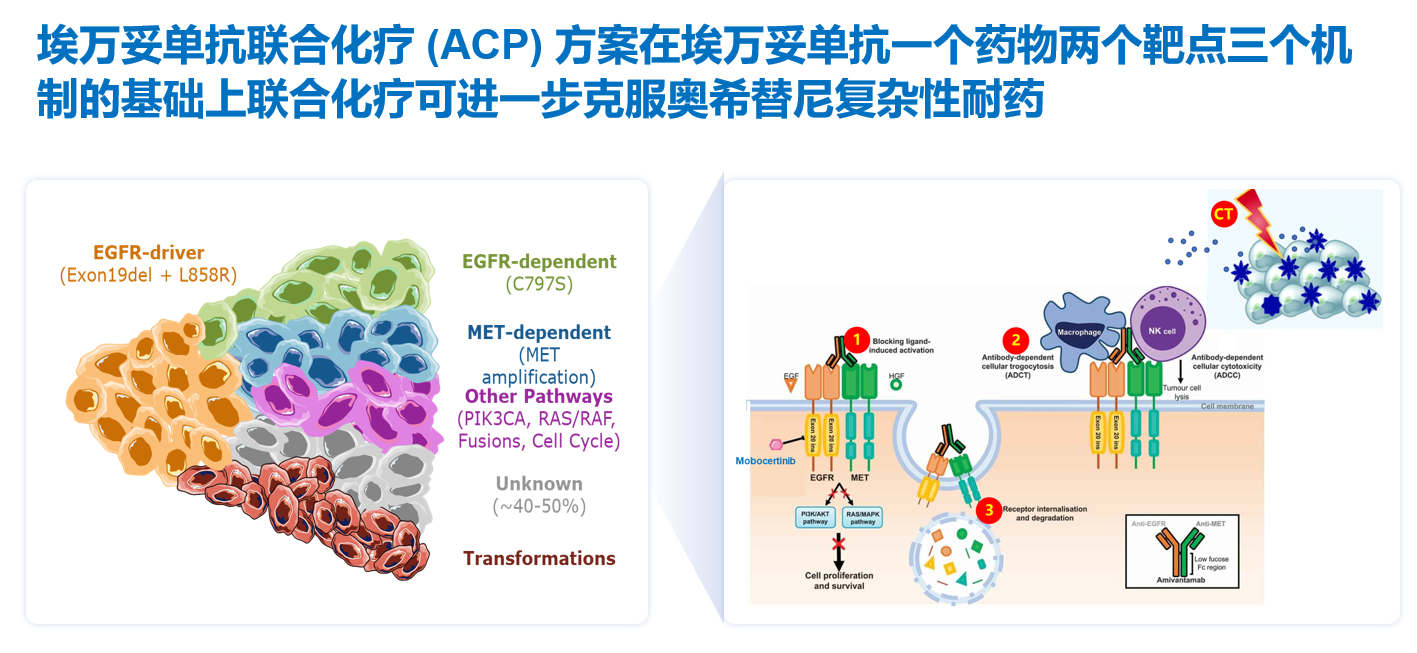
MARIPOSA-2研究是一项全球多中心、随机对照III期临床研究,旨在评估埃万妥单抗联合化疗治疗奥希替尼耐药后EGFR突变晚期NSCLC患者的疗效和安全性。主要研究终点为BICR评估的PFS,关键次要研究终点包括ORR,OS等(图2)[7]。
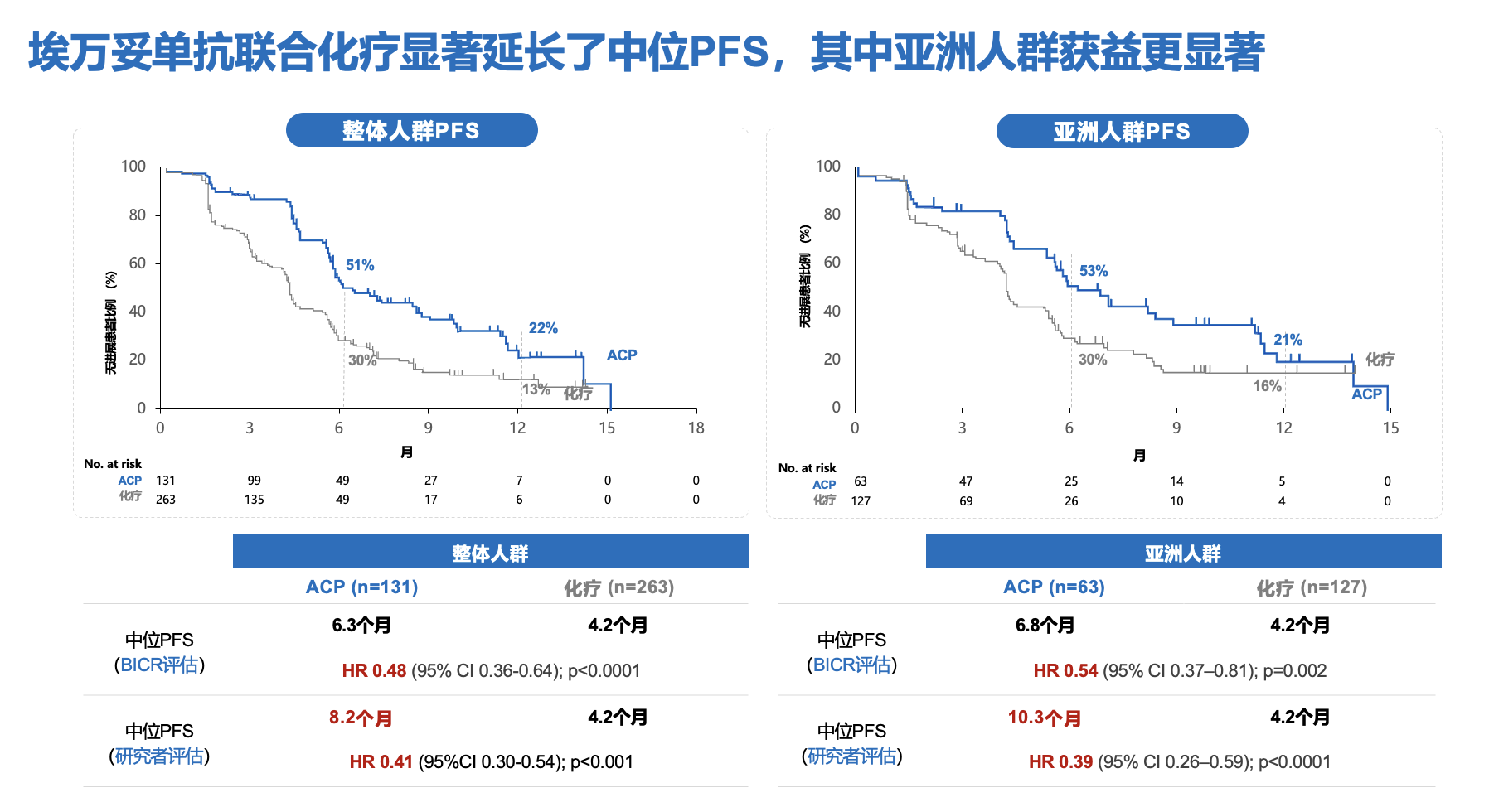
中位随访8.7个月后,埃万妥单抗联合化疗相较单纯化疗在奥希替尼耐药后EGFRm NSCLC患者中展现出具有统计学差异和临床意义的中位PFS改善;两组经BICR评估的中位PFS分别为6.3个月和4.2个月,降低了52%的疾病进展或死亡风险(HR=0.48,95%CI 0.36-0.64,P<0.001)[7]。值得关注的是,在亚洲人群中,埃万妥单抗联合化疗组经研究者评估的中位PFS达10.3个月,而单纯化疗组仅为4.2个月,降低了61%的疾病进展或死亡风险(HR=0.39. 95%CI 0.26-0.59)(图3)[8]。
此外,脑转移始终是EGFR突变NSCLC诊疗的难题。在MARIPOSA-2研究中,有45%的患者基线存在脑转移病史。结果显示,相较单纯化疗,ACP可明显降低颅内疾病进展或死亡风险,ACP组的中位颅内PFS达12.5个月;其中,对于既往未接受过脑放疗的人群,ACP组的颅内PFS获益更显著,降低了64%的颅内疾病进展或死亡风险,提示埃万妥单抗联合化疗可预防或延缓脑转移(图4)[7]。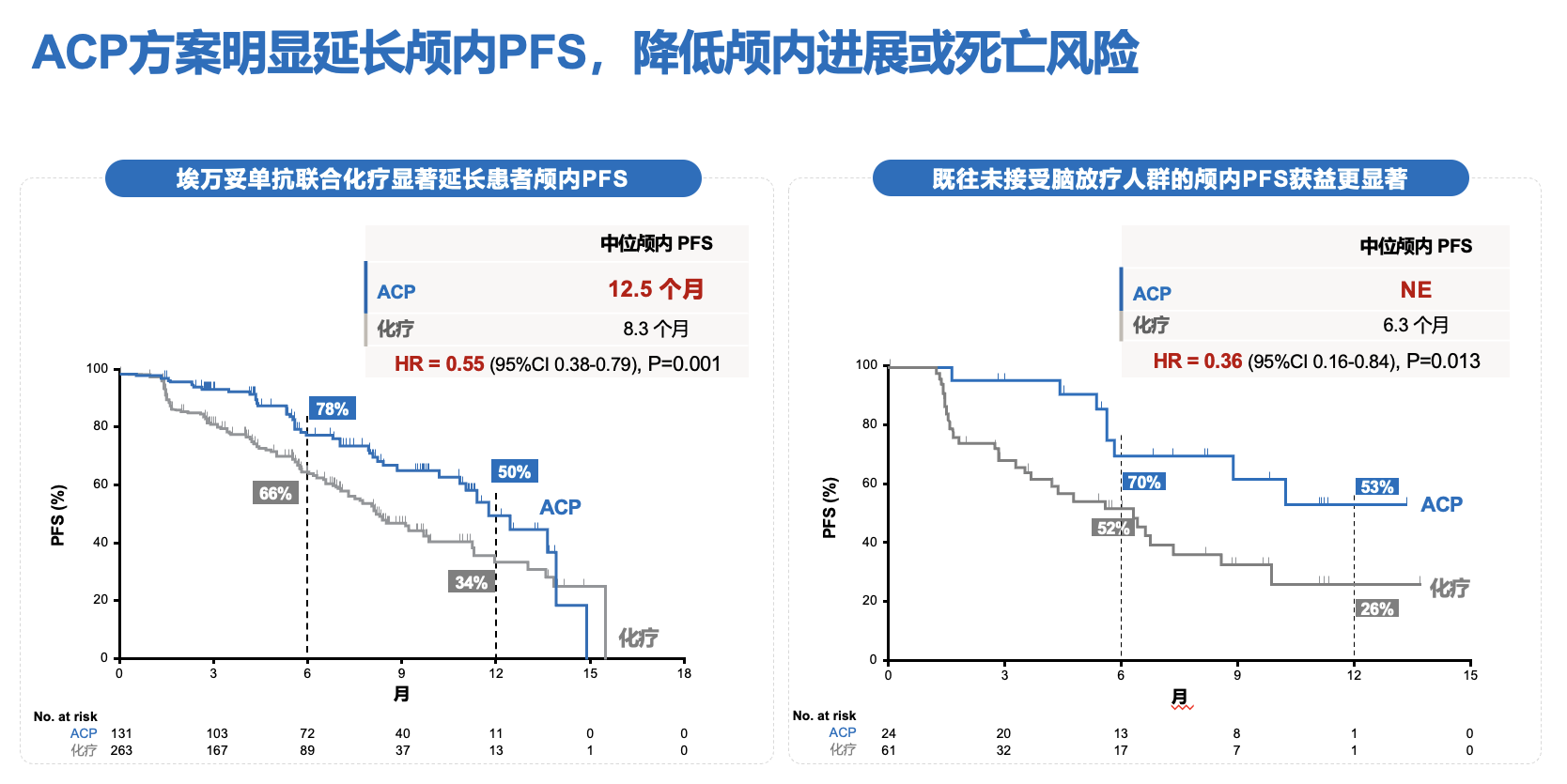
在肿瘤缓解方面,相较单纯化疗,埃万妥单抗联合化疗可显著降低患者肿瘤负荷,两组的ORR分别为64%和36%(OR=3.1; P<0.001);且一旦达到肿瘤缓解的患者,中位缓解持续时间明显延长,埃万妥单抗联合化疗组的中位DoR为6.9个月(图5)[7]。在亚洲人群中,埃万妥单抗联合化疗同样展现出明显的肿瘤缓解,两组BICR评估的ORR分别为66%和32%(OR=4.0; P<0.0001)[8]。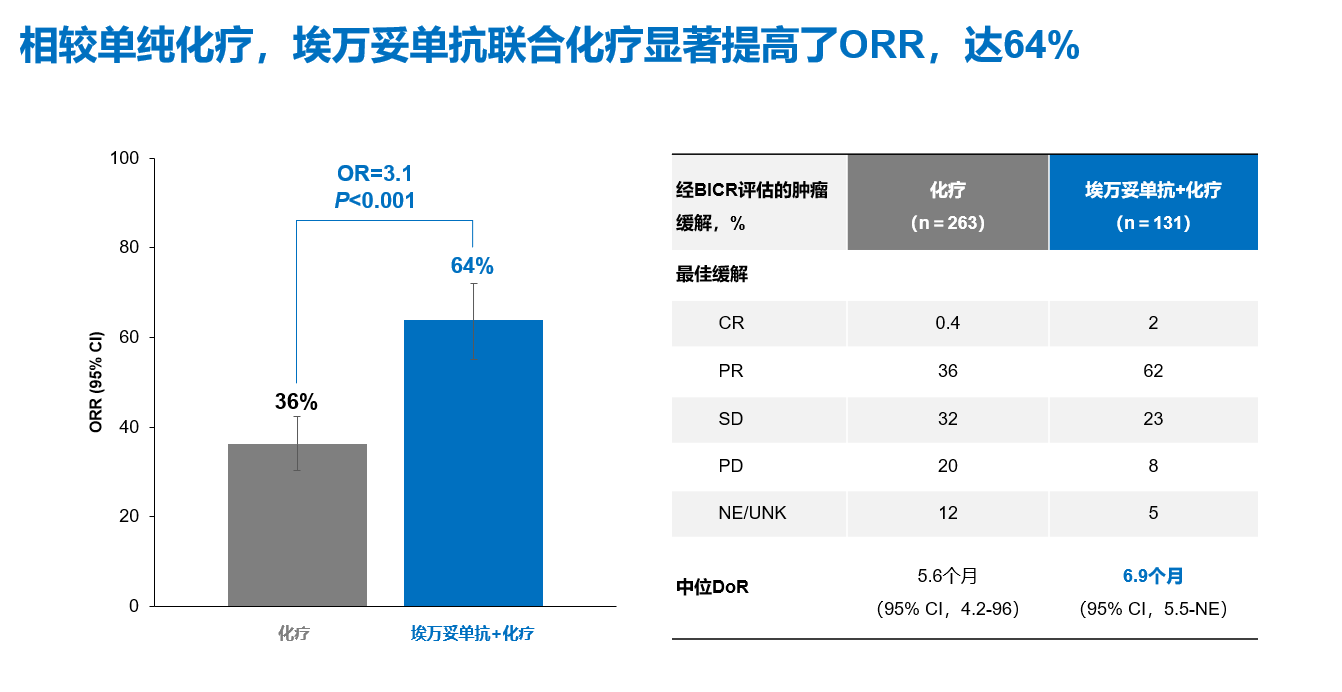
数据截止2024年4月26日(中位随访时间18.1个月),相较单纯化疗,埃万妥单抗联合化疗OS获益趋势更显著,HR由0.77降至0.73,且95%置信区间上限<1 (HR=0.73; 95%CI 0.54-0.99)(图6)[9]。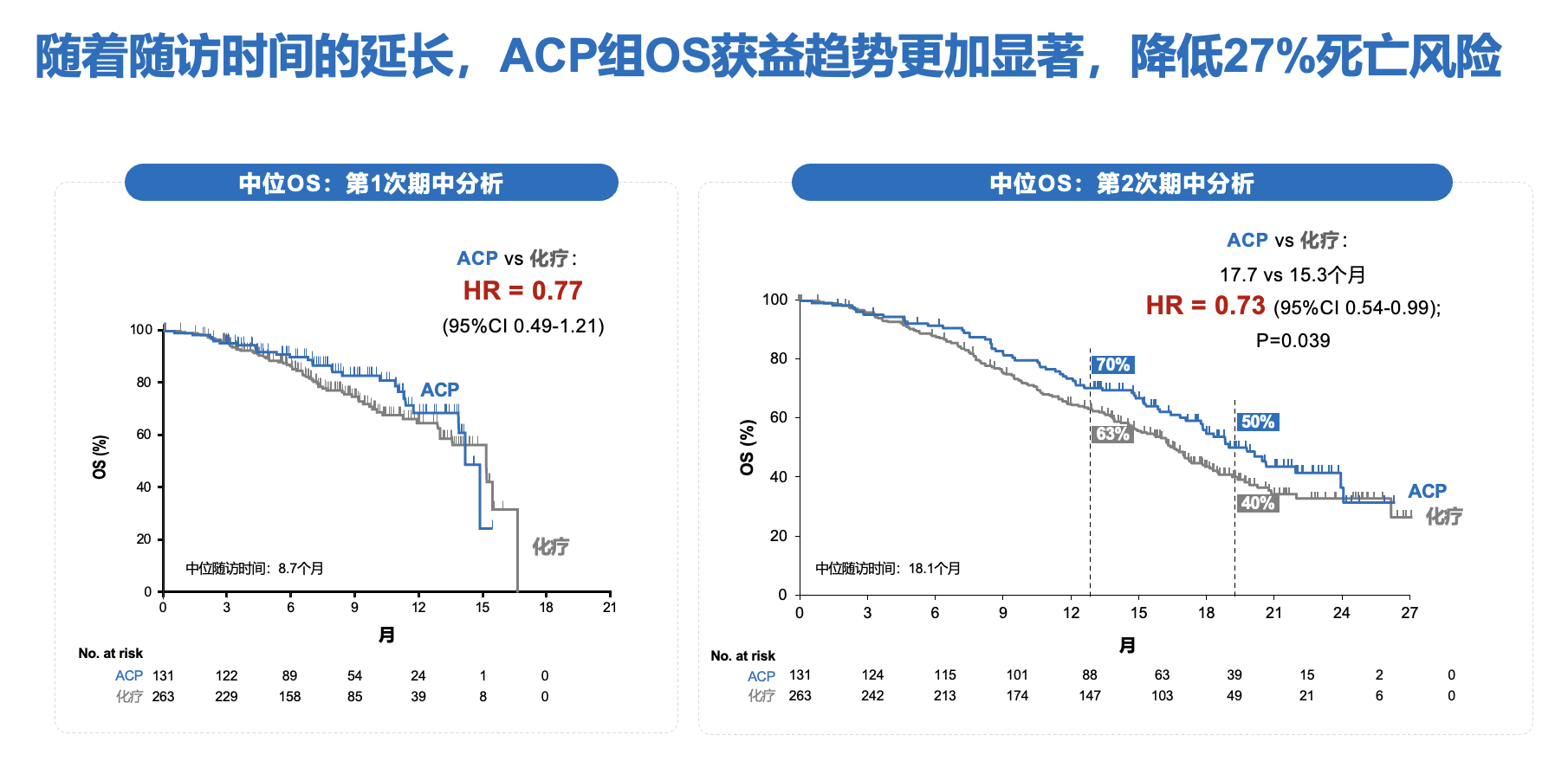
安全性方面,整体可控可管理,大部分不良事件为1~2级;ACP组和化疗组3级及以上常见AE主要为血液学毒性,其中以中性粒细胞减少、血小板减少、贫血和白细胞减少为主,常见于第1周期。此外,ACP组皮疹和IRR均以1~2级为主,且因其导致治疗中断的发生率均较低;两组VTE发生率相当,且在初次发生VTE的患者中,没有患者接受预防性抗凝治疗[7]。目前包括SKIPPirr研究[10]、COCOON研究[11]等多种预防性管理策略可显著降低IRR、皮疹和VTE的发生率,进一步优化患者管理。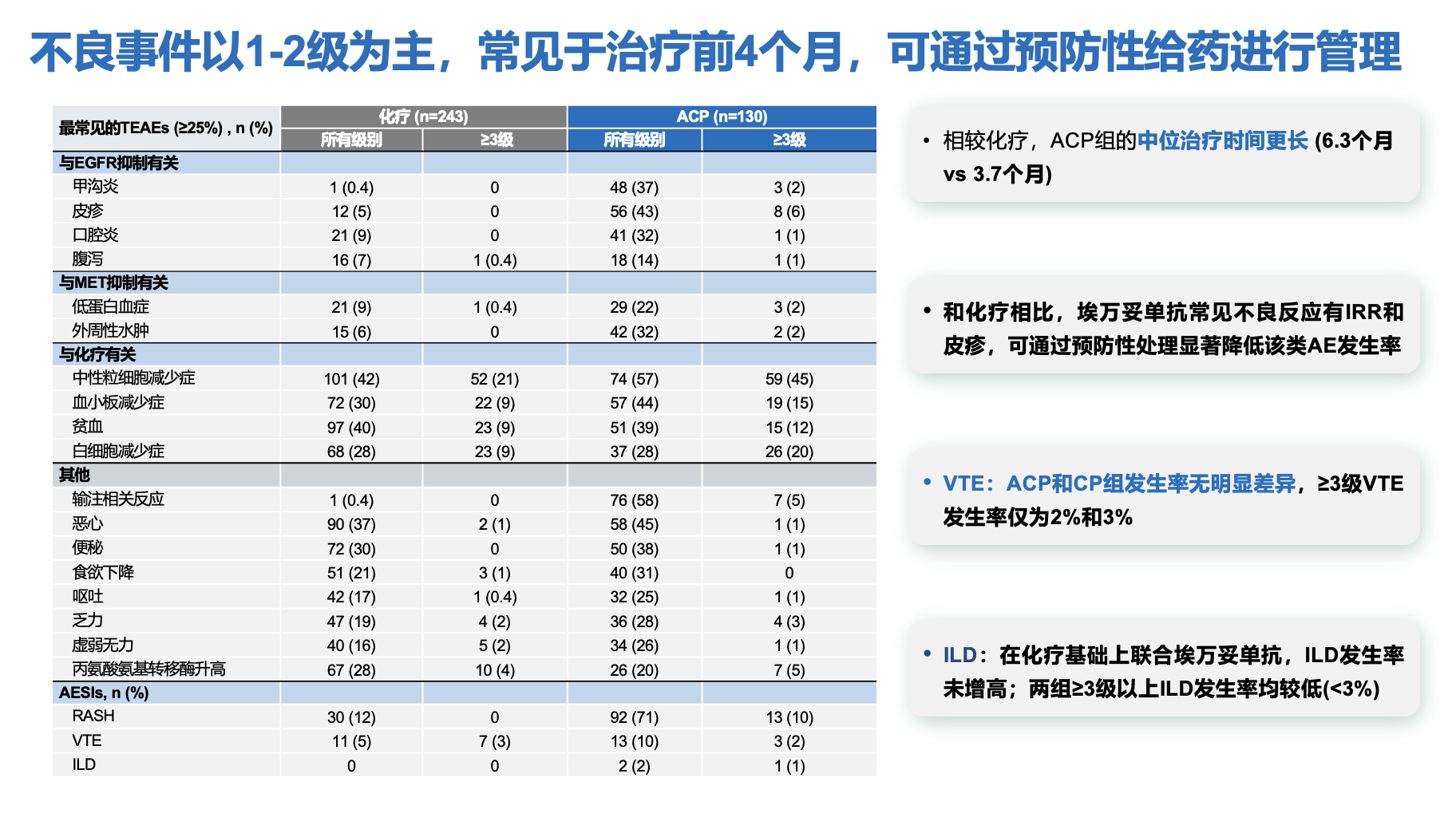
填补国内治疗空白,埃万妥单抗开启国内EGFR-TKI耐药后诊疗新篇章
MARIPOSA-2研究是全球首个证实靶向联合方案在奥希替尼经治EGFR敏感突变NSCLC人群中有阳性PFS获益的III期临床研究,与单纯化疗相比,埃万妥单抗联合化疗降低了52%的疾病进展或死亡风险。从作用机制来看,埃万妥单抗对奥希替尼耐药后的EGFR C797S、MET扩增以及其他EGFR/MET依赖性耐药具有明显的抑制作用;此外,化疗对于EGFR/MET非依赖性耐药具有一定疗效,因此,埃万妥单抗联合化疗可广泛克服奥希替尼进展后的多种复杂性耐药。基于此,目前包括FDA、EMA均已批准其用于EGFR-TKI耐药后NSCLC人群,且包括NCCN非小细胞肺癌等指南已将其列为奥希替尼进展后的推荐治疗[12-15]。
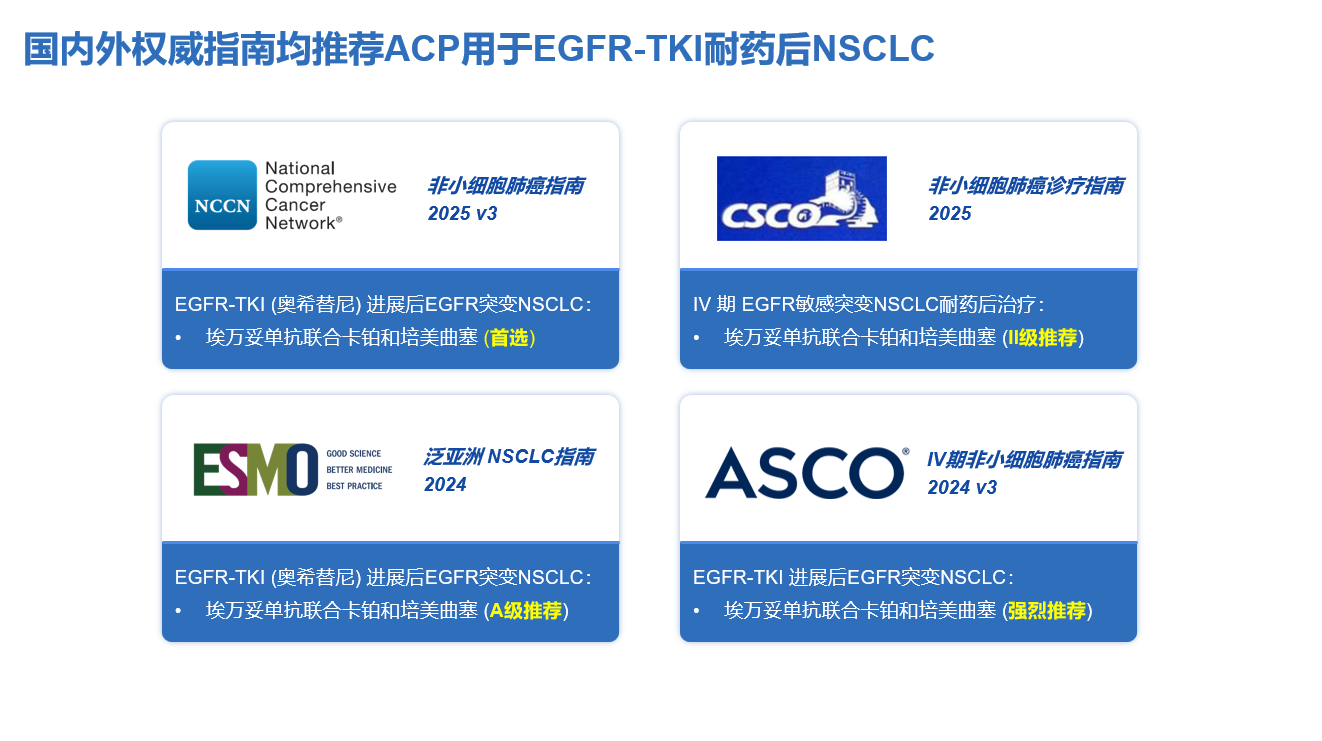
更具里程碑意义的是,近日,NMPA正式批准埃万妥单抗联合化疗用于治疗携带EGFR 经典突变且在EGFR TKIs治疗期间或之后疾病进展的局部晚期或转移性NSCLC患者,有望成为EGFR-TKI耐药后NSCLC新的标准治疗,开启了国内EGFR-TKI耐药后NSCLC人群全新的诊疗格局。
[1] Chmielecki J, Gray JE, Cheng Y, et al. Candidate mechanisms of acquired resistance to first-line osimertinib in EGFR-mutated advanced non-small cell lung cancer. Nat Commun. 2023;14(1):1070. doi:10.1038/s41467-023-35961-y
[2] Griesinger F, et al. 2024 ELCC. 25P.
[3] Mok T, Nakagawa K, Park K, et al. Nivolumab Plus Chemotherapy in Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small-Cell Lung Cancer After Disease Progression on Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors: Final Results of CheckMate 722. J Clin Oncol. 2024;42(11):1252-1264. doi:10.1200/JCO.23.01017
[4] Yang JC, Lee DH, Lee JS, et al. Phase III KEYNOTE-789 Study of Pemetrexed and Platinum With or Without Pembrolizumab for Tyrosine Kinase Inhibitor‒Resistant, EGFR-Mutant, Metastatic Nonsquamous Non-Small Cell Lung Cancer. J Clin Oncol. 2024;42(34):4029-4039. doi:10.1200/JCO.23.02747
[5] Lu S, Wu L, Jian H, et al. Sintilimab plus chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer with disease progression after EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): second interim analysis from a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Respir Med. 2023;11(7):624-636. doi:10.1016/S2213-2600(23)00135-2
[6] Vyse S, Huang PH. Amivantamab for the treatment of EGFR exon 20 insertion mutant non-small cell lung cancer. Expert Rev Anticancer Ther. 2022;22(1):3-16. doi:10.1080/14737140.2022.2016397
[7] Passaro A, Wang J, Wang Y, et al. Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol. 2024;35(1):77-90. doi:10.1016/j.annonc.2023.10.117
[8] Jin-Yuan Shih, et al. ESMO Asia. 2023. LBA11.
[9] Sanjay Popat, et al. ESMO 2024. LBA54.
[10] Spira AI, Paz-Ares L, Han JY, et al. Preventing Infusion-Related Reactions With Intravenous Amivantamab-Results From SKIPPirr, a Phase 2 Study: A Brief Report. J Thorac Oncol. Published online January 24, 2025. doi:10.1016/j.jtho.2025.01.018
[11] Nicolas G, et al. 2025 ELCC. 10MO.
[12] NCCN Guidelines®. Non-Small Cell Lung Cancer. Version 3. 2025.
[13] 2025 CSCO 非小细胞肺癌诊疗指南.
[14] Lee SH, Menis J, Kim TM, et al. Pan-Asian adapted ESMO Clinical Practice Guidelines for the diagnosis, treatment and follow-up of patients with oncogene-addicted metastatic non-small-cell lung cancer. ESMO Open. 2024;9(12):103996. doi:10.1016/j.esmoop.2024.103996
[15] Owen DH, Ismaila N, Freeman-Daily J, et al. Therapy for Stage IV Non-Small Cell Lung Cancer With Driver Alterations: ASCO Living Guideline, Version 2024.1. J Clin Oncol. 2024;42(20):e44-e59. doi:10.1200/JCO.24.00762
*截至发布日期
CRC Code: EM-180827
Approved Date: 2025-04-22
排版编辑:肿瘤资讯-TJ
✅ “本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。强生创新制药不支持、不鼓励任何未被批准的药品/适应症使用。”











 苏公网安备32059002004080号
苏公网安备32059002004080号


