随着酪氨酸激酶抑制剂(TKI)的出现,慢性粒细胞白血病(CML)的治疗目标正逐渐发生改变。TKI治疗达到对CML的长期控制一直是大多数患者的治疗目标。近年来,无治疗缓解(TFR)更多地被当作治疗的主要目标。通过RT-qPCR检测BCR-ABL1信使RNA表达水平是CML治疗反应评估的主要方法。在特定时间达到相应的分子生物学标准可以最合理地确定患者的预后及治疗失败风险。深度且持续的分子生物学反应已成为TFR的患者新的治疗目标。近日,Blood杂志上发表了一篇综述,结合3个病例,详细介绍了CML分子学监测的深度、频率及其对治疗的影响。
EMR、MMR和DMR:不同的缓解目标选择和预后意义
传统而言,早期分子生物学缓解(EMR)被定义为TKI治疗开始后3个月BCR-ABL1≤10%(IS)。作为早期预测因子,EMR是一个重要预后预测指标,但基于这个单一结果来改变治疗方案的证据尚不充分,因为一些未能达到EMR的患者仍可达到最佳预后。NCCN指南建议,对于治疗后3个月BCR-ABL1拷贝数仅稍高于10%的患者,需谨慎评估BCR-ABL1检测值,特别是在患者的检测值从初始基线迅速下降的情况下。结合3个月和6个月的疾病进行重新评估可能进一步帮助区分患者,但在某些病例中,也可能造成未能及时地换用更有力的治疗方案。未能达到EMR的患者的另一个区别是BCR-ABL1下降的速度。尽管EMR对临床医生来说是一个预后判断的早期指标,但在未达到EMR的情况下,关于更换TKI的共识很少。
尽管欧洲白血病网(ELN)和欧洲肿瘤学会(ESMO)研究将12个月时达到MMR归为最理想的治疗反应,但NCCN指南将在此时间节点分子生物学<1%作为目标(表1)。数据冲突导致达到MMR的时间节点不明确。尽管尚不清楚12个月达到MMR是否会提高生存预后,但早期达到MMR预示着后续可达到并有利于维持稳定的MR4.5(即MR4.5持续2年),这对实现终止治疗很重要。
表1 CML一线治疗的关键节点
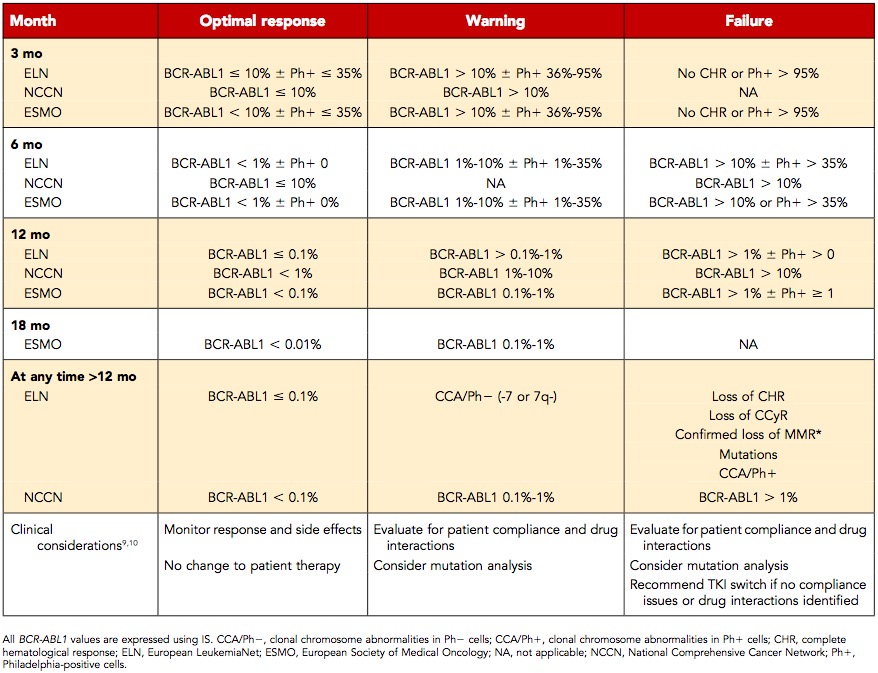
有研究显示了TFR在特定患者人群中的安全性和可行性,TFR现已纳入全球指南。在各种停药研究中,40%~60%的患者成功实现了TFR。分子生物学缓解的持续时间和深度直接决定是否可追求TFR。由于测定和样品灵敏度的显著变化,“完全分子生物学缓解”BCR-ABL1转录本无法被检出,但由于检测和样本之间存在很大差异而很大程度上已经被废弃。“深度分子生物学缓解(DMR)”是一种更好的表达方法,关于DMR的各种定义描述了相对于标准化基线的治疗缓解深度(例如,MR4为较基线减少≥4-log或≤0.01%BCR-ABL1)。达到和维持DMR是目前追求TFR资格的基本要求。尽管TKI停药前最佳分子生物学缓解深度和DMR的持续时间尚不明确,但有证据表明≥24个月的持续DMR与TFR成功率相关。
病例1
患者男性,52岁,相关检查示白细胞显著增多,伴有骨髓中中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞明显增多。骨髓活检证实该患者为CML慢性期(CP),染色体核型分析显示有费城染色体。外周血分子生物学检测显示BCR-ABL1 融合基因拷贝的RT-qPCR结果为90%(IS)。该患者的Sokal评分高,开始接受尼洛替尼治疗,每日2次,每次300mg。 在治疗的6周内达到完全血液学缓解。尼罗替尼治疗后1个月和3个月的BCR-ABL1拷贝分别为80%和25%。
该患者继续尼洛替尼300mg,每日2次治疗,并且在6个月时,BCR-ABL1定量为14%(IS),遂转而使用达沙替尼治疗。然而该患者对达沙替尼的反应轻微,并且在3个月内BCR-ABL1定量增至53%(IS)。突变分析显示出现TKI耐药的T315I突变,因此更换为普纳替尼并计划进行异体造血干细胞移植。普纳替尼未能产生更好的反应,3个月后,该患者继续进行同种异体干细胞移植,之后BCR-ABL1定量高至无法检测。
病例1评论:定期进行分子生物学监测,及时发现耐药突变
该患者是CML中对所有TKI药物耐药的罕见病例,定期监测是确定未达目标缓解和突变产生的关键,并且在早期就认识到异体造血干细胞移植是该患者的唯一选择是十分重要的。
我们建议所有人在最初进行BCR-ABL1定量检测基线水平。在开始TKI治疗后,通常建议每3个月进行BCR-ABL1的RT-qPCR检测,直至达到稳定的MMR,之后每3~6个月进行1次检测。更频繁的分子生物学监测(每年3~4次检测)与依从性增加相关,提示每3个月1次的BCR-ABL1检测可能会改善患者的药物依从性。我们建议尽可能保持每3个月1次的检测频率,特别是在以下人群中:①患者达到MMR,但存在依从性问题;②患者希望在将来达到TFR,因此需要达到持续的深度缓解(DMR);③患者换用新的TKI药物。建议在以下特定情况下进行每月监测:①因妊娠停用TKI药物的患者;②进入TFR的患者TKI停药后前6个月;③患者进入TFR超过6个月,未达MR4.5但仍达MMR。
KD突变是TKI耐药的最明确机制,应在TKI治疗失败的患者中进行突变筛查。未能达到时间节点的治疗目标和治疗未缓解的患者应检测是否存在突变。直接(Sanger)测序是目前公认的用于研究KD突变的技术,但它的灵敏度相对低,假设BCR-ABL1定量≥1%,该方法只能检测出费城染色体阳性的细胞≥10%~20%样本的突变。由于停用TKI后,突变可能难以检测,因此应在停用TKI之前进行突变分析。
病例2
患者女性,34岁, 6年前被诊断为CML,目前考虑怀孕。 诊断时Sokal评分很低,使用伊马替尼400mg/d进行治疗,耐受性良好。在伊马替尼治疗18个月后,该患者达到并始终保持MMR,尽管药物依从性很好,但尚未能达到持续的且更深层次的缓解。
该患者希望怀孕前能达到TFR。该患者使用伊马替尼治疗不太可能在合理的时间内达到DMR。能安全停药非常重要,而且该患者用药时间相对较短,所以尼洛替尼或达沙替尼对该患者而言是更好的选择。该患者换用尼洛替尼治疗并迅速达到MR4.5。该患者在TKI治疗2.5年内尝试达到TFR,并且已经停止治疗超过12个月。
病例2评论:选择更有效的TKI以达到DMR
通过一线伊马替尼治疗未能实现DMR的患者改为二线治疗已被证实为一种成功的治疗策略,但为达到DMR而选择的TKI应根据其毒性进行调整。在不以TFR为治疗目标的患者(即老年人和具有显著合并症的患者)中以MMR或CCyR而非DMR作为治疗目标,并且根据治疗目标调整药物选择。
在TKI治疗期间,需要告知患者及其家属,建议患者避免妊娠,并且应在开始TKI治疗前讨论育龄期患者生育能力的保留。 由于出生畸形和流产的风险,TKI应在受孕前停用,并且在分娩后再重新开始治疗。同时, 我们建议对妊娠患者进行每月监测,并且在BCR-ABL1值接近1%后,使用α干扰素治疗直至分娩。只要避免母乳喂养,TKI可在分娩后立即重新应用。
病例3
患者男性,50岁,过去的14年中接受伊马替尼400mg/d的治疗,为尝试TFR而停用了伊马替尼。诊断时,该患者Sokal风险评分是中级。治疗后3个月内,该患者达到EMR,12个月内达到MMR。但伊马替尼引起的重度疲劳和胃肠道毒性促使该患者尝试TFR。 伊马替尼治疗12年后,该患者达到MR4.5,并在维持MR4.5 24个月后停用了伊马替尼治疗。停药后3个月,该患者因缓解深度降至MMR需要重新开始TKI治疗。重新开始伊马替尼治疗后,该患者又迅速达到CCyR,但治疗6个月后尚未达到MMR。
鉴于该患者在重启TKI治疗后最初BCR-ABL定量下降缓慢,因此决定改用更强效的TKI。该患者未检出KD突变的相关证据,更换为达沙替尼100mg/d治疗。该患者在3个月内达到了MMR和MR4.5,并且保持MR4.5状态超过2年。
病例3评论:TFR失败后治疗方案的选择
停止TKI治疗后如果出现分子生物学复发和未达MMR,我们建议每1~2个月监测BCR-ABL1定量,直到重新获得MMR。几乎所有病例中,TFR失败再次使用TKI的患者对TKI治疗仍然敏感,鲜有KD突变的报告。大多数患者可迅速恢复到MMR和DMR水平。在重新治疗后6~12个月内未能恢复MMR者应进行KD突变分析,并且可适当更换其他TKI进行治疗。
虽然大多数患者在TFR失败后重新开始TKI治疗可迅速恢复MMR和DMR状态,但仍有小部分患者对TKI重新反应延迟,本案例就说明了这一点。有两种解决方法:一种是在确保没有KD突变发生后继续使用当前的TKI;另一种是换用其他TKI药物,特别是对那些希望再次达到TFR的患者。
结语
目前CML有多种治疗方法,并且在大多数情况下能取得很好的治疗效果,因此可能被视为一种“易治疗”的疾病,但这种观点尚存风险。为了确保疗效进一步优化,定期进行高质量分子生物学监测可使疾病进展风险降到最低,进而使获得TRF的机会最大化。若早期检测到BCR-ABL1值升高或未能达到预定的缓解目标,则可能需要进行KD突变分析,同时如果患者治疗失败,则需更换为更有效的TKI治疗。持续保持DMR状态与TFR成功相关,并且通过合适的治疗选择使达到DMR可能性最大化已成为CML当前愈加重要的治疗目标。
HUGHES T P,SHANMUGANATHAN N.Molecular monitoring in CML: how deep? How often? How should it influence therapy?[]Blood,2018 ,132:2125-2133.
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯-娜小编,备注“血液肿瘤”!












 苏公网安备32059002004080号
苏公网安备32059002004080号


