节拍化疗是近年来兴起的一种新的治疗模式,通过相对低剂量、高频度、持续应用细胞毒药物,使药物能够长时间维持在相对较低、有效的血药浓度,以达到延长疾病控制时间,同时大大降低毒副作用的目的。相比于传统化疗,节拍化疗还表现出抗肿瘤血管生成和免疫调节等独特的作用机制。口服化疗药物因使用方便,是节拍化疗的优选方案,其中有代表性的药物包括长春瑞滨、卡培他滨等。
什么是节拍化疗?
化疗是晚期恶性肿瘤治疗的基石,然而传统化疗采用最大耐受剂量,毒性大,作用不持久,容易产生耐药,限制了临床应用。2000年Folkman及其同事通过动物移植瘤模型发现持续应用小剂量环磷酰胺能够使肿瘤血管床的内皮细胞持续凋亡。1同年,Kerbel也证实持续低剂量的长春花碱能够抑制肿瘤血管生成,使移植瘤缩小。2在这两项开创性研究的基础上,Hanahan提出了节拍化疗(metronomic chemotherapy)的概念。3
节拍化疗是近年来兴起的一种新的治疗模式,通过相对低剂量、频繁的应用细胞毒性药物,使药物能够长时间维持在相对较低、但仍有抗肿瘤活性的血药浓度,并减轻药物毒副作用。4
节拍化疗的作用机理
相比于传统化疗,节拍化疗有其独特的作用机理。一方面,节拍化疗通过缩短治疗间歇,降低肿瘤细胞在治疗间歇期的修复,实现直接抑制肿瘤细胞的作用。另一方面,节拍化疗还表现出抗肿瘤血管生成作用和免疫调节作用。5
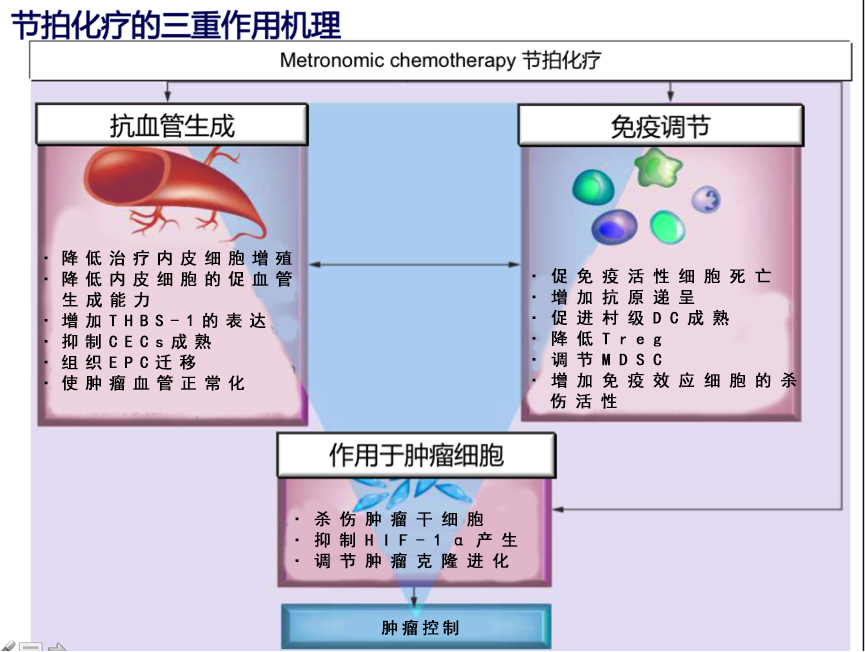
节拍化疗抗血管生成的理论来源于Folkman和Kerbel动物实验,新形成血管床内活化的内皮细胞对一些低剂量的化疗药物是高度敏感的。6在漫长的肿瘤血管生成的过程中,肿瘤血管内皮细胞也会出现增殖状态,但与肿瘤细胞相比,增殖的频率较低。传统化疗对低频率增殖、分化的血管内皮细胞只有微弱的破坏作用。而节拍化疗则可以通过直接和间接作用抑制肿瘤血管生成。
一方面,低剂量持续应用细胞毒性化疗药物可以直接抑制肿瘤新生血管系统中增殖的内皮细胞的生长或使之凋亡,持续阻止循环内皮祖细胞(circulating endothelial progenitors,CEPs)的分化。4另一方面,节拍化疗可以促进抗血管生成因子血小板反应蛋白-1(thrombospondin 1,TSP-1 )的表达。4TSP-1是细胞外基质成分之一,为内源性血管生成抑制因子,与表达在内皮细胞上的分化抗原36受体结合,抑制内皮细胞增殖,促进凋亡。此外,TSP-1还能持续阻止CEPs的分化。
长春瑞滨作为微管蛋白抑制剂,具有独特的抗血管生成作用。其可以通过作用于黏着斑、黏着连接,阻断VEGF受体及其它相关信号的传导通路,干扰细胞骨架的形成及细胞的去极化等多途径作用于内皮细胞起到抗血管生成作用。7长春瑞滨节拍化疗则可以通过多种途径抑制肿瘤血管生成:
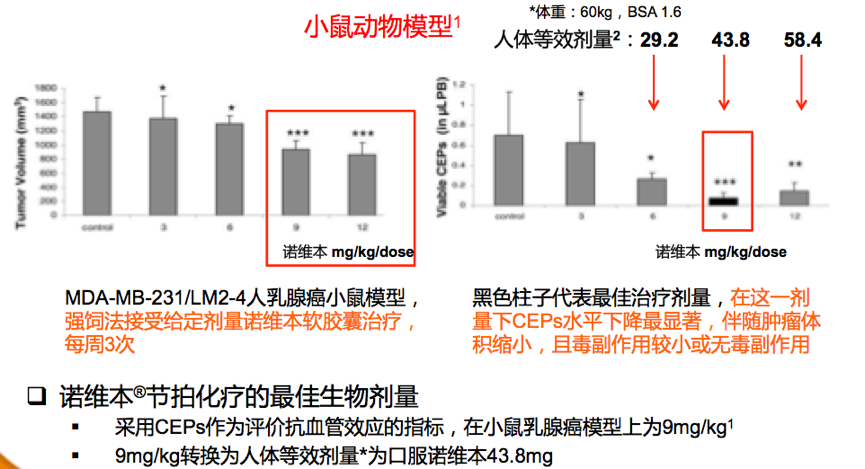
1. 长春瑞滨节拍化疗可以减少CEPs的数量和活性,从而抑制肿瘤血管生成。8同时,外周血管中活性CEPs水平的变化也可以作为一个生物标志物,以确定节拍化疗的最佳生物剂量。8,9
2. 长春瑞滨节拍化疗还可以显著下调促血管生成基因的表达,并上调抗血管生成基因的表达。10
3. 长春瑞滨增加血小板反应蛋白TSP-1(血管生成抑制剂)的血浆浓度。在长春瑞滨抑制人脐静脉内皮细胞增殖实验中显示,长春瑞滨节拍化疗相比于传统化疗,抗血管生成作用更佳。11
(二)节拍化疗对免疫功能的调节
逃逸机体的免疫监视是癌症的十大特征之一。12先天性和获得性免疫系统在控制瘤发生和发展的过程中均发挥重要的作用。近年来,免疫检查点抑制剂在多种晚期肿瘤中显示出很好的疗效。然而,免疫检查点抑制剂单药治疗的有效率偏低,免疫联合方案,有望改变肿瘤的免疫微环境,进一步提高免疫检查点抑制剂的疗效,获取长久获益。目前,研究的较为成熟的方案为免疫检查点抑制剂联合化疗。13
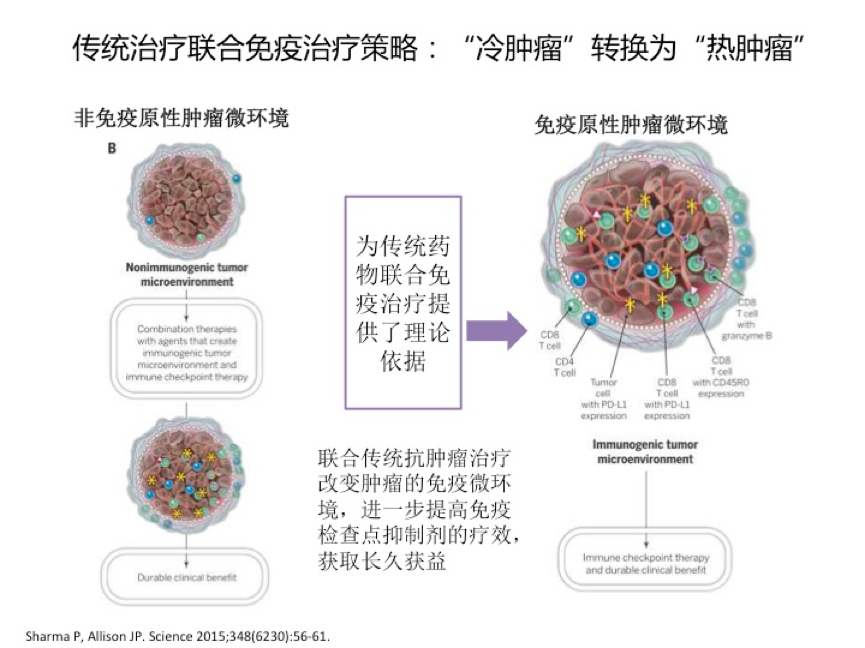
研究发现,节拍化疗能够使肿瘤患者体内的免疫平衡由免疫抑制状态向免疫活
化状态转换。14调节性T 细胞(Treg)表达细胞毒性淋巴细胞相关抗原-4(CTLA-4),能够抑制细胞特异性免疫应答。 Treg也能抑制由CD8+淋巴细胞、CD4+ T辅助细胞和自然杀伤细胞介导的抗肿瘤免疫应答。15,16Treg的增加与肿瘤进展及对抗肿瘤治疗缺少应答有关。因此清除肿瘤患者的 Treg,尤其是肿瘤微环境中的Treg,被认为是成功的抗肿瘤治疗的重要组成部分之一。16一些研究发现在动物移植瘤模型中,节拍化疗能够通过减少Treg细胞数量和抑制Treg功能,增加抗肿瘤免疫反应。17,18
VICTOR-5研究是探索口服长春瑞滨节拍化疗联合或不联合卡培他滨用于晚期乳腺癌的研究。对服用长春瑞滨节拍化疗治疗的患者进行连续的外周血细胞检测,结果显示,至用药56天后,患者的Treg细胞数量持续下降,伴随细胞毒性T细胞数目的增多。这一探索性分析显示,口服长春瑞滨节拍化疗可以增强患者的抗肿瘤免疫反应。19
节拍化疗对比传统化疗的优势
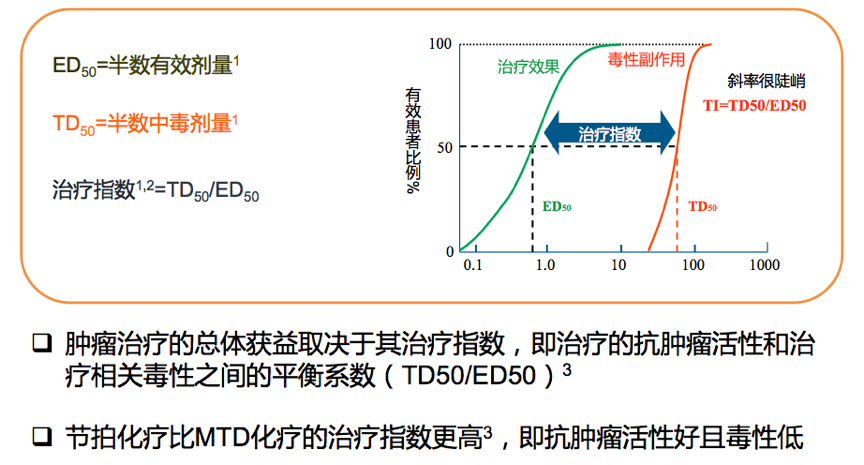
与传统化疗针对快速增殖的肿瘤细胞不同,节拍化疗主要作用于血管内皮细胞和肿瘤基质细胞。节拍化疗对比传统化疗的优势主要表现为以下3个方面: 1、节拍化疗可以有效延长治疗周期,同时降低治疗毒副作用;2、接受节拍化疗的患者,不需要或很少需要使用生长因子来加速恢复患者的骨髓抑制;3、节拍化疗治疗指数较高。20
节拍化疗的适应人群和代表药物
目前节拍化疗的主要适用人群如下4,5:
1.生长缓慢的肿瘤,需要考虑长期生存和生活质量的患者;处于快速增殖期的肿瘤并不适合。
2. 先前已经接受大量治疗的患者和老年及PS评分较差的患者。
3. 此外,节拍化疗可以与标准传统化疗进行整合,称之为“转换性维持治疗switch maintenance”。
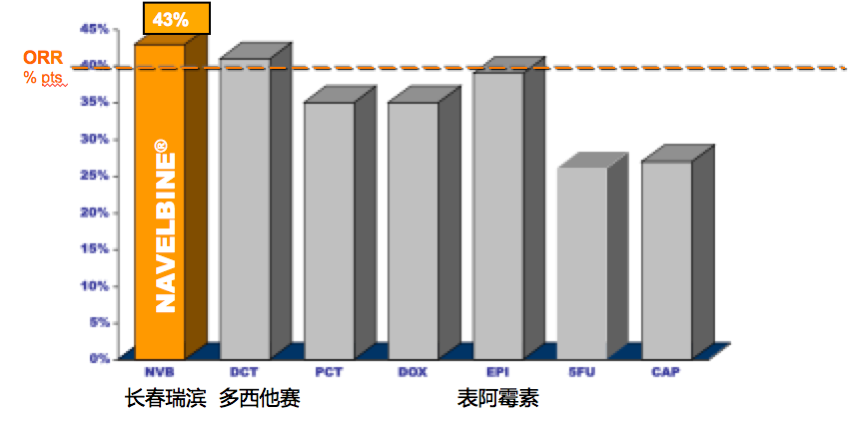
口服化疗药物由于其方便服用,更适合作节拍化疗。其中,代表性的药物有长春瑞滨、甲氨蝶呤、环磷酰胺、S-1、卡培他滨。已有的研究表明,单药治疗晚期乳腺癌有效率超过40%的三个主流化疗药有长春瑞滨、多西他赛、蒽环类药物,其中长春瑞滨的客观反应率最高,达到43%。21
此外,长春瑞滨也是治疗非小细胞肺癌的标准化疗药物之一。值得一提的是,长春瑞滨节拍化疗用于晚期NSCLC一线治疗的HORG研究。22这是一项临床II期研究,评估口服长春瑞滨节拍化疗联合顺铂用于晚期非小细胞肺癌患者的临床疗效。结果显示长春瑞滨节拍化疗显示出较好的疗效,且安全耐受。
1. Browder T, Butterfield CE, Kraling BM, et al: Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res 60:1878-86, 2000
2. Klement G, Baruchel S, Rak J, et al: Continuous low-dose therapy with vinblastine and VEGF receptor-2 antibody induces sustained tumor regression without overt toxicity. J Clin Invest 105:R15-24, 2000
3. Hanahan D, Bergers G, Bergsland E: Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J Clin Invest 105:1045-7, 2000
4. Kerbel RS, Kamen BA: The anti-angiogenic basis of metronomic chemotherapy. Nat Rev Cancer 4:423-36, 2004
5. Cazzaniga ME, Camerini A, Addeo R, et al: Metronomic oral vinorelbine in advanced breast cancer and non-small-cell lung cancer: current status and future development. Future Oncol 12:373-87, 2016
6. Bocci G, Nicolaou KC, Kerbel RS: Protracted low-dose effects on human endothelial cell proliferation and survival in vitro reveal a selective antiangiogenic window for various chemotherapeutic drugs. Cancer Res 62:6938-43, 2002
7. Schwartz EL: Antivascular actions of microtubule-binding drugs. Clin Cancer Res 15:2594-601, 2009
8. Shaked Y, Emmenegger U, Man S, et al: Optimal biologic dose of metronomic chemotherapy regimens is associated with maximum antiangiogenic activity. Blood 106:3058-61, 2005
9. Reagan-Shaw S, Nihal M, Ahmad N: Dose translation from animal to human studies revisited. Faseb j 22:659-61, 2008
10. Biziota E, Briasoulis E, Mavroeidis L, et al: Cellular and molecular effects of metronomic vinorelbine and 4-O-deacetylvinorelbine on human umbilical vein endothelial cells. Anticancer Drugs 27:216-24, 2016
11. Bocci G, Francia G, Man S, et al: Thrombospondin 1, a mediator of the antiangiogenic effects of low-dose metronomic chemotherapy. Proc Natl Acad Sci U S A 100:12917-22, 2003
12. Chen DS, Mellman I: Oncology meets immunology: the cancer-immunity cycle. Immunity 39:1-10, 2013
13. Sharma P, Allison JP: The future of immune checkpoint therapy. Science 348:56-61, 2015
14. Andre N, Carre M, Pasquier E: Metronomics: towards personalized chemotherapy? Nat Rev Clin Oncol 11:413-31, 2014
15. Kosmaczewska A, Ciszak L, Potoczek S, et al: The significance of Treg cells in defective tumor immunity. Arch Immunol Ther Exp (Warsz) 56:181-91, 2008
16. Hao YB, Yi SY, Ruan J, et al: New insights into metronomic chemotherapy-induced immunoregulation. Cancer Lett 354:220-6, 2014
17. Ghiringhelli F, Menard C, Puig PE, et al: Metronomic cyclophosphamide regimen selectively depletes CD4+CD25+ regulatory T cells and restores T and NK effector functions in end stage cancer patients. Cancer Immunol Immunother 56:641-8, 2007
18. Banissi C, Ghiringhelli F, Chen L, et al: Treg depletion with a low-dose metronomic temozolomide regimen in a rat glioma model. Cancer Immunol Immunother 58:1627-34, 2009
19. Cazzaniga ME BS, Riva F, Vigorè L, Malandrin S, Cicchiello F, Pelizzoni D, Lissoni P, Manfrida I, Brando B and Bidoli P, VICTOR Study Group: SABCS, 2016
20. KD S: Metronomic Chemotherapy: Pharmacology and Clinical Applications. Berlin: Springer-Verlag; 2014:263-279.
21. Hortobagyi: ASCO 2003 Educational Session.
22. Katsaounis P, Kotsakis A, Agelaki S, et al: Cisplatin in combination with metronomic vinorelbine as front-line treatment in advanced non-small cell lung cancer: a multicenter phase II study of the Hellenic Oncology Research Group (HORG). Cancer Chemother Pharmacol 75:821-7, 2015











 苏公网安备32059002004080号
苏公网安备32059002004080号


