10余年来,靶向和免疫治疗引领了晚期NSCLC的治疗变革,使得晚期NSCLC长期生存成为可能。然而,纵观目前晚期NSCLC的治疗,仍然存在有待进一步优化的地方。在本届ASCO年会上,报道了众多相关研究,采用FundationOne® CGP(Comprehensive Genomic Profiling,)分析难治性晚期NSCLC 的分子突变特征,探寻潜在的治疗靶点、靶向治疗原发或继发性耐药机制,综合评估免疫检查点抑制剂的疗效预测标志物等。以下针对精华内容进行汇总。
由FMI开发的FundationOne®全面基因组测序(CGP)分析服务目前已经进入中国市场。FundationOne®针对所有实体肿瘤(除肉瘤以外)使用组织样本,应用“基于靶向富集杂交捕获”的NGS技术,在一次检测中平行提供了315个基因的4种基因变异及TMB和MSI两种基因标签的全面分子信息,更加精准地指导个体化靶向及免疫治疗方案。FoundationOne®的检测结果是经过严谨分析验证的,同平台下的FoundationOne CDxTM是FDA和CMS批准的首个经过临床验证的NGS伴随诊断(CDx)。
Abs 12001前瞻性评估b-TMB作为Atezolizumab一线治疗NSCLC的疗效预测标志物:来自B-F1RST研究的中期分析
背景
约30%的NSCLC在诊断时没有足够的组织标本进行分子检测,基于血浆的肿瘤突变负荷(bTMB)检测是一个有前景的无创的生物标志物检测,可以帮助筛选有可能从PD-1/PD-L1抑制剂中获益的患者。
来自II期研究POPLAR研究患者(训练集)的分析发现,bTMB≥16个突变/Mb的患者,接受Atezolizumab治疗PFS显著获益,这一结果在III期OAK研究(验证集)中得到验证。当采用bTMB≥16/Mb作为cut-off值进行分组时,bTMB与tTMB显著相关(rs=0.93),且两者具有较高的阳性一致率和阴性一致率。
方法
B-F1RST是第一个前瞻性评估b-TMB作为Atezolizumab一线治疗NSCLC的疗效预测标志物的II期研究。入组了IIIB-IV期EGFR/ALK野生型NSCLC(N=153),接受Atezolizumab治疗。计划50%的患者完成入组6个月后进行第一次预设的中期分析,预设的bTMB的cut-off值为16。主要共同研究终点为:1. 接受Atezolizumab治疗的临床获益;2. bTMB和患者PFS获益的关系。
结果
1. 中期分析人群(IAP)定义为入组人群中最早接受Atezolizumab治疗的78例患者。生物标志物可评估人群(BEP)包括基线有可评估血液标本,且肿瘤细胞含量足够进行FMI的bTMB检测。根据既定bTMB cut-off值16分组评价疗效(bTMB高≥16,bTMB低<16)。
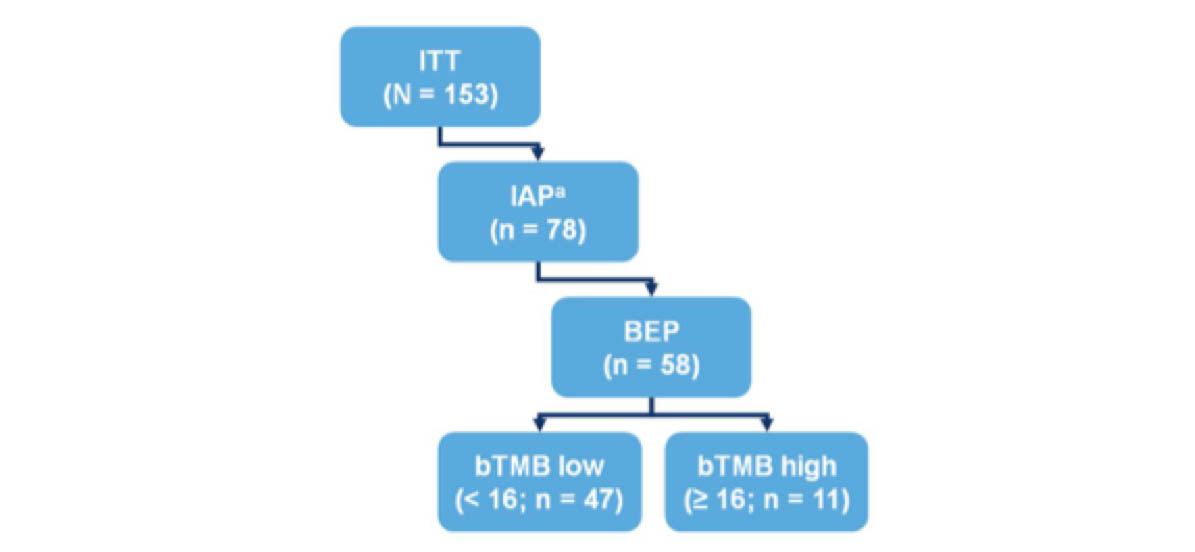
图1. 入组患者流程图
2. 接受Atezolizumab治疗的ORR评估(RECIST v1.1)见下表2。IAP和BEP患者的ORR分别为15.4%和12.1%, bTMB低和bTMB高组患者的ORR(6.4% vs 36.4%)和靶病灶肿瘤负荷的变化存在显著差异(图2),bTMB高组靶病灶缩小的比例和肿瘤负荷减低的幅度更显著。
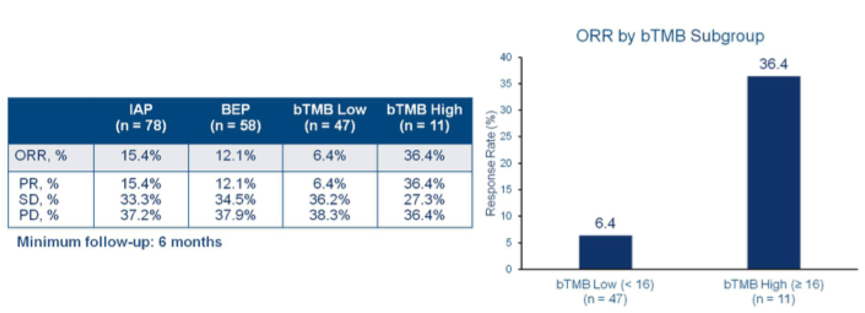
表2. 接受Atezolizumab治疗的ORR
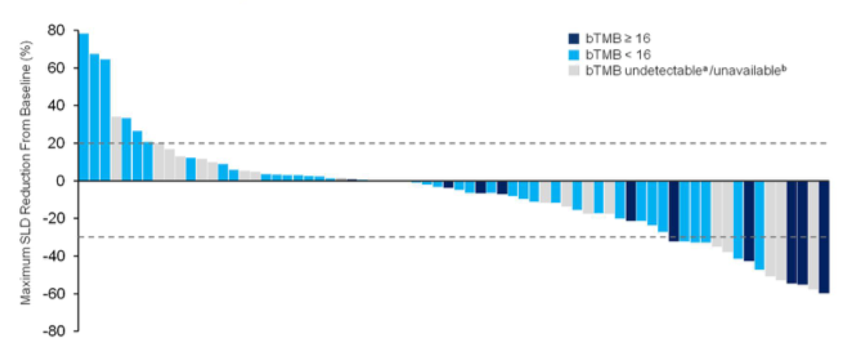
图2. bTMB低和bTMB高组患者肿瘤负荷变化
3. bTMB与接受Atezolizumab治疗的PFS的关系:两组患者的mPFS在绝对数值上差异明显,9.5 vs 2.8个月,HR 0.51,P=0.1215(图3)。探索不同的bTMB cut-off值,发现bTMB≥16是最佳的cut-off值,见下图4.
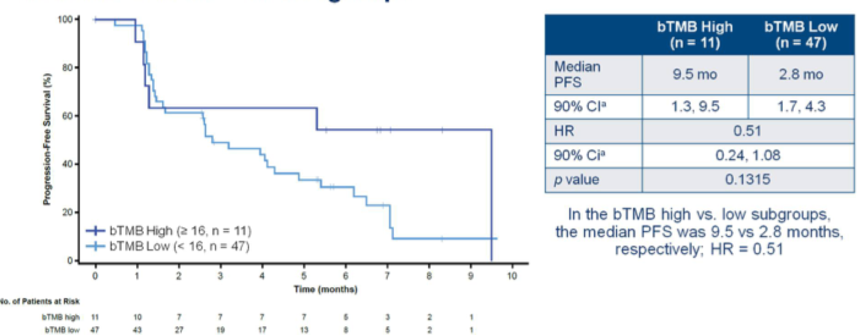
图3. bTMB高和bTMB低组患者的PFS对比
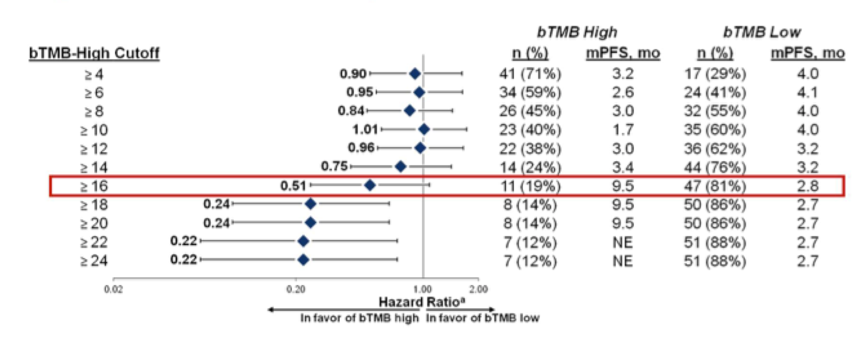
图4. 不同bTMB cut-off值的亚组与PFS的关系
B-F1RST是第一项评估基于外周血检测的bTMB用于NSCLC中Atezolizumab一线治疗疗效预测的前瞻性临床研究。中期分析显示,以bTMB≥16为cutoff值,可以预测患者接受Atezolizumab单药一线治疗的PFS,此外两组患者的ORR也存在差异。这一结果支持正在进行的III期研究BFAST以bTMB为标志物来筛选入组人群。
Abs 3028 STK11 LKB1体细胞突变介导晚期NSCLC患者免疫治疗的耐药
NSCLC患者的基因突变谱对PD-1/PD-L1抑制剂的影响尚未明确,探寻PD-1/PD-L1抑制剂的耐药机制有利于优化治疗决策。本研究在晚期非鳞NSCLC患者中,探索与Durva单药或Durva+Tremi联合治疗原发耐药相关的分子变异。
方法
分别从3个临床试验中纳入接受Durva单药或Durva +Tremi联合治疗的晚期非鳞NSCLC患者。采用覆盖70个癌症基因的Guardant360 panel检测ctDNA; Stu采用FoundationOne CDxTM进行肿瘤组织测序。

图1. 研究入组流程图
入组患者均为EGFR/ALK野生型,探索STK11突变和免疫治疗ORR、OS的关系。研究发现,STK11(LKB1)突变与Durva单药或Durva +Tremi联合治疗无效有关。基于这一结果,进一步探索了TCGA数据库中STK11突变与非鳞NSCLC患者预后的关系,并采用RNA测序分析了TCGA数据库和Study006研究中STK11突变型非鳞NSCLC患者的免疫相关特征。
结果
1. STK11体细胞突变与Durva单药或Durva +Tremi联合治疗的低ORR相关(图2)。在非鳞NSCLC患者中,STK11突变患者, Durva单药或联合治疗的OS显著更短(图3)。无论KRAS突变状态,STK11突变的非鳞NSCLC患者接受Durva单药或联合治疗的疗效更差(图4)。
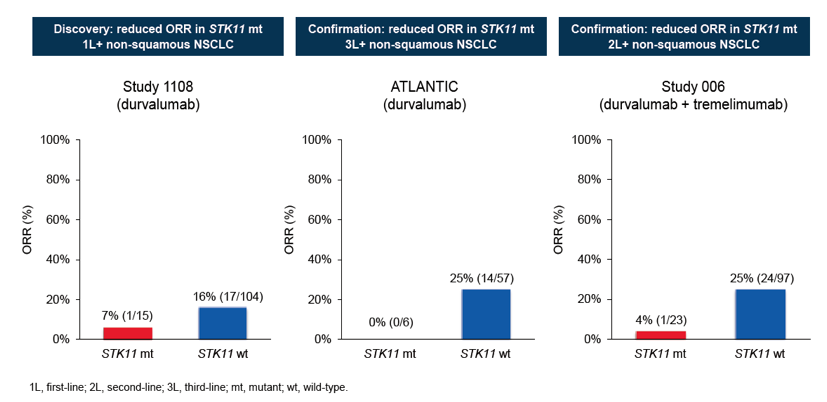
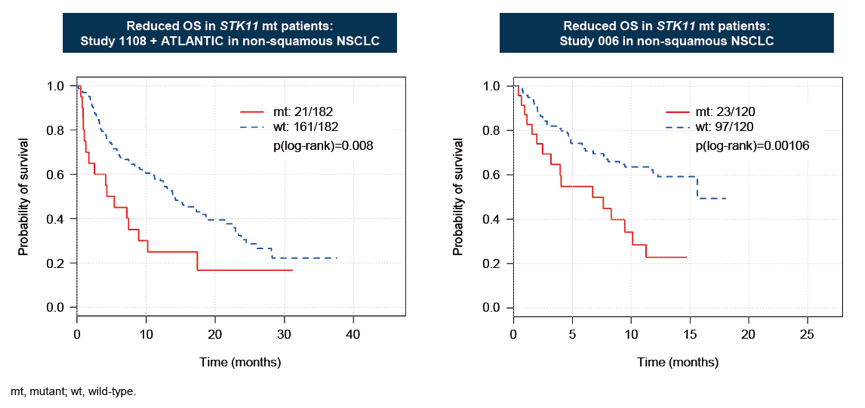
图2. STK11体细胞突变与Durva单药或联合治疗的低ORR以及更短OS相关
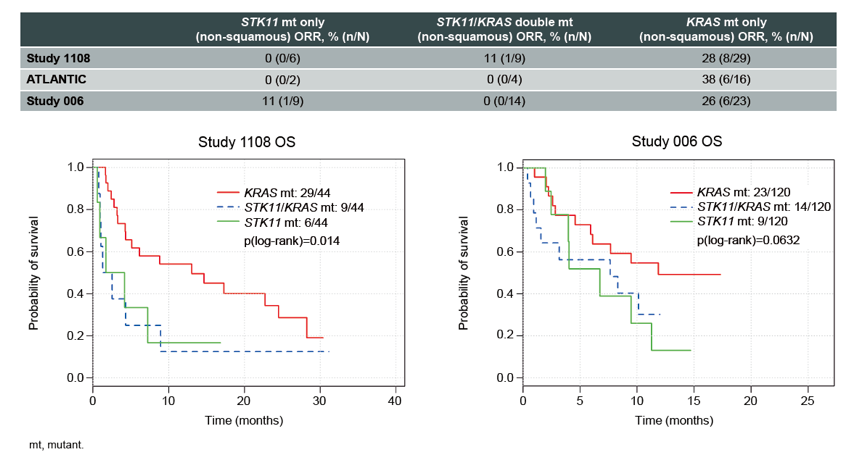
图3. 无论KRAS突变状态,STK11突变的非鳞NSCLC接受Durva单药或联合治疗的疗效更差
2. 在TCGA数据库中,STK11突变不能预测NSCLC患者的OS,但与免疫抑制性肿瘤微环境相关。
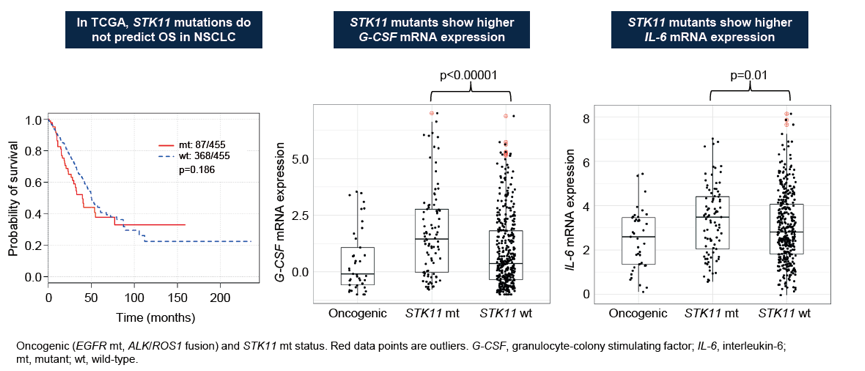
图4. TCGA数据库中,STK11突变并不能预测NSCLC患者的OS,但与免疫抑制性肿瘤微环境相关
3. STK11突变型肿瘤的免疫相关特征分析:STK11突变与IFNγ评分低(图5)相关。
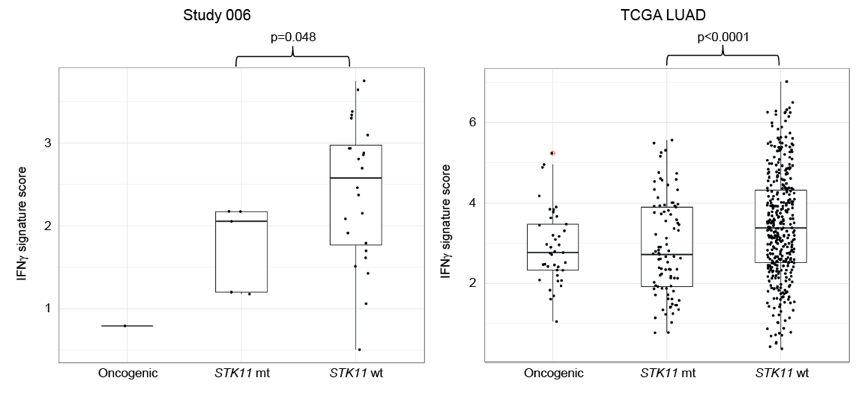
图5. STK11突变型肿瘤与IFNγ低评分相关
小结
在非鳞NSCLC患者中,STK11体细胞突变可能介导免疫检查点抑制剂的原发耐药,与患者的KRAS突变状态无关。STK11突变与抑制性的免疫微环境和中等TMB有关,这些发现有助于指导免疫治疗。后续需要在HUDSON雨伞试验的更大样本量患者中,探索这类人群的最佳联合治疗方案。
Abs 9076 在NSCLC患者中,分析罕见驱动基因变异与PD-L1表达,TMB,MSI状态以及接受免疫检查点抑制剂治疗疗效的关系
背景
关于免疫检查点抑制剂用于携带罕见驱动基因突变的NSCLC患者的疗效尚未明确。
方法
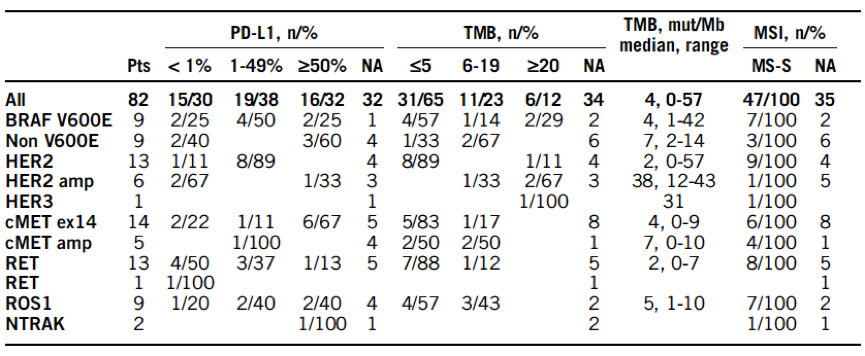
从Davidoff癌症中心数据库中连续纳入了82例携带罕见驱动基因突变(非EGFR/ALK变异)的NSCLC患者,分析这些突变与TMB,MSI(采用FoundationOne进行检测)和PD-L1表达的关系,评估患者接受免疫检查的抑制剂治疗的ORR,PFS 和OS。
结果
77例晚期患者中,44例接受免疫检查点抑制剂治疗,ORR为16%,mPFS 为3.2个月(95% CI, 2.6-5)。在开始免疫治疗后中位随访7.8个月,19例(19/44,43%)患者死亡,mOS为16.2个月(95%CI:8.4-NR)。接受免疫治疗的OS与PD-L1表达(P=0.6),TMB(P=0.9)或罕见驱动基因突变类型(P=0.9)无关。共40例(52%,40/77) 死亡,对比有/无接受免疫治疗患者的OS,mOS分别为32 vs 13个月,P=0.01。多因素分析发现自诊断为晚期疾病后的OS与接受免疫治疗(P=0.04),靶向治疗(P=0.01)和ECOG PS评分(P=0.01)显著相关。
表1:携带罕见驱动基因突变患者的TMB,MSI状态和PD-L1表达水平分析
小结
携带罕见驱动突变的NSCLC患者,TMB多为低/中等,MSI稳定,PD-L1表达水平不一。患者接受免疫治疗的疗效与非选择性患者相当,很难预测哪些患者对免疫治疗有效。接受免疫治疗是影响患者OS的独立因素。值得一提的是,在另一篇poster中(Abs 9010),研究了免疫检查点抑制剂在在一些携带敏感突变包括BRAF、KRAS、ROS1、MET、EGFR、HER2,RET和ALK变异的患者中疗效的相关性,其ORR结果如下:
表2
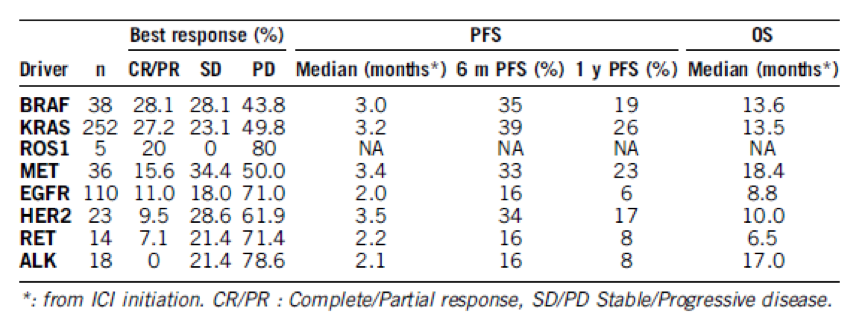
这表明,免疫检查点抑制剂在携带敏感基因突变中的疗效包括一些罕见驱动基因突变的NSCLC患者的疗效情况复杂,仍需进一步研究。
Abs 9040 采用CGP检测探索携带EGFR突变(非19del/L858R)的1233例NSCLC患者的分子特征
背景
EGFR exon19del或L858R突变是经典的EGFR活化突变类型,预示着患者对TKI治疗敏感。近期,FDA扩大了阿法替尼的适应证,可用于除exon19del或L858R以外的罕见EGFR突变(S768I,L861Q和G719X)。
方法
收集2012-8至2018-1期间常规送检的30,888例肿瘤组织标本和3,440例外周血标本。组织学标本采用FoundationOne检测;外周血检测首先从20ml全血中分离血浆,提取50-100ng的ctDNA构建测序文库,采用基于杂交捕获的Foundation ACT 检测,覆盖62个基因,中位测序深度为6874X,功能未知的基因变异不纳入本次分析。
结果
1. 不同EGFR突变类型患者的临床和基因特征共5240例EGFR突变患者,其中Del19/L858R的患者占77%,EGFR少见突变包括:不同突变类型患者,年龄、性别和组织学无显著差异。
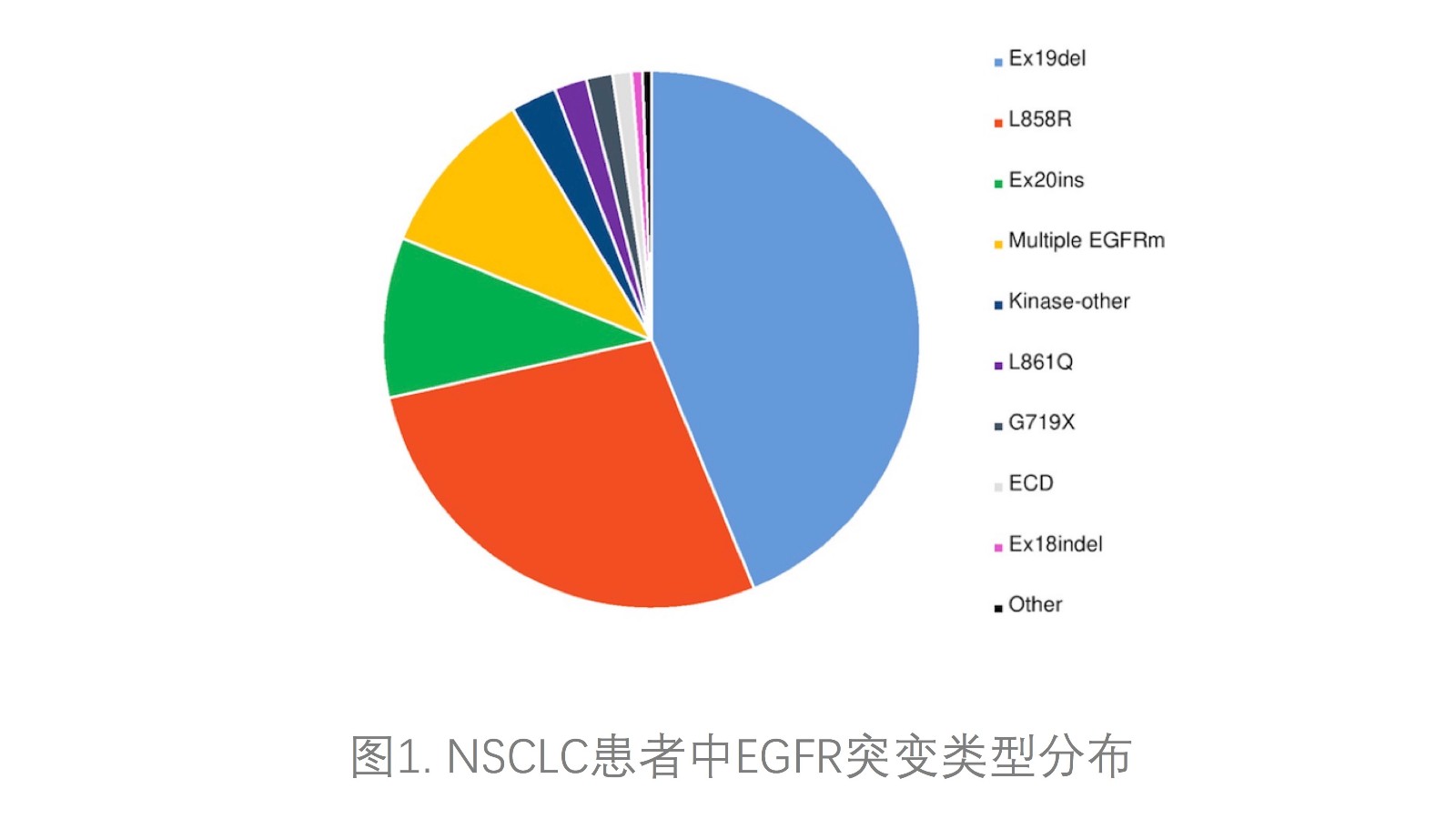
2.共变异基因分布:相比于del19/L858R (7%)的患者,下列EGFR突变类型患者携带≥1个原发EGFR突变的患者比例更高,分别为E709X(100%),S768I (94%),TMD (75%),G719X (70%),其他KD突变 (63%),ECD突变(57%)和L861Q (31%)。T790M共突变发生率在del19/L858R患者中为21%,在非del19/L858R患者中仅为4%;KRAS共突变发生率在del19/L858R患者中为1%,在非del19/L858R患者中为0-3%,在其他KD突变患者中为8%。EGFR扩增在E709X,ECD,其他KD,G719X或 S768I突变患者中为10-17%,在其余EGFR突变亚组中为20-25%。
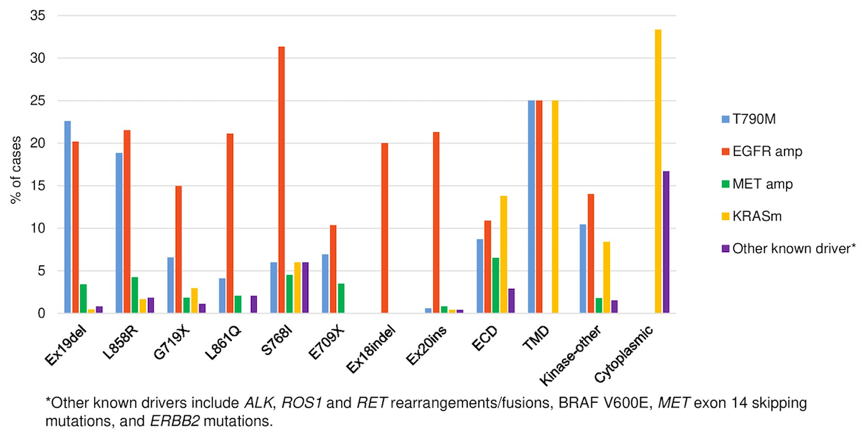
图2. 不同EGFR突变类型患者中共变异基因分布
3. 患者的TMB分布:在del19/L858R或其他插入/缺失突变患者中,TMB最低(mTMB为2.6 mut/Mb);在G719X或ECD突变的患者中,TMB最高(mTMB为5.2 mut/Mb)。
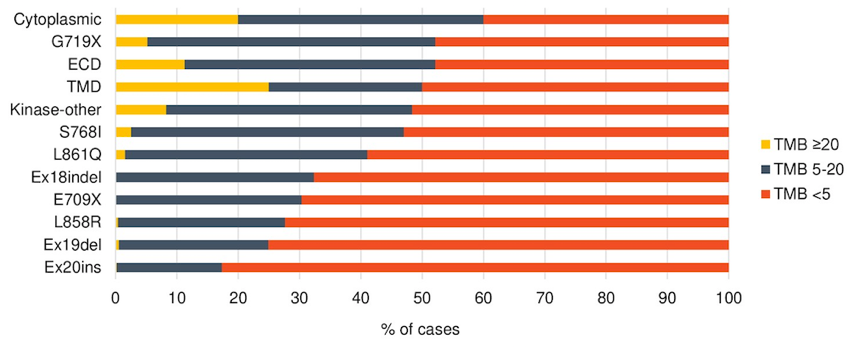
图3. 不同EGFR突变类型患者的TMB分析
4. 研究还报道了6例EGFR少见突变患者接受不同EGFR TKI治疗疗效,见表1.
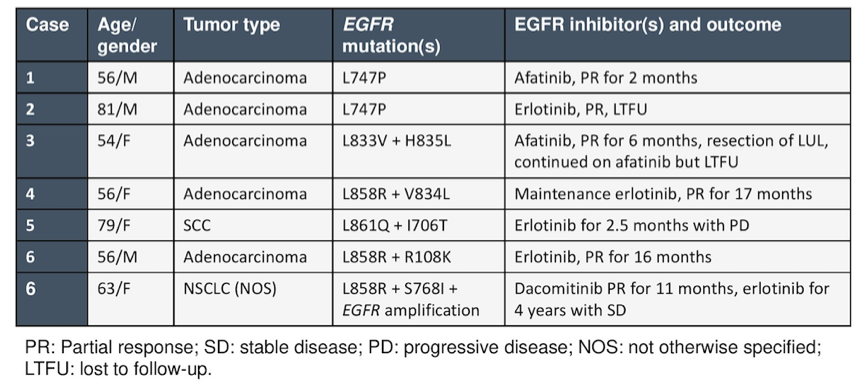
表1. EGFR少见突变患者接受不同EGFR TKI治疗的疗效
小结
在NSCLC患者中,非经典(del19/L858R)EGFR突变占23%。其中exon20插入突变和G719X突变最常见,分别占9.8%和5.2%。在所有EGFR突变的NSCLC标本中,其他EGFR激酶区突变的发生率为7.5%,这些突变通常(>50%)与其他已知的EGFR驱动突变共存,可能导致部分患者对EGFR TKI原发或继发耐药。在携带非经典EGFR突变的患者中,KRAS突变、其他已知的驱动突变(如ALK,ROS重排)和高TMB的发生率较低,提示这些非经典EGFR突变可能是这部分患者的驱动基因。此外,非经典EGFR突变患者通常携带1个以上的EGFR突变,使得这类患者的治疗选择更具挑战。
Abs 12006应用真实世界的终点指标来探索和发现预后不良的晚期NSCLC患者的基因突变谱
众所周知,一些肺癌患者对目前的治疗方案无效,预后较差。这类患者是否有特殊的基因突变谱?通过对真实世界的患者数据库进行分析,可筛选出治疗后快速进展的患者,并探索患者的基因突变特征。
方法
研究分析了2011-1-1至2016-12-31期间FMI-Flatiron临床基因数据库中,至少经历2次随访,临床结局信息完整的患者。采用真实世界至治疗失败时间(rwTTF)发现快速进展的患者。其中rwTTF≤60天的患者定义为快速进展患者。研究的主要终点为探寻快速进展患者的基因特征;探索性终点为快速进展组Vs非快速进展组的基因变异。
结果
1. 共筛选出2139例患者。在开始治疗60天内记录为rwP,换用另一种治疗或死亡的患者分别为138例(36%),30例(14%)和103例(24%)。接受免疫治疗的患者中,快速进展组和非快速进展组分别有90例和148例患者接受了FMI基因panel检测;TKI治疗组中,分别有11例和86例进行了检测。
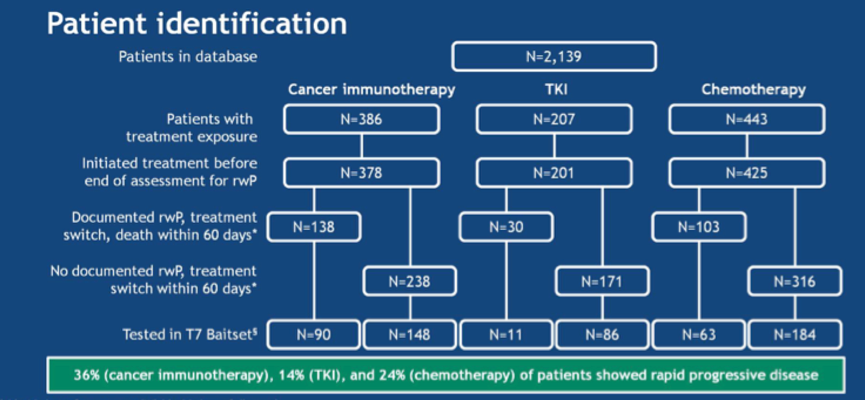
图1. 患者的流程图
2. 各种治疗模式的治疗线数分析
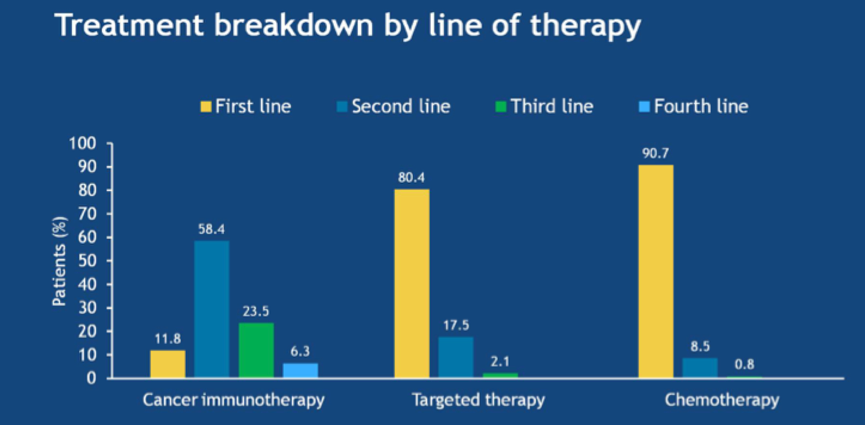
图2. 各种治疗模式的治疗线数分析
3. 对比各治疗模式中快速进展组和非快速进展组的OS,均存在显著差异。免疫治疗组中,两组的mOS分别为12.3 vs 3.7个月(P<0.0001);化疗患者中,两组的mOS分别为14.9 vs 3.5个月(P<0.0001);TKI治疗组中,两组的mOS分别为36.6 vs 6.2个月(P=0.00084)。
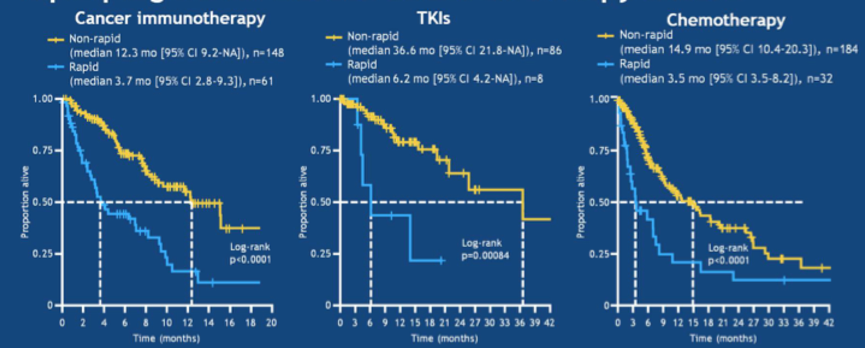
图3. 各种治疗模式中,快速进展组和非快速进展组患者的OS对比
4. 免疫治疗患者中,快速进展组和非快速进展组的TMB存在显著差异(P=0.006),靶向治疗和化疗的患者,两组患者的TMB均无显著差异。
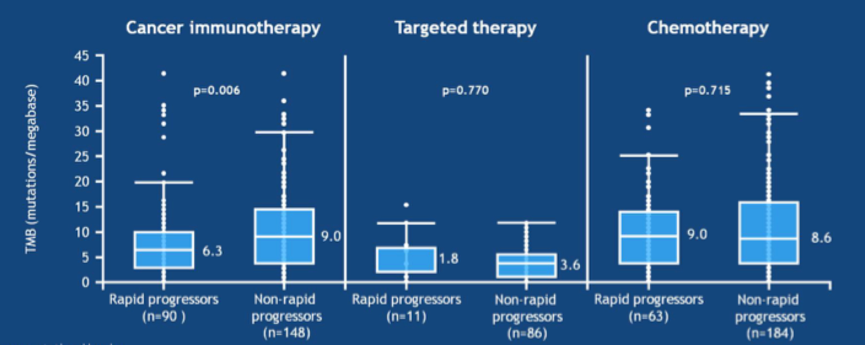
图4. 各种治疗模式中,快速进展组和非快速进展组患者的TMB对比
5. 对比各治疗模式中快速进展组和非快速进展组患者的基因特征:在预后很差的患者中也可以观察到可靶向基因变异,一些基因变异与快速进展存在弱相关,但无统计学意义。研究者认为,可通过多基因分析来克服上述分析方法的缺陷,分析患者的临床特征和基因突变谱,构建一个基因风险评分指数,以预测患者的治疗疗效。
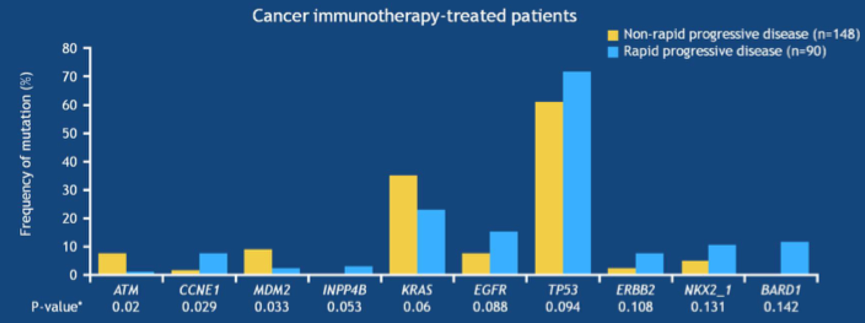
图5. 在接受免疫治疗的患者中,快速进展组和非快速进展组患者的一些常见基因的突变率比较
小结
本研究使用新的真实世界终点指标rwTTF来探寻和发现快速进展患者的基因突变特征。免疫治疗快速进展的患者,TMB较低。目前未发现单一基因变异与快速进展相关,计划通过多基因分析以发现临床有意义的早期进展预测指标。
总结
靶向和免疫,已经成为晚期NSCLC治疗的研究的焦点。上述研究中,前3项研究采用FMI开发的CGP检测,探索免疫治疗的疗效预测标志物,后2项研究正对真实事件的病例,探寻罕见驱动基因突变患者的基因突变谱以及难治性患者的潜在治疗靶点,为靶向和免疫治疗的进一步优化提供了重要思路。
专家点评

中山大学肿瘤防治中心内科副主任医师
现任广东省抗癌协会化疗委员会青委会主任委员
广东省抗癌协会癌症康复与姑息治疗委员会青年委员会委员
广东省胸部疾病学会委员
参与 I~III 期抗肿瘤药物临床研究二十余项。对临床研究的程序、原则、组织和实施有丰富的实际操作经验。近三年以第一作者(含共同第一)发表SCI论文15篇,其中在The Lancet(IF 44.00)、Journal of the National Cancer Institute(IF 11.37)上各发表论文1篇,主持国家自然科学基金青年科学基金项目1项。编写肿瘤专业的专著 3 本。
在晚期NSCLC治疗中,靶向和免疫已经成为最重要的治疗手段之一,如何优化靶向和免疫治疗的疗效是当下的重要研究课题,通过NGS检测患者的基因突变特征,为研究提供了重要思路和手段。
TMB是目前免疫治疗公认的疗效预测标志物之一,在去年的ESMO大会上,研究者报道了POPLAR和OAK研究的探索性分析,显示采用FMI CGP平台检测患者血浆肿瘤突变负荷(b-TMB)与Atezolizumab疗效显著相关。在本次ASCO大会上,进一步在B-F1RST研究中前瞻性验证了b-TMB作为Atezolizumab一线治疗NSCLC的疗效预测标志物的意义,研究的初步结果显示出b-TMB预测免疫治疗疗效的潜力,但仍需后续更大样本量患者的进一步验证。b-TMB是一个相对无创的检测,同时还可以动态监测,这是一个非常具有前景的研究方向。Abs 3028研究探寻了可能介导免疫治疗原发耐药的机制,9076研究则关注携带罕见基因变异患者的免疫疗效预测谱。上述3项研究为优化免疫治疗提供了重要数据。9040研究和12006研究关注真实世界中的难治性肺癌患者,探寻潜在的治疗靶点,以期优化治疗,改善患者生存。综上,CGP检测为晚期NSCLC的精准管理提供了重要手段,使得晚期NSCLC的长期生存成为可能。















 苏公网安备32059002004080号
苏公网安备32059002004080号


