 Roberta Zaooasidi, et al., Emerging concepts for immune checkpoint blockade based combination therapies;
Roberta Zaooasidi, et al., Emerging concepts for immune checkpoint blockade based combination therapies;
cancer cell 33,Aril 9,2018.
Hellmann et al., Tumor Mutational Burden and Efficacy of Nivolumab Monotherapy and in Combination with Ipilimumab in Small-Cell Lung Cancer, Cancer Cell (2018),
Tumor Mutational Burden and Efficacy of Nivolumab Monotherapy and in Combination with Ipilimumab in Small-Cell Lung Cancer
 免疫检查点抑制剂已在小细胞肺癌(SCLC)中证实了持久的反应和令人鼓舞的生存延长,但尚缺乏有效的生物标志物。 来自MSKCC 的Hellmann及其团队使用WES测序来评估肿瘤突变负荷对nivolumab单药疗效或与ipilimumab联合用于来自CheckMate 032队列的SCLC患者的疗效影响。患者接受nivolumab(每2周3 mg / kg)或nivolumab 加ipilimumab(1 mg / kg加3 mg / kg,每3周4个疗程,接着每2周nivolumab 3 mg / kg)。 nivolumab±ipilimumab 增强高肿瘤突变负荷患者的疗效。 在高肿瘤突变负荷(TMB>247/mb)中,Nivolumabplus ipilimumab似乎比nivolumab单药治疗提供更大的临床获益。
免疫检查点抑制剂已在小细胞肺癌(SCLC)中证实了持久的反应和令人鼓舞的生存延长,但尚缺乏有效的生物标志物。 来自MSKCC 的Hellmann及其团队使用WES测序来评估肿瘤突变负荷对nivolumab单药疗效或与ipilimumab联合用于来自CheckMate 032队列的SCLC患者的疗效影响。患者接受nivolumab(每2周3 mg / kg)或nivolumab 加ipilimumab(1 mg / kg加3 mg / kg,每3周4个疗程,接着每2周nivolumab 3 mg / kg)。 nivolumab±ipilimumab 增强高肿瘤突变负荷患者的疗效。 在高肿瘤突变负荷(TMB>247/mb)中,Nivolumabplus ipilimumab似乎比nivolumab单药治疗提供更大的临床获益。
Tertile boundaries were defined as: low, 0 to <143 mutations; medium, 143 to 247 mutations; and high,>248mutations.
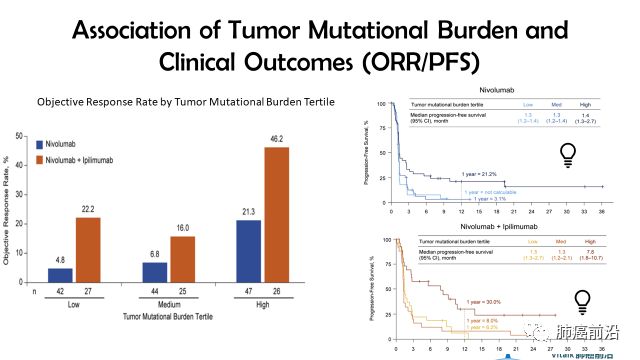
相较于Nivo单药,Nivo与Ipi联合能够提高肿瘤反应率,这种提升在高肿瘤突变负荷组则更明显
Association of Tumor Mutational Burden and Clinical Outcomes (OS)
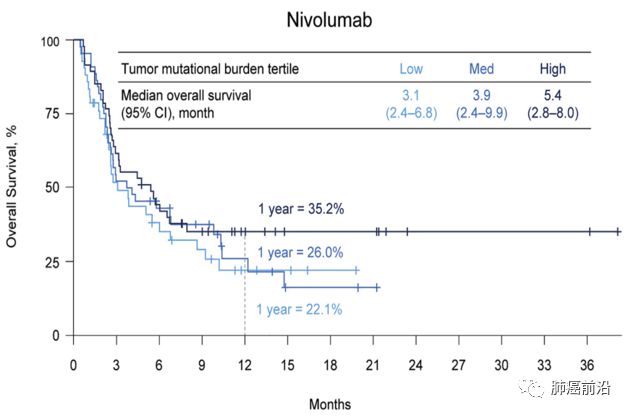
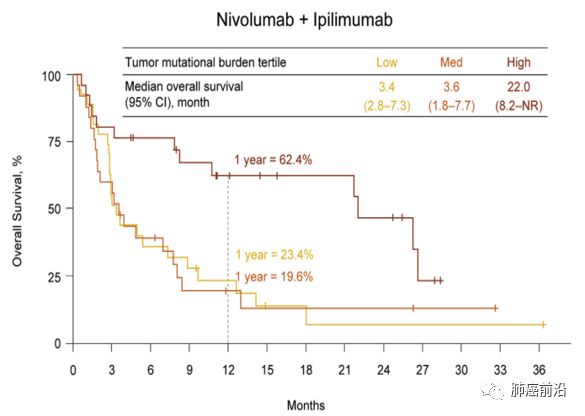 在每个治疗组中,高肿瘤突变负荷组的估计1年总生存率较高(分别为nivolumab单药治疗组和nivolumab + ipilimumab组为35.2%和62.4%,而在低突变负荷组则仅分别为22.1%和23.4% )或中等突变负荷组(分别为26.0%和19.6%)。 在高肿瘤突变负荷的患者中,联合治疗中位OS高于nivolumab单药治疗(mOS 22.0m vs 5.4m)
在每个治疗组中,高肿瘤突变负荷组的估计1年总生存率较高(分别为nivolumab单药治疗组和nivolumab + ipilimumab组为35.2%和62.4%,而在低突变负荷组则仅分别为22.1%和23.4% )或中等突变负荷组(分别为26.0%和19.6%)。 在高肿瘤突变负荷的患者中,联合治疗中位OS高于nivolumab单药治疗(mOS 22.0m vs 5.4m)
 1.肿瘤非同义/移码体细胞突变的数量,可能是通过产生“新抗原” - 突变非自身和更多免疫原性蛋白 - 特别是当它们被多个肿瘤克隆共有时 (由‘truncal''突变引起)
1.肿瘤非同义/移码体细胞突变的数量,可能是通过产生“新抗原” - 突变非自身和更多免疫原性蛋白 - 特别是当它们被多个肿瘤克隆共有时 (由‘truncal''突变引起)
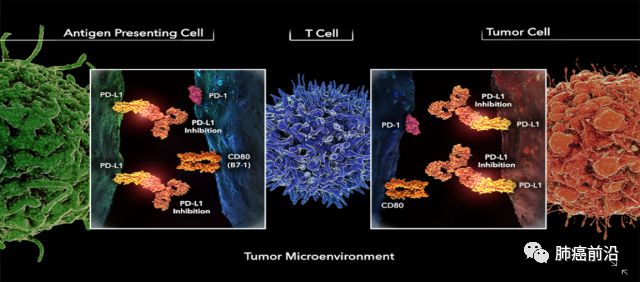
2.在肿瘤细胞或肿瘤浸润性免疫细胞中具有高PD-L1水平的表达,与对PD-1 / PD-L1阻断的临床反应发生率增加相关
3.表达Ki67的循环CD8 + T细胞,与肿瘤负荷 tumor burden有关,,治疗前肿瘤负荷低的患者往往能够在PD-1阻断后Ki67CD8T细胞升高的治疗反应中取得临床疗效。
考虑与检查点阻滞相结合以取得最大化治疗的成功可能性,则应该考虑以下三种策略 :能够增加肿瘤免疫原性,有利于肿瘤内T细胞运输并减少肿瘤负荷
Molecular Basis for Distinct Mechanisms of Action of
CTLA-4 and PD-1 Blockade
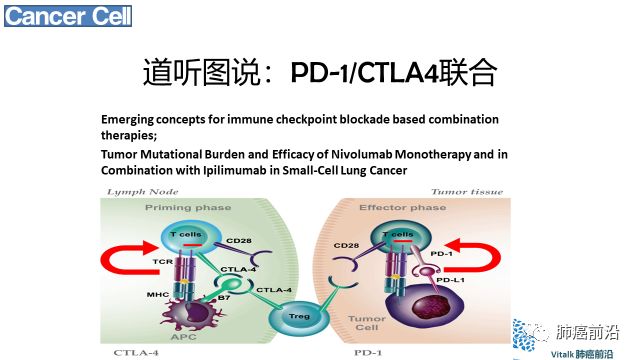
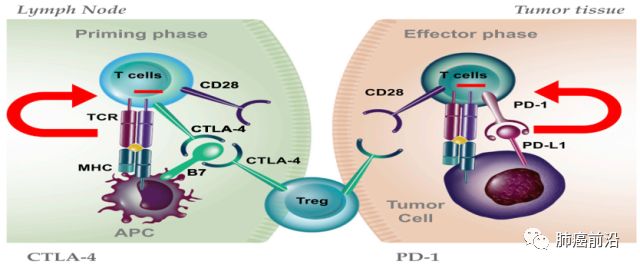 CTLA-4,又名CD152,由CTLA-4基因编码的一种跨膜蛋白质,表达于活化的CD4+和CD8+T细胞,与T细胞表面的协同刺激分子受体(CD28)具有高度的同源性。CTLA-4和CD28均为免疫球蛋白超家族成员,二者与相同的配体CD86(B7-2)和CD80(B7-1)结合。CTLA-4的免疫调控功能的关键体现在控制CD4+FoxP3-、CD8+T细胞以及调节性T细胞(Treg)。CTLA-4能够中止激活的T细胞的反应(T cell response)以及介导Treg的抑制功能。目前的研究表明CTLA-4抑制T细胞的反应主要是通过两种途径(如图二):一是通过与CD28竞争性的结合B7或者招募磷酸酶到CTLA-4的胞内结构域部分从而降低TCR(T cell receptor)和CD28的信号。另一种是降低CD80和CD86在抗原呈递细胞(APC)的表达水平或者通过转胞吞作用(transendocytosis)将它们从APC移除,这样就减少了CD28参与进行T细胞激活。
CTLA-4,又名CD152,由CTLA-4基因编码的一种跨膜蛋白质,表达于活化的CD4+和CD8+T细胞,与T细胞表面的协同刺激分子受体(CD28)具有高度的同源性。CTLA-4和CD28均为免疫球蛋白超家族成员,二者与相同的配体CD86(B7-2)和CD80(B7-1)结合。CTLA-4的免疫调控功能的关键体现在控制CD4+FoxP3-、CD8+T细胞以及调节性T细胞(Treg)。CTLA-4能够中止激活的T细胞的反应(T cell response)以及介导Treg的抑制功能。目前的研究表明CTLA-4抑制T细胞的反应主要是通过两种途径(如图二):一是通过与CD28竞争性的结合B7或者招募磷酸酶到CTLA-4的胞内结构域部分从而降低TCR(T cell receptor)和CD28的信号。另一种是降低CD80和CD86在抗原呈递细胞(APC)的表达水平或者通过转胞吞作用(transendocytosis)将它们从APC移除,这样就减少了CD28参与进行T细胞激活。
PD-1(亦称CD279)是一种外周组织和肿瘤微环境中T细胞活性的负调节因子。Pd-1在肿瘤浸润淋巴细胞(TILs;主要是CD4+T细胞)、B细胞、自然杀伤细胞、单核细胞和树突状细胞中均有表达。PD-1有两个内源性配体:PD-L1(又称B7-H1和CD 274)和PD-L2 (又称B7‑DC 和CD273)。PD-L1(B7-H1)属于B7家族,常在人体肿瘤细胞表面上调。PD-L1表达广泛,在肿瘤微环境中表达,包括在癌细胞和肿瘤浸润巨噬细胞中都有表达。PD-L1比PD-L2表达更为广谱,主要在造血和非造血细胞(包括上皮细胞、血管上皮细胞、基质细胞等)中,由促炎症细胞因子(proinflammtory cytokine,包括I型和II型Interferon, TNFα以及VEGF)诱导表达。表达的PD-L1诱导抗肿瘤T淋巴细胞的凋亡。PD-L2主要由抗原呈递细胞表达。
CTLA-4通常可以作为早期免疫检查点,控制T细胞活化和诱导所需的代谢开关,以及PD -1作为后期免疫检查点,保持活化的抗原特异性T细胞的功能和代谢。
因此,CTLA-4和PD-1抑制剂的联合作用可能依赖于抗CTLA-4介导的对T细胞的动员作用(priming))从而发挥PD-1 / PD-L1抑制上调T细胞功能效应,从而导致更有效的抗 - 肿瘤反应。然而,只有在免疫原性肿瘤抗原被表达并适当呈递给T细胞时,这种作用机制才成立。 例如,免疫耐受的临床前模型中,CTLA-4阻断剂不能逆转免疫耐受,除非其与高剂量肿瘤抗原一起使用(Eagar et al,2002)。这可以解释为什么抗CTLA-4更有可能在具有高肿瘤突变负荷和新抗原负荷的癌症患者中实现长期的临床益处。
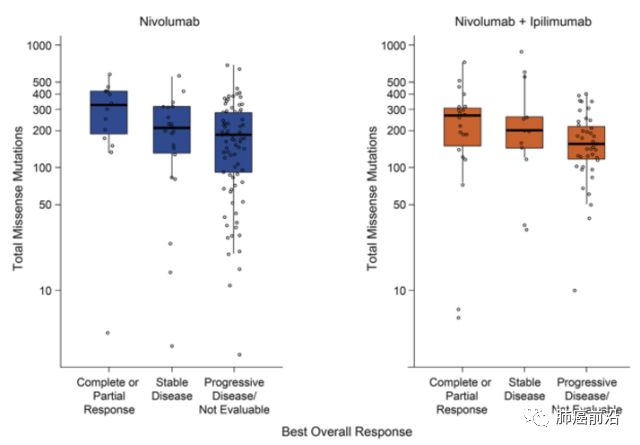
尚无法推论对于小细胞肺癌,肿瘤突变负荷是否提供了足够的治疗决策相关信息。鉴于小细胞肺癌患者与吸烟几乎普遍相关,肿瘤突变负担很高,但范围相对较窄(Alexandrov等,2013)。目前尚不清楚是否有足够的分子多样性来鉴定具有不同临床反应的亚组,以指导免疫治疗;然而,免疫治疗的临床获益见于突变负荷最高的患者中。此外,有人推测,鉴于SCLC肿瘤中使用的小活检组织和坏死组织,肿瘤突变负荷分析可能不可行。在这项回顾性分析中,61%的患者有足够的肿瘤活检材料和全血样本以进行WES分析。由于WES分析非预先设计,组织对合格性的要求相对较低,这种分析的成功率可能比预期的要好。此外,绝大多数(86%)这些患者中,WES和回顾性的肿瘤突变负荷都是可实现的。总体而言,分析表明,SCLC检测肿瘤突变负荷的分子分析是可行的,通过未来的努力可能实现更高的成功率。
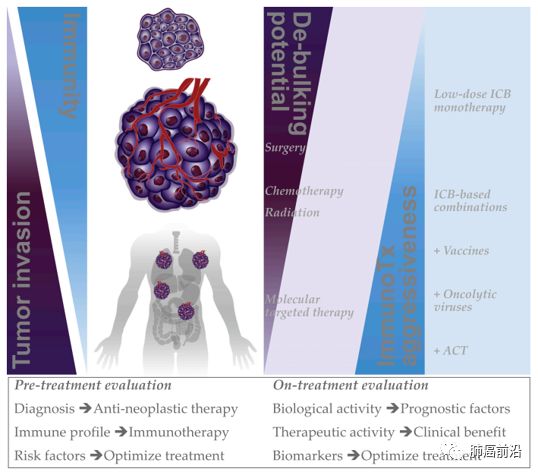
Selection and optimization of immunotherapy –based combinations
根据不同抗肿瘤方法针对肿瘤不同阶段和不同免疫原性的抗肿瘤活性的相互作用水平提出治疗组合的策略,以提高抗肿瘤活性。
预计肿瘤侵袭的程度与免疫原性和/或免疫功能成反比。
考虑到减少肿瘤负荷可能有助于维持持久的免疫,合理的做法是将治疗与具有最大缩瘤潜能的治疗方法(Debulking)结合在一起,这种免疫疗法(ImmunoTx)可以最好地支撑持续抗肿瘤活性。
这种策略还可以确保免疫疗法的适当剂量以限制免疫相关不良事件的发生。提供动态的生物标志物和对治疗反应的检测,将允许及时和针对患者的治疗组合进行优化。















 苏公网安备32059002004080号
苏公网安备32059002004080号


