
免疫治疗包括激活免疫疗法和抑制免疫疗法,分别通过诱导、增强或抑制免疫应答来治疗疾病。广义来说,基于人体免疫系统,例如免疫分子(如抗体、细胞因子治疗等)、免疫细胞(如体外提取和/或扩增的淋巴细胞、巨噬细胞、树突状细胞、天然杀伤细胞、血小板等)而开发的治疗方案都属于免疫治疗的范畴。
在癌症治疗方面,传统的治疗方法包括细菌/病毒感染增强免疫反应、肿瘤疫苗免疫等。最早的肿瘤免疫治疗案例可以追溯到1893年,纽约骨科医生William Coley意外地发现,骨肉瘤患者在手术切除肿瘤后被化脓性链球菌感染能够导致癌症消退,这是感染促进免疫反应从而治愈癌症的实例;溶瘤病毒治疗更是一种具有上百年研究历史的免疫治疗策略,但是长期以来成效甚微,随着基因工程技术的进步、病毒改造技术的完善,溶瘤病毒疗法才有了进展。目前,FDA批准上市的溶瘤病毒只有一种,即2015年10月批准上市的lmlygic (Talimogene laherparepvec),也称为T-VEC,一种经过基因改造的单纯疱疹病毒,用于皮肤及淋巴结黑色素瘤的治疗。一项在436位不可切除的黑色素瘤患者中的III期临床试验显示,接受Imlygic治疗的研究受试者有16.3%的人其皮肤及淋巴结中黑色素瘤病灶减小,并且这种减小持续至少6个月,相比之下,接受对照药物治疗的受试者中仅有2.1%的人病灶减小[1];癌症疫苗通常是利用树突细胞负载肿瘤特异抗原递呈并激活宿主T细胞引发抗瘤免疫应答。然而目前为止,无论使用单一抗原(如MAGE-A3用于非小细胞肺癌)、还是癌细胞裂解物(如GVAX)都没有取得明显进展,目前全球只有1个治疗性DC疫苗Sipuleucel-T(Provenge)被批准上市,包括患者DC提取、荷载前列腺癌特异抗原、回输体内等多个步骤。患者死亡风险降低了33%,显示了一定的生存改善[2]。
近年来,新兴的肿瘤免疫疗法蓬勃发展。1984年,美国国立癌症研究院(NCI)的Steven Rosenberg团队首次应用大剂量IL-2与LAK细胞协同治疗25例肾细胞癌、黑素瘤、肺癌、结肠癌等肿瘤患者,其中11例肿瘤缩小超过50%,1名33岁的转移性黑色素瘤患者肿瘤完全消退,给肿瘤免疫治疗带来一线曙光。这是癌症“过继细胞疗法”(Adoptive cell transfer,ACT)成功的首个例子。1988年Steven Rosenberg团队总结了IL-2与LAK细胞协同治疗222例肿瘤患者的整体疗效,指出其中16例患者肿瘤转移灶完全消退,26例患者肿瘤消退50%以上,提示该疗法对转移性肾细胞癌、黑素瘤、结肠癌和非何杰金氏淋巴瘤患者的疗效较显著 [3, 4]。LAK细胞是指淋巴因子激活的杀伤细胞(lymphokine activated killer cells),将外周血淋巴细胞在体外经IL-2激活3~5天而扩增为具有广谱抗瘤作用的杀伤细胞,先后有多个基于LAK细胞的临床试验显示其具有一定的疗效;然而,大剂量IL-2的副作用很大,因此研究者们尝试了一系列新型细胞疗法,采用体外提取/筛选、活化并回输自体/异体CIK、肿瘤特异性T细胞、肿瘤部位浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)等细胞进行肿瘤过继免疫治疗,显示了一定的刺激机体免疫系统、杀伤肿瘤、延长患者生存期和/或无进展病程的疗效[5-8]。例如,1986年Steven Rosenberg研究组首先报道了肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)[9];1991年,Weissman首次报道了在荷瘤小鼠进行CIK(cytokine induced killer)细胞疗法的评估[10];2002年,Steven Rosenberg团队在Science杂志发文称,在转移性黑素瘤患者中过继输注肿瘤特异性T细胞,能够使得患者的癌症消退[11]等。值得一提的是,CIK细胞在发现之初是一群正常人外周血中只占1~5%的CD3+CD56+、CD3+CD8+ T淋巴细胞,该细胞群可以在IL-2、IFN-γ等细胞因子及单抗(如抗CD3单抗)的刺激下,在体外由从外周血、骨髓或脐血中分离出来的单个核细胞培养扩增而成,具有非MHC限制的广泛的强杀瘤活性,故又称为NK 细胞(自然杀伤细胞)样 T 淋巴细胞。由于利益驱使、国内患者需求以及临床科研大环境的推动, CIK细胞免疫疗法一度在国内临床实践中异常火爆,曾被认为是国内癌症临床治疗赶超国外的契机。然而,2016年发生的魏则西事件将DC-CIK细胞治疗技术推上了风口浪尖,揭露了细胞免疫疗法在国内临床界的乱象,一夜之间相关临床试验便陷入停滞。DC-CIK细胞治疗技术是一个具有中国特色的词语,是将DC细胞和CIK联合对患者进行过继免疫治疗。在pubmed搜索DC-CIK,共89篇论文,几乎全部都是中国研究者发表的,署名作者中单位为USA的只有2篇,且这2篇文章第一作者均为国内的临床医生。曾几何时,国内进行基础研究的有识之士大声疾呼取消/禁止乱象纷呈的细胞免疫治疗,代替以国外已经经过临床试验证实的、真正有效的/已上市的免疫疗法并将其纳入医保,例如治疗性抗体、免疫检查点(Immuno-checkpoint)抗体、CAR-T疗法等。近年来,癌症免疫治疗发展迅猛,特别是抗体药物的发展令人瞩目,截止2016年底,FDA先后批准了约五十种抗体药物上市,其中大多数是针对癌症治疗的单抗药物。目前,基于抗体发展的多种肿瘤治疗的策略中,除了直接靶向癌细胞表面特殊抗原(如CD20、HER2等)外,还有靶向血管生成因子VEGF切断肿瘤营养供给、双功能抗体(如BiTE)、放射物质/毒素偶联“裸抗”杀伤活性的模式。特别是近年来阻断CTLA4、PD-1/PD-L1等免疫检查点分子从而增强T细胞杀伤活性、基于单链抗体(ScFv)的结构设计嵌合抗原受体T细胞(Chimeric Antigen Receptor–Modified T Cells,CART)等新型免疫疗法均在临床上取得了突出的疗效,被认为是最具前景的肿瘤免疫治疗策略(图1)[12]。2012年,Carl H. June使用CAR-T疗法治愈了6岁患白血病女孩Emily,引起了全球轰动,而到目前为止,Emily的癌细胞已经完全消失了5年。2013年,《科学》杂志将免疫治疗列为年度十大科学突破之首,这也让免疫疗法再次成为全球研发的热点。
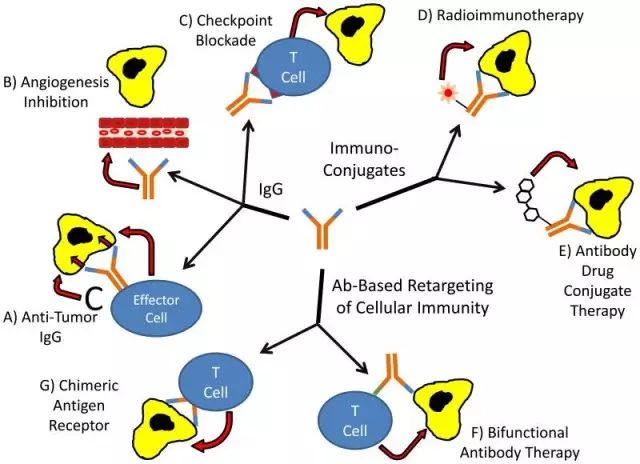
图1 基于抗体的癌症治疗策略
一、肿瘤免疫调节抗体
众所周知,体内表达TCR的T细胞是参与特异性免疫应答的主要细胞,而TCR在特异性识别抗原呈递细胞(antigen-presenting cell,APC)所提呈的抗原肽的过程中,必须同时识别与抗原肽形成复合物的MHC分子;同时,免疫应答还需要免疫调节分子的参与。一般认为,参与机体免疫调节的分子包括以下三类:1、免疫负调控分子,包括表达于活化T细胞表面的CTLA-4、PD-1以及表达于天然杀伤(NK)细胞表面的KIR家族。例如CTLA-4与B7的结合能够有效抑制 T 细胞增殖;2、免疫共刺激受体,包括表达在CD4+和CD8+T细胞表面的TNFR超家族成员OX40、GITR等,如B7与T细胞表面CD28结合能够激活T细胞;3、可溶性免疫抑制因子,如TGFβ1。图2显示了重要的T细胞免疫调节分子[13]。其中,靶向CTLA-4、PD-1等分子的治疗性抗体已经成功上市,为肿瘤治疗开创了新的理念。
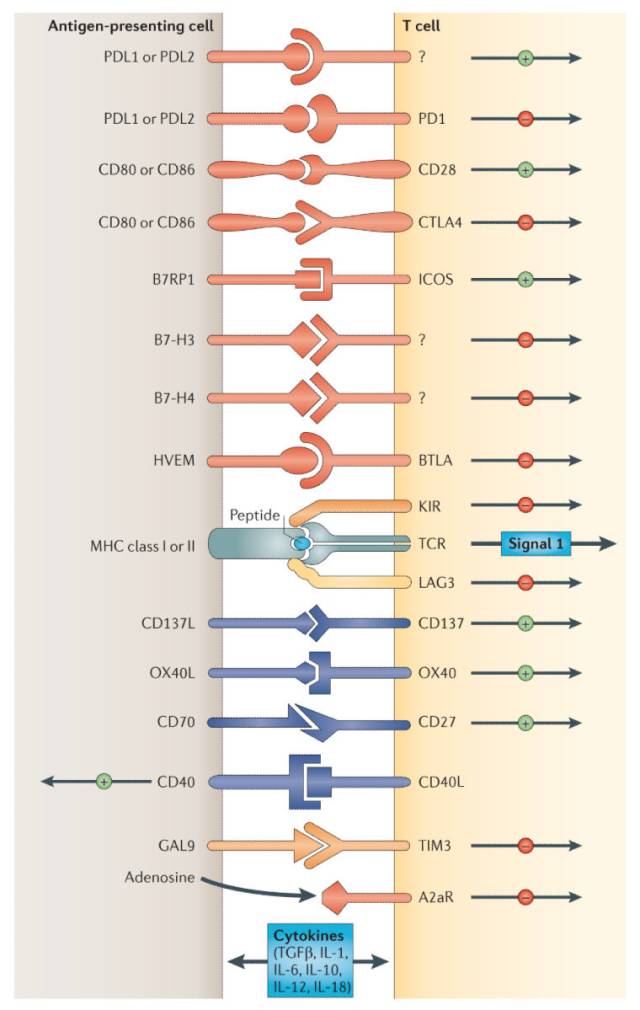
图2 T细胞免疫调节分子
1抗PD-1/PD-L1抗体
PD-1是免疫负性调控分子,与其配体PD-L1或PD-L2作用可下调T细胞活性,使得肿瘤逃逸免疫系统的识别和杀伤,而抗PD-1/PD-L1抗体可以逆转这一抑制效应(图3)。2014年,FDA批准了首个抗PD-1抗体,即默克公司的Keytruda(通用名:pembrolizumab),用于晚期黑色素瘤的治疗。它和后来被批准上市的抗PD-1抗体Opdivo(百时美施贵宝开发,通用名:nivolumab)都曾获得过FDA突破性药物称号。Opdivo被批准的虽然较晚,但是进展迅速,已经被批准用于转移性恶性黑色素瘤、鳞状非小细胞肺癌、肾癌的临床治疗。2015年,美国副总统卡特罹患黑色素瘤并发生脑转移,但仅仅4个月后就传来好消息,卡特的癌症已经被治愈,除了传统的手术、放疗,Keytruda也起了不容忽视的巩固效果。关于PD-1抗体的研究将另文专述。
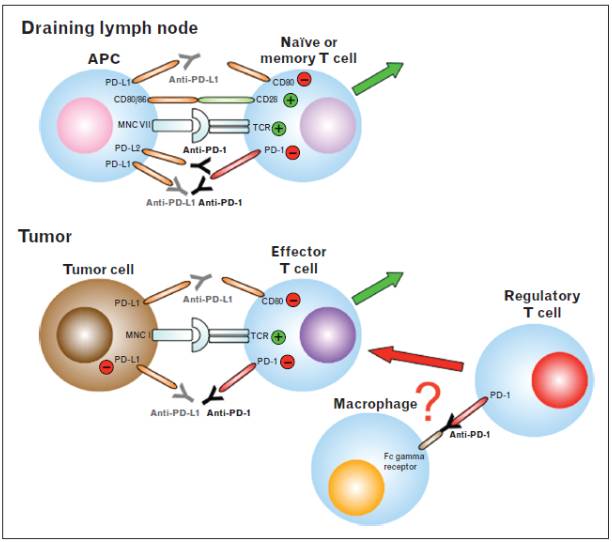
图3 抗PD-1/PD-L1抗体作用机制示意
2抗CTLA-4抗体
CTLA-4全称为细胞毒性T细胞相关抗原-4(cytotoxic T lymphocyteassociated protein 4,亦名CD152),是一种表达于T细胞表面的免疫负调节分子。CTLA-4能够结合APC表面的配体CD80/CD86,抑制T细胞的激活,减弱机体对肿瘤细胞的免疫应答。因此,抗CTLA-4抗体能够恢复T细胞激活信号,增强T细胞活化和增殖,恢复免疫系统识别并攻击癌细胞的能力,通过T细胞介导的免疫应答而发挥抗肿瘤作用[14, 15];此外,抗CTLA-4抗体还可通过Fcγ受体依赖方式介导调节性T细胞的消耗,从而上调效应T细胞的比例,逆转免疫抑制状态的T细胞,增强机体抗肿瘤能力(图4)[16]。
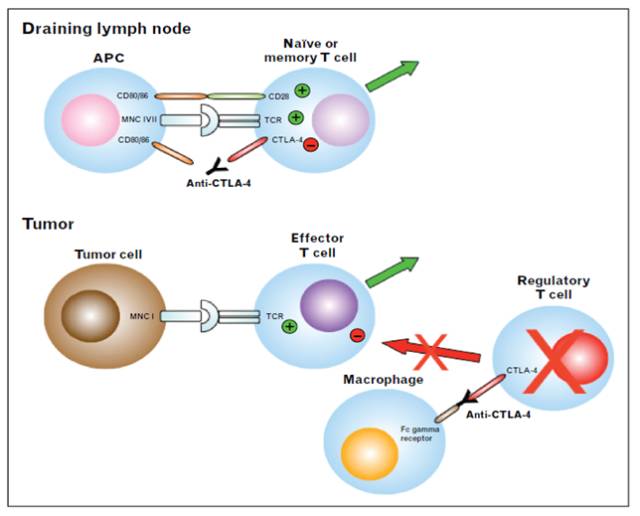
图4 CTLA-4抗体作用机制示意
Ipilimumab/Yervoy是BMS公司研发的抗CTLA-4抗体药物(全人IgG1),于2011年被FDA批准上市,用于不可手术或转移性黑色素瘤患者。实验表明,Ipilimumab使用后可以引起淋巴细胞激活,表明抗体可以增强患者的免疫力[17]。临床数据显示,III或IV期黑色素瘤患者用gp100肽疫苗和/或Ipilimumab 进行治疗后,抗体的使用能够延长总体生存时间,比疫苗单用组增加了3.6个月(10个月 vs 6.4个月)[18];在肺癌中,Lync h等[19]报道了一项Ipilimumab联合紫杉醇/卡铂治疗IIIb/IV期NSCLC的Ⅱ期临床试验,结果显示,Ipilimumab能够延长无疾病进展期,顺序治疗、同步治疗和对照组中位生存期分别为12.2月、9.7月和8.3月,且鳞癌患者优于非鳞癌患者;此外,Ipilimumab对小细胞肺癌也有一定的疗效,联合紫杉醇/卡铂治疗小细胞肺癌(ED-SCLC)的Ⅱ期临床试验中,顺序治疗、同步治疗和对照组中位生存期分别为12.94月、9.13月和9.92月,顺序治疗有改善生存期的趋势[20];阿斯利康公司开发的Tremelimumab是一种抗CTLA-4抗体(全人IgG2),于2015年被FDA批准为孤儿药,用于恶性间皮瘤的治疗[21, 22]。尽管如此,tremelimumab未能改善IIb期患者的生存期,因此,Tremelimumab被列为不可切除的恶性间皮瘤的二或三线治疗方案。目前,Tremelimumab在其他肿瘤中的临床试验也正在开展,但是还没有适应症获批。同时,阿斯利康正在将Tremelimumab与旗下抗PD-L1抗体Durvalumab(MEDI4376)组合,在非小细胞肺癌(NSCLC)中进行临床III期试验[23];在转移或复发性胃癌中进行的研究也已经进入临床II期阶段。
除了抗CTLA-4、PD-1/PD-L1等抗体,还有多个免疫调节抗体正处于临床期试验阶段(见表1)。
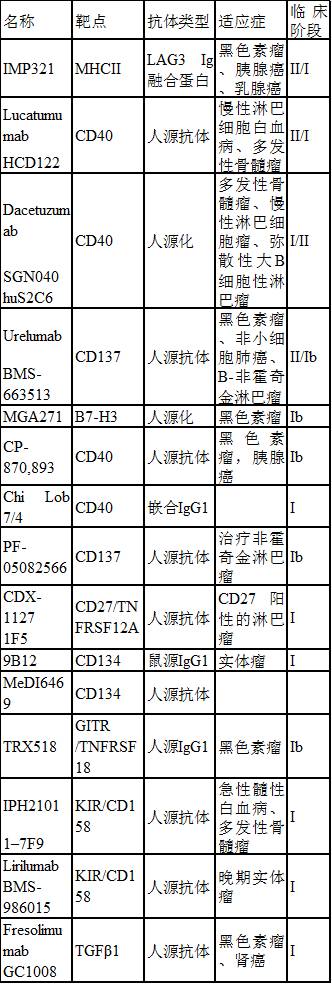
表1 部分处于临床试验的肿瘤免疫调节抗体
二CAR-T
嵌合抗原受体(Chimeric antigen receptor,CAR)是利用逆转录病毒载体将外源抗体/蛋白(如scFv)等呈现在细胞表面所形成的受体。目前广受关注的CAR-T疗法就是将CAR呈现在T细胞表面并进行过继细胞免疫治疗的方法。CAR-T疗法的全称是Chimeric Antigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法。CAR-T是对T细胞进行基因转染,使其表面能够表达特异性识别肿瘤细胞的抗体,从而介导T细胞杀伤癌细胞(图5)。T细胞可以来自于患者自体或者异体,而转染T细胞的方法通常采用慢病毒和逆转录病毒,还有利用SB转座子等系统成功制备的CAR-T细胞的报道[24],显示在晚期非霍奇金淋巴瘤和急性淋巴细胞白血病患者中,CAR-T离体扩增倍数达2200~2500倍,且自体CAR-T治疗后30个月的癌症无进展率和总生存率分别为83%和100%,而同种异体CAR-T治疗后12个月的数据分别为53%和63%。
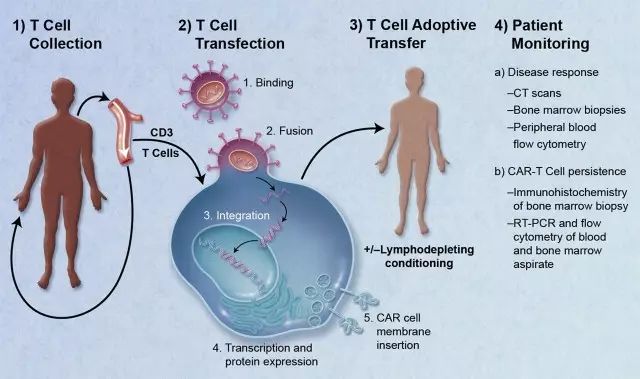
图5 CAR-T细胞过继细胞疗法
最早的CAR-T疗法主要是单一的靶向B淋巴瘤CD19和CD20的scFv。而优化后的CAR-T最常见的形式是scFv与CD3ζ胞内信号域融合,从而在scFv结合癌细胞后传递ζ信号,增强T细胞的杀伤能力。目前在研的CAR-T疗法进一步在此基础上进行了改进,加入了共刺激分子CD28、4-1BB/OX40等,增强了CAR-T细胞的扩增能力和细胞因子分泌水平,延长体内存活时间(图6)。2012年,治愈了Emily的就是诺华开发的二代CD19 CAR-T。随即,Cruz等[25]在同种异体干细胞移植后的B淋巴细胞瘤复发患者中,利用异体T细胞制备CD19 CAR-T进行临床I期研究。结果显示,CAR-T安全有效,8名患者,在血液中可以存活8周,在疾病部位可以持续9周。2例患者肿瘤消退明显,另有2例患者在CAR-T维持期间疾病无进展;Wang等[26]比较了含有CD3ζ结构域的CAR-T(CD19R:ζ)和新一代含有CD28和CD3ζ的CAR-T(CD19R:28ζ)。8例CD19R:ζ治疗患者中,4例在1年和2年后疾病无进展,在8名CD19R:28ζ患者中,6例1年无进展。同时,CD19R:28ζ CAR T细胞的早期增殖较好,尽管持续时间≤28天。在两组中都没有出现严重的细胞因子释放综合征,显示了这种免疫疗法的安全性和可行性(www.clinicaltrials.gov临床试验注册号为#NCT01318317和#NCT01815749)。
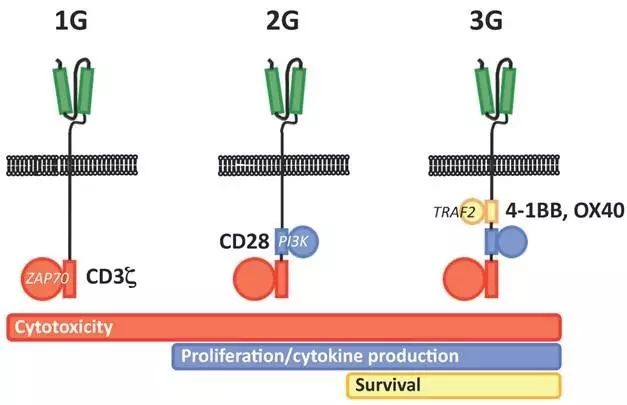
图6 三代CAR-T的结构示意图(绿色为scFv)
诺华开发的CTL019分别于2014、2017年7月连续被FDA给予突破性疗法地位,分别被批准用于治疗儿童和年轻成年患者的复发性/难治性B淋巴瘤、急性淋巴细胞白血病(ALL),以及用于2种或以上治疗方案失败的、复发性和难治性成人弥漫大B淋巴瘤。CTL019是嵌合了CD3ζ/4-1BB胞内域的CD19 CAR-T疗法,利用慢病毒转染T细胞。临床研究显示[27],30名接受CTL019治疗的患者中,27例患者完全缓解,其中包括曾接受单抗治疗复发和骨髓移植的患者。6个月后无进展生存率为67%,总生存率为78%。即使在干细胞移植失败的患者中,也观察到长达24个月的病情持续缓解。所有患者都有细胞因子释放综合征,利用抗IL-6受体抗体tocilizumab能够有效控制(ClinicalTrials.gov编号NCT01626495和NCT01029366)。不过,CTL019也存在副作用,需要良好的临床护理和干预。例如,39名复发/难治性急性淋巴细胞白血病患者中开展的CTL019临床I/IIa期试验结果显示,18例发生3-4级细胞因子释放综合征,出现发烧、高铁蛋白血症、器官功能障碍。14例心血管功能障碍,6例发生急性呼吸衰竭等急性临床反应[28]。2017年8月30日,FDA批准了诺华公司的CAR-T疗法CTL-019(tisagenlecleucel-T)上市,目前仅用于治疗25岁以下的难治性、复发性白血病患者。FDA同日批准了人源化抗人IL-6单抗Actemra(tocilizumab)的新适用症,用于治疗CAR-T细胞治疗引起的细胞因子释放综合征。
除了CTL019,针对CD19分子的CAR-T疗法还有JUNO公司的JCAR014、JCAR015、JCAR017,以及Kite公司开发的axicabtagee ciloleucel(KTE-C19)。其中,KTE-C19 [29] 是嵌合了CD3ζ/CD28胞内域的CD19 CAR-T疗法,利用逆转录病毒转染T细胞。在7例难治性弥漫性大B细胞淋巴瘤患者中的研究显示,5例患者对KTE-C19治疗有应答,4例完全缓解,3例随访超过12个月,且病情持续缓解;CAR-T细胞在2周内达到峰值扩张,并且能够连续12个月被持续检测到。副作用方面,发生1例4级细胞因子释放综合征,4例神经毒性,但在1个月内这些严重反应均被控制。在101例非霍奇金淋巴瘤患者中,客观缓解率高达82%,在8.7个月的中位随访时间内,44%的患者持续缓解,其中39%为完全缓解。KTE-C19于2017年5月获得FDA的优先审评资格,7月31日获得EMA的加速审批资格,适应症为弥漫性大B 细胞淋巴瘤/原发性纵隔B 细胞淋巴瘤/转化的滤泡性淋巴瘤,有望在2017年底前上市。
此外,FDA已经批准了Kite 公司CAR-T疗法KITE-585的申请,近期将启动1期临床试验,用于多发性骨髓瘤的治疗。KITE-585的靶点是BCMA蛋白,表达于大部分此类患者的恶性浆细胞表面,而且除了正常浆细胞和特定的成熟B细胞,其他组织不会表达BCMA,可以预见KITE-585较强的特异性和靶向性。
近期,iCell开发的CD4CAR由FDA授予孤儿药资格,用于治疗CD4+T淋巴瘤。CD4CAR是基于CD8+细胞毒性T细胞(CTL)开发的CAR-T疗法,使其表达抗CD4抗体,识别CD4+T淋巴瘤细胞。体外数据显示,CD4CAR T细胞能够识别CD4+细胞,有效地清除CD4+肿瘤细胞系和原发性患者CD4+肿瘤细胞。体内试验显示,CD4CAR T细胞显著延长了小鼠的存活时间 [30]。
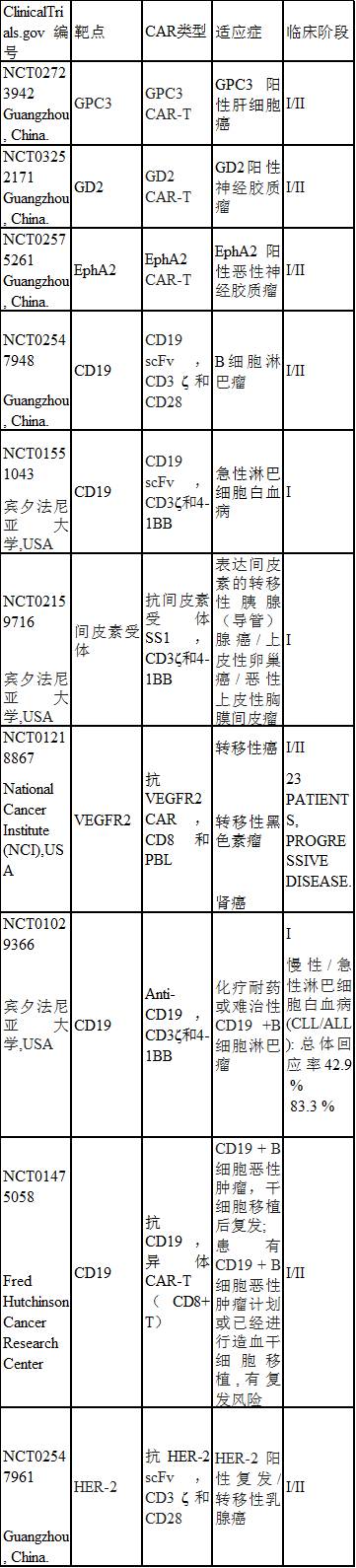
除了以上CAR-T疗法实例,目前还有很多临床试验正在进行中(表2)。需要注意的是,CAR-T还存在明显的不足,例如费用高、患者个体化差异大、人工制备T细胞对技术的要求高、攻击正常组织产生“脱靶效应”等,而且在实体瘤中的疗效还有待评价,特别是容易产生严重的细胞因子释放综合征,需要在治疗过程中严密监控并加强护理。例如,Lee等[31]利用CD19 CAR-T进行的临床I期研究中,19例急、慢性淋巴细胞白血病或B淋巴瘤患者接受了治疗,其中3例发生4级细胞因子释放综合征、9例发热、9例低血钾症等。特别是在使用新一代CAR-T时更需要小心,因为CAR-T细胞体内清除更慢。此外,未来对于CAR-T疗法靶点的选择也需要更深入的研究。例如,目前认为,肿瘤干细胞是肿瘤分化增殖的关键因素,它参与肿瘤的发生、转移、进展以及耐药,因此,制备肿瘤干细胞特异性靶抗原CAR-T或许可以从“源头”抑制肿瘤。这些靶抗原可能包括CD44、CD133、ABCG2等。
表2 部分已完成的CAR-T临床试验 (截止2017.8)
1.Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J, Delman KA, Spitler LE, Puzanov I, Agarwala SS et al: Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2015, 33(25):2780-2788.
2.Higano CS, Schellhammer PF, Small EJ, Burch PA, Nemunaitis J, Yuh L, Provost N, Frohlich MW: Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel-T in advanced prostate cancer. Cancer 2009, 115(16):3670-3679.
3.Mule JJ, Shu S, Schwarz SL, Rosenberg SA: Adoptive immunotherapy of established pulmonary metastases with LAK cells and recombinant interleukin-2. Science 1984, 225(4669):1487-1489.
4.Lee RE, Lotze MT, Skibber JM, Tucker E, Bonow RO, Ognibene FP, Carrasquillo JA, Shelhamer JH, Parrillo JE, Rosenberg SA: Cardiorespiratory effects of immunotherapy with interleukin-2. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 1989, 7(1):7-20.
5.Fujita K, Ikarashi H, Takakuwa K, Kodama S, Tokunaga A, Takahashi T, Tanaka K: Prolonged disease-free period in patients with advanced epithelial ovarian cancer after adoptive transfer of tumor-infiltrating lymphocytes. Clinical cancer research : an official journal of the American Association for Cancer Research 1995, 1(5):501-507.
6.Kimura H, Yamaguchi Y: A phase III randomized study of interleukin-2 lymphokine-activated killer cell immunotherapy combined with chemotherapy or radiotherapy after curative or noncurative resection of primary lung carcinoma. Cancer 1997, 80(1):42-49.
7.Takayama T, Sekine T, Makuuchi M, Yamasaki S, Kosuge T, Yamamoto J, Shimada K, Sakamoto M, Hirohashi S, Ohashi Y et al: Adoptive immunotherapy to lower postsurgical recurrence rates of hepatocellular carcinoma: a randomised trial. Lancet 2000, 356(9232):802-807.
8.Kono K, Takahashi A, Ichihara F, Amemiya H, Iizuka H, Fujii H, Sekikawa T, Matsumoto Y: Prognostic significance of adoptive immunotherapy with tumor-associated lymphocytes in patients with advanced gastric cancer: a randomized trial. Clinical cancer research : an official journal of the American Association for Cancer Research 2002, 8(6):1767-1771.
9.Rosenberg SA, Spiess P, Lafreniere R: A new approach to the adoptive immunotherapy of cancer with tumor-infiltrating lymphocytes. Science 1986, 233(4770):1318-1321.
10.Schmidt-Wolf IG, Negrin RS, Kiem HP, Blume KG, Weissman IL: Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. The Journal of experimental medicine 1991, 174(1):139-149.
11.Dudley ME, Wunderlich JR, Robbins PF, Yang JC, Hwu P, Schwartzentruber DJ, Topalian SL, Sherry R, Restifo NP, Hubicki AM et al: Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes. Science 2002, 298(5594):850-854.
12.Weiner GJ: Building better monoclonal antibody-based therapeutics. Nature reviews Cancer 2015, 15(6):361-370.
13.Pardoll DM: The blockade of immune checkpoints in cancer immunotherapy. Nature reviews Cancer 2012, 12(4):252-264.
14.Freeman GJ, Gribben JG, Boussiotis VA, Ng JW, Restivo VA, Jr., Lombard LA, Gray GS, Nadler LM: Cloning of B7-2: a CTLA-4 counter-receptor that costimulates human T cell proliferation. Science 1993, 262(5135):909-911.
15.Linsley PS, Greene JL, Brady W, Bajorath J, Ledbetter JA, Peach R: Human B7-1 (CD80) and B7-2 (CD86) bind with similar avidities but distinct kinetics to CD28 and CTLA-4 receptors. Immunity 1994, 1(9):793-801.
16.Blank CU: The perspective of immunotherapy: new molecules and new mechanisms of action in immune modulation. Current opinion in oncology 2014, 26(2):204-214.
17.Matzinger P, Kamala T: Tissue-based class control: the other side of tolerance. Nature reviews Immunology 2011, 11(3):221-230.
18.Hodi FS, O'Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, Gonzalez R, Robert C, Schadendorf D, Hassel JC et al: Improved survival with ipilimumab in patients with metastatic melanoma. The New England journal of medicine 2010, 363(8):711-723.
19.Lynch TJ, Bondarenko I, Luft A, Serwatowski P, Barlesi F, Chacko R, Sebastian M, Neal J, Lu H, Cuillerot JM et al: Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2012, 30(17):2046-2054.
20.Reck M, Bondarenko I, Luft A, Serwatowski P, Barlesi F, Chacko R, Sebastian M, Lu H, Cuillerot JM, Lynch TJ: Ipilimumab in combination with paclitaxel and carboplatin as first-line therapy in extensive-disease-small-cell lung cancer: results from a randomized, double-blind, multicenter phase 2 trial. Annals of oncology : official journal of the European Society for Medical Oncology 2013, 24(1):75-83.
21.Calabro L, Morra A, Fonsatti E, Cutaia O, Fazio C, Annesi D, Lenoci M, Amato G, Danielli R, Altomonte M et al: Efficacy and safety of an intensified schedule of tremelimumab for chemotherapy-resistant malignant mesothelioma: an open-label, single-arm, phase 2 study. The Lancet Respiratory medicine 2015, 3(4):301-309.
22.Calabro L, Morra A, Fonsatti E, Cutaia O, Amato G, Giannarelli D, Di Giacomo AM, Danielli R, Altomonte M, Mutti L et al: Tremelimumab for patients with chemotherapy-resistant advanced malignant mesothelioma: an open-label, single-arm, phase 2 trial. The Lancet Oncology 2013, 14(11):1104-1111.
23.Planchard D, Yokoi T, McCleod MJ, Fischer JR, Kim YC, Ballas M, Shi K, Soria JC: A Phase III Study of Durvalumab (MEDI4736) With or Without Tremelimumab for Previously Treated Patients With Advanced NSCLC: Rationale and Protocol Design of the ARCTIC Study. Clinical lung cancer 2016, 17(3):232-236 e231.
24.Kebriaei P, Singh H, Huls MH, Figliola MJ, Bassett R, Olivares S, Jena B, Dawson MJ, Kumaresan PR, Su S et al: Phase I trials using Sleeping Beauty to generate CD19-specific CAR T cells. The Journal of clinical investigation 2016, 126(9):3363-3376.
25.Cruz CR, Micklethwaite KP, Savoldo B, Ramos CA, Lam S, Ku S, Diouf O, Liu E, Barrett AJ, Ito S et al: Infusion of donor-derived CD19-redirected virus-specific T cells for B-cell malignancies relapsed after allogeneic stem cell transplant: a phase 1 study. Blood 2013, 122(17):2965-2973.
26.Wang X, Popplewell LL, Wagner JR, Naranjo A, Blanchard MS, Mott MR, Norris AP, Wong CW, Urak RZ, Chang WC et al: Phase 1 studies of central memory-derived CD19 CAR T-cell therapy following autologous HSCT in patients with B-cell NHL. Blood 2016, 127(24):2980-2990.
27.Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, Chew A, Gonzalez VE, Zheng Z, Lacey SF et al: Chimeric antigen receptor T cells for sustained remissions in leukemia. The New England journal of medicine 2014, 371(16):1507-1517.
28.Fitzgerald JC, Weiss SL, Maude SL, Barrett DM, Lacey SF, Melenhorst JJ, Shaw P, Berg RA, June CH, Porter DL et al: Cytokine Release Syndrome After Chimeric Antigen Receptor T Cell Therapy for Acute Lymphoblastic Leukemia. Critical care medicine 2017, 45(2):e124-e131.
29.Locke FL, Neelapu SS, Bartlett NL, Siddiqi T, Chavez JC, Hosing CM, Ghobadi A, Budde LE, Bot A, Rossi JM et al: Phase 1 Results of ZUMA-1: A Multicenter Study of KTE-C19 Anti-CD19 CAR T Cell Therapy in Refractory Aggressive Lymphoma. Molecular therapy : the journal of the American Society of Gene Therapy 2017, 25(1):285-295.
30.Pinz K, Liu H, Golightly M, Jares A, Lan F, Zieve GW, Hagag N, Schuster M, Firor AE, Jiang X et al: Preclinical targeting of human T-cell malignancies using CD4-specific chimeric antigen receptor (CAR)-engineered T cells. Leukemia 2016, 30(3):701-707.
31.Lee DW, Kochenderfer JN, Stetler-Stevenson M, Cui YK, Delbrook C, Feldman SA, Fry TJ, Orentas R, Sabatino M, Shah NN et al: T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial. Lancet 2015, 385(9967):517-528.















 苏公网安备32059002004080号
苏公网安备32059002004080号


